二硫键介导的肿瘤微环境智能响应型抗肿瘤药物递送系统的研究进展
钞艳惠,高梅梅,聂安政,孙丙军,杜书章*,聂会娟*(.郑州大学第一附属医院,郑州 450000;.沈阳药科大学,沈阳 006)
肿瘤严重威胁着人类的健康[1]。化疗是目前肿瘤治疗的主要手段,尤其是对于不能通过手术治疗和已发生转移扩散的肿瘤,然而,化疗药物一般具有水溶性差、生物利用度低和全身毒性严重等问题[2]。随着纳米技术在药物传递领域的广泛应用,这些问题有所改善。但目前临床应用的纳米制剂还存在着载药量低、稳定性差、载体材料相关的毒副作用、药物在贮存过程中的结晶和渗漏等缺点[3-5]。因此,设计和构建高效低毒纳米药物传递系统仍然是一个亟待解决的难题。前药是一类药理活性很小或无药理活性的药物衍生物,给药后可在体内进行生物转化,产生活性代谢物,发挥治疗作用。前药策略通过对药物分子中羟基、胺基等官能团进行可断裂化学键修饰,能够克服药物分子存在的理化性质的缺陷,改变药物的溶解度、稳定性等关键的生物药剂学性质,对提高化疗药物的治疗效率有重要意义[6]。
相较于正常组织,肿瘤部位代谢和增殖异常,具有非常复杂且异质性高的微环境,其特征主要包括乏氧、微酸性、高还原性、高活性氧(reactive oxygen species,ROS)、蛋白酶及酯酶等的过表达[7]。谷胱甘肽(glutathione,GSH)是哺乳动物细胞中含量最丰富的硫醇,具有还原性,谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)维持着细胞内的氧化还原平衡[8]。细胞内过量的ROS 不利于细胞氧化还原平衡的维持,进而导致癌症等疾病的发生。肿瘤微环境中H2O2的浓度比正常组织高近100 倍,高达100 μmol·L-1[9]。肿瘤部位特殊的微环境已被广泛用来设计各种刺激响应型纳米药物递送系统,即使用不同类型的敏感键构建纳米前药或纳米载体,也可使化疗药物选择性在肿瘤组织中富集,并在肿瘤部位响应性释放,这一策略显著提高了抗肿瘤药物的递送效率,达到增效减毒的治疗效果[10]。
二硫键具有独特的化学性质,在硫醇的存在下可生物降解,且对不同浓度GSH 刺激的响应性有明显差别,二硫键还能够在肿瘤内部高ROS 水平的环境中发生氧化反应增加药物递送体系的亲水性,有利于基于二硫键的载体或前药发生水解反应,促进纳米粒解体和药物释放。因此,二硫键已被广泛用来设计氧化还原敏感的前药和纳米药物载体,用于抗肿瘤药物和荧光探针等的递送[11]。目前二硫键在氧化还原刺激响应型纳米递药系统中的应用主要包括二硫键作为药物、药物与载体、载体之间的连接剂以及药物载体中的交联剂[12],如表1所示。二硫键修饰的纳米药物递送系统在进入肿瘤细胞之前可以稳定存在,在肿瘤细胞中高浓度GSH 或ROS 条件下,基于二硫键的纳米前药或纳米药物载体可迅速降解释放抗肿瘤药物,有效避免药物的过早释放对正常组织细胞产生的毒副作用。这一策略为改善抗肿瘤药物的药动学性质、提高药效提供了一种新的式范。

表1 二硫键在构建氧化还原响应型药物递送系统中的应用Tab 1 Disulfide bond in the construction of redox responsive drug delivery system
1 二硫键氧化还原响应药物递送系统设计原理
与正常细胞相比,肿瘤细胞内存在更高浓度的ROS 和GSH[13]。GSH 在肿瘤细胞内部环境高表达,研究报道肿瘤细胞中的GSH 水平是血浆中的1000 倍,且至少比正常细胞高4 倍[13]。这种浓度差异为基于二硫键的氧化还原响应型纳米给药系统的特异性药物释放提供了先决条件。相较于正常细胞,肿瘤细胞还能不断产生高水平的ROS,例如过氧化氢、羟基自由基和超氧化物[14-15]。包含二硫键、硼酸酯、二茂铁等ROS 响应性基团的纳米药物递送系统可以针对ROS 高表达的特定部位特异性释放药物[16]。
具有二硫键的纳米药物递送系统在肿瘤细胞内刺激响应释药机制如图1所示。二硫键在包含巯基官能团的还原性物质(如GSH)作用下断裂形成硫醇,实现递药体系药物释放[13]。二硫键的氧化响应能力表现为在体内强氧化自由基(如ROS)作用下,被氧化成砜或者亚砜,使递药体系亲水性增强,促进药物载体解体进而释放药物[17]。
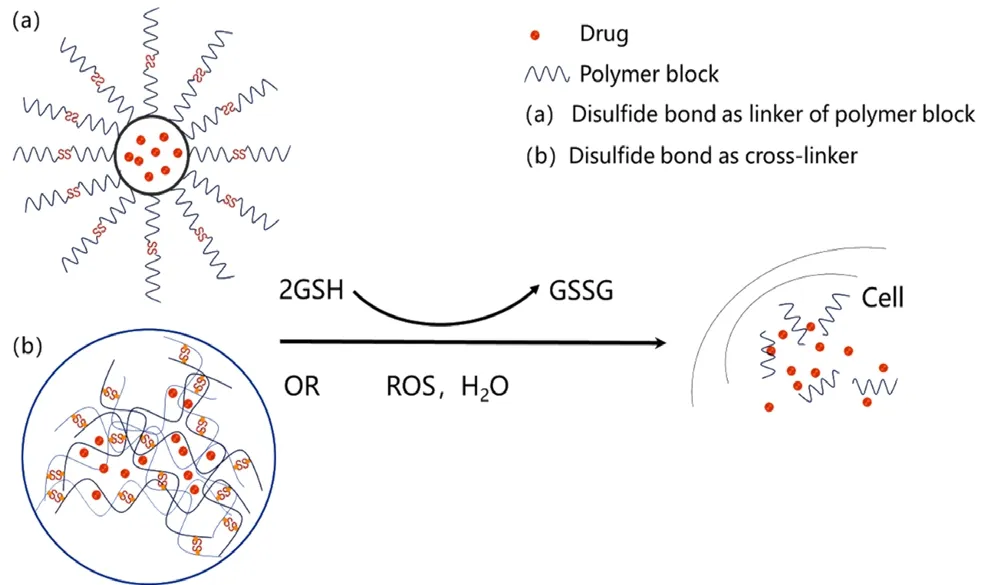
图1 基于二硫键的聚合物纳米载体氧化还原(GSH/ROS)响应释药机制Fig 1 Redox(GSH/ROS)responsive mechanism of polymer nanocarriers conjugating via disulfide bond
二硫键桥联前药与基于二硫键的纳米载体具有相似的氧化还原响应性,即肿瘤细胞内高浓度的GSH 或ROS 有利于二硫键桥联前药的水解进而发挥药效,其具体释药机制如图2所示。
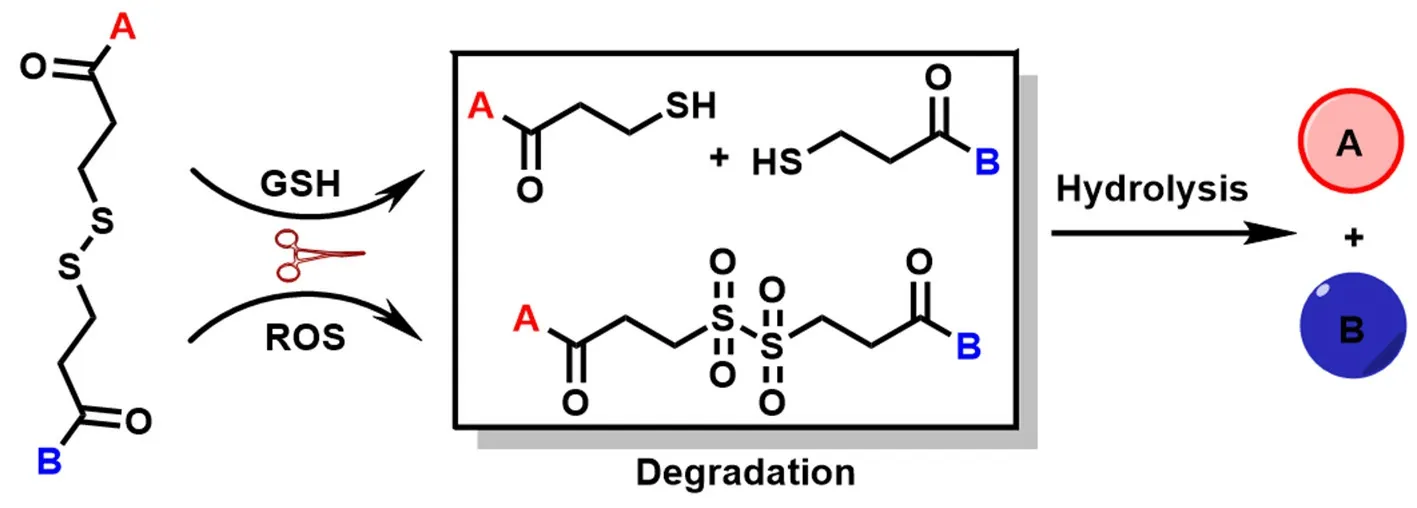
图2 二硫键桥联前体药物氧化还原(GSH/ROS)响应释药机制Fig 2 Redox(GSH/ROS)responsive mechanism of disulfide-bridged prodrugs
由于生物体内氧化还原环境的差异性以及二硫键对肿瘤细胞内外氧化还原电势响应的不同,二硫键具有在血液循环过程中稳定存在,在肿瘤细胞中才发生反应的特点,因此被广泛用来设计氧化还原敏感的药物递送系统。
2 二硫键前药
研究表明药物-药物偶联物中引入二硫键可以诱导疏水性药物分子自组装成纳米结构聚集体,这主要是由于二硫键具有独特的二面角,平衡了药物分子间的非共价作用力,抑制其在水中结晶[18-20]。由此制备的前药自组装纳米粒具有明确的组成结构和极高的载药量,显著改善了小分子化疗药物溶解度差、具有非选择性毒副作用等问题。同时在前药结构中引入二硫键能够赋予药物分子环境响应性药物释放的能力。Ma 等[21]将紫杉醇和阿霉素通过二硫键共轭相连,制备了具有氧化还原响应性的前药自组装纳米粒,其具有较好的粒径(180 nm 左右),且稳定性良好,由于二硫键两端均是药物,该前药纳米粒具有89%的超高载药量。
此外,二硫键桥联的前药自组装纳米粒制备相对简单,结构相对灵活,通过各种多功能化修饰可以实现药物的高效递送。将特异性靶向肿瘤细胞的基团,例如叶酸、抗体、肽类等,通过二硫键与小分子化疗药物连接,可实现主动靶向功能,提高药物递送效率和治疗效果[22]。例如,由于有些肿瘤细胞表面会表达过量的叶酸受体,叶酸可以作为抗肿瘤药物靶向输送中的靶向配体。当带有荧光的阿霉素和叶酸靶头用二硫键共价键连接后,阿霉素的荧光会被淬灭[23]。一旦前药进入叶酸受体高表达的肿瘤细胞,二硫键会与细胞内高表达的GSH发生反应,使得阿霉素从前药中释放出来,药物荧光得以恢复,并对肿瘤细胞有较好的杀伤作用。二硫键也被用于连接单克隆抗体与化疗药物,这类可激活前药利用抗体与肿瘤细胞表面抗原的特异性结合反应,介导纳米粒内化到肿瘤细胞中。例如,2017年上市的抗体药物偶联物奥英妥珠单抗使用含二硫键的连接臂共价连接靶向肿瘤细胞表面特异性表达的CD22 抗体的单抗和可诱导DNA 双链断裂的N-乙酰基-γ-卡奇霉素,用以治疗急性淋巴细胞白血病[24]。二硫键能够在血液循环中稳定存在,在肿瘤部位特异性裂解的性质极大降低了N-乙酰基-γ-卡奇霉素的系统毒性。二硫键还可用于化疗药物和荧光成像探针的连接(见图3),前药在肿瘤部位特异性激活后同时具备诊断和治疗功能,包括喜树碱和光敏剂、羟基喜树碱和荧光物质、米托蒽醌和荧光分子共轭等[25-27]。
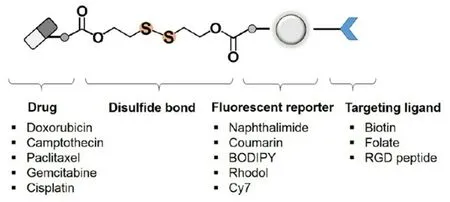
图3 基于二硫键响应的共轭化合物[28]Fig 3 Conjugated compounds based on disulfide bond responses[28]
3 基于二硫键的纳米载体
3.1 基于二硫键的聚合物纳米胶束
利用二硫键将药物与聚合物的功能基团相连形成的两亲性聚合物-药物结合物,可在水中自组装形成纳米胶束,由于胶束稳定的物理化学性质,二硫键修饰的聚合物纳米胶束可稳定存在于血液循环中,通过实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR)靶向肿瘤部位,并具有肿瘤微环境敏感性释药的特点,可以显著减少药物对正常组织的损伤,提高治疗效果[16,18-20,29]。为了降低联合用药引起的毒副作用、实现药物的可控释放,Yang 等[30]构建了具有氧化还原敏感性的共载紫杉醇(paclitaxel,PTX)和阿霉素(doxorubicin,DOX)的胶束体系。使用亲水性聚乙二醇单甲醚(methoxypolyethylene glycols,mPEG)通过二硫键修饰疏水性的PTX 和DOX,合成的两种聚合物-药物结合物,分别记为mPEG-SS-PTX 和mPEGSS-DOX,具有氧还原敏感性。mPEG-SS-PTX 和mPEG-SS-DOX 均为两亲性嵌段,可以在水中自组装形成混合胶束,平均粒径为93.3 nm,胶束能够通过EPR 被动靶向到肿瘤部位发挥作用。此外,该药物递送系统可以根据临床用药效果精确确定PTX 和DOX 的比例,同时能够实现药物的氧化还原敏感性释放[30]。Yang 等[31]合成了两亲性结合物阿霉素-二氯乙酸盐,该偶联物可以通过使用少量DSPE-PEG2000自组装成纳米颗粒,减少了相关赋形剂的使用,载药量高达71.8%(w/w)。纳米粒给药后没有对小鼠造成系统毒性,最大耐受剂量为75 mg·kg-1,比游离DOX 高15倍。这些研究为简化药物制备过程,增加载药量,降低全身毒性以及提高抗肿瘤效率提供了有希望的策略。Hu 等[32]制备的新型氧化还原敏感性羟乙基淀粉-阿霉素结合物(HES-SS-DOX),HESSS-DOX 在细胞外GSH 水平下相对稳定,但在细胞内GSH 水平下迅速释放DOX。与游离DOX相比,HES-SS-DOX 延长了DOX 的血浆半衰期,增强了DOX 在肿瘤内的蓄积。
除了作为聚合物-药物结合物之间的连接物,二硫键还可作为两亲性高分子材料、聚合物的主链间或主链与侧链之间的连接键[12]。通过二硫键连接亲水和疏水性聚合物链段所形成的两亲性共聚物,临界聚集浓度较低,能够自组装形成粒径适当、稳定性良好的纳米胶束,极大丰富了抗肿瘤药物递送载体的结构和功能[33]。文献报道了一种氨基葡萄糖(amino-glucose,AG)修饰的聚乙二醇(polyethylene glycol,PEG)和聚乳酸(polylactic acid,PLA)嵌段聚合物(AG-PEGSS-PLA)[34],可以在水溶液中自组装成纳米胶束。研究表明包封PTX 的AG-PEG-SS-PLA 纳米胶束能够主动靶向肿瘤细胞递送药物,通过内吞途径被肿瘤细胞摄取,并且可以在肿瘤细胞内高浓度GSH 的刺激下快速释放PTX,有效改善肿瘤细胞的多重耐药性。Thambi 等[35]利用二硫键将石胆酸(lithocholic acid,LCA)连接到羧甲基葡聚糖(carboxymethyl-dextran,CMD)链上,所构建的偶联物(CMD-SS-LCAs)具有自组装能力。采用乳化法制备的负载DOX 的纳米胶束,载药量高达70%,在体外10 mmol·L-1GSH 条件下可实现DOX 的完全释放,与游离DOX 相比表现出显著增强的抗肿瘤效果。
聚合物载体在血液循环中可能与蛋白或细胞成分发生相互作用,使得载体的稳定性降低,药物提前泄漏[36]。使用氧化还原响应性裂解的二硫键作为聚合物药物载体中的交联剂[12],可以提高聚合物载体的血液稳定性,实现肿瘤细胞内的特异性药物释放。Guo 等[37]合成了PEG-赖氨酸(lysine,Lys)-苯丙氨酸-(phenylalanine,PPhe)三嵌段聚合物(PEG-Lys-PPhe),使用含二硫醚的交联剂3,3'-二硫代双(磺酸琥珀酰亚氨基丙酸酯)与PLys 侧链上的氨基反应形成交联壳层,胶束表面使用脱氢抗坏血酸(dehydroascorbic acid,DHAA)共价修饰,由此制备的DHAA 修饰的二硫键交联聚合物载体可装载DOX,形成粒径60.34 nm 左右的纳米胶束[DPL(s-s)P/DOX]。DPL(s-s)P/DOX 在生理条件下可以稳定存在,能够通过葡萄糖转运体GLUT1 主动靶向肝癌细胞,内化进入肿瘤细胞后,在胞内高浓度GSH 条件下二硫键断裂、胶束发生降解,使DOX 从胶束中快速释放出来,体内外实验表明DPL(s-s)P/DOX 胶束抗肿瘤效率有所增强。
3.2 基于二硫键的纳米凝胶
近年来含二硫键的链段作为水凝胶和微凝胶的交联剂已经成为聚合物载药领域的研究热点。在D/L-二硫苏糖醇、谷胱甘肽和L-半胱氨酸等还原性物质存在的条件下,二硫键交联纳米凝胶的三维网络结构被破坏进而解体[13]。二硫键使得载药纳米凝胶具有优异的还原响应性,所装载的药物可以在氧化还原微环境中快速释放。紫草素(shikonin,SHK)是一种通过诱导细胞坏死发挥抗肿瘤作用的天然产物,对骨肉瘤有较好的治疗作用,但其具有化疗药物普遍存在的溶解性差和非选择性杀伤正常组织细胞等缺陷。Li 等[38]使用靶向骨肉瘤的多肽修饰的二硫化物交联纳米凝胶递送SHK(STP-NG/SHK),用于降低药物的全身毒性,提高患者的耐受性。STP-NG/SHK 能够主动靶向肿瘤细胞,体外释放实验表明二硫键在还原条件(高浓度GSH 条件)下20 h 内超过75%的SHK 从载体中释放,而无GSH 存在下仅有少量释放。Pan 等[39]以N,N'-双(丙烯酰)胱胺为交联剂制备了聚甲基丙烯酸纳米凝胶(polymethyl methacrylate-nanogel,PMAA-NG),用以高效递送DOX。负载DOX 的PMAA-NG 具有pH/氧化还原双响应释药能力,在生理pH 条件下仅有少量药物释放,而在酸性和还原环境(pH 5.0,10 mol·L-1GSH)中,5 h 内约91%的DOX 能够从纳米凝胶中释放出来。PMAA-NG装载DOX 的载药量高,研究表明其能通过吞噬作用迅速被肿瘤细胞摄取,PMAA-NG 在弱酸性和还原性肿瘤微环境中特异性降解释药,具有良好的抗肿瘤作用。
3.3 基于二硫键的二氧化硅纳米粒
二氧化硅纳米粒相较有机纳米载体稳定性好、载药量高,根据微观结构的不同可分为介孔硅纳米粒(mesoporous silica nanoparticles,MSNs)和无孔硅纳米粒(nonporous silica nanoparticles,NSNs)[40]。近年来,许多研究使用二硫键对二氧化硅纳米粒进行修饰,多种具有可控降解特性的纳米递药系统已经被开发出来[41-42]。该系统可在肿瘤细胞内高浓度GSH 的诱导下降解进而发挥药效,对正常细胞毒副作用小,已被广泛应用于诊疗制剂的递送。
其中,MSNs 具有多孔结构和较大的比表面积,能够有效装载药物并缓慢可控地释放药物,是以在医药领域受到广泛关注[11,43]。为了避免抗肿瘤药物在到达肿瘤部位前从介孔硅纳米载体中泄漏,研究中使用含有二硫键的中间体将Fe3O4等无机纳米粒、环糊精等大环化合物、聚(N-丙烯酰氧基丁二酰亚胺)、聚乙烯亚胺等高分子聚合物与介孔硅表面共价相连[11,44-45]。这种修饰使得介孔硅孔道在体循环中处于闭合状态,药物分子无法释放;当纳米粒进入肿瘤细胞后,二硫键被GSH 等物质还原断裂,介孔硅表面的修饰物解离,封装的药物得以释放[46],从而提高制剂在血液循环中的稳定性,实现其在肿瘤部位特异性释药。然而纯二氧化硅骨架在生物体内难以降解,长期使用会在体内滞留,继而引发严重且无法预测的毒性风险。因此,需要设计和合成更加安全的二氧化硅载体。通过在二氧化硅骨架中引入二硫键构建可生物降解的二氧化硅纳米粒,不仅保持了二氧化硅纳米载体原有的生理稳定性,还可实现肿瘤部位氧化还原微环境响应性生物降解,有助于提高载体的生物安全性和药物治疗效率[47]。例如,Huang 等[48]将双(3-三乙氧基硅丙基)二硫化物共价掺杂于MSNs 的二氧化硅骨架中,制备了有机-无机杂化的中空介孔有机硅纳米胶体(HMONs@PEG)。二硫键的引入加速了HMONs@PEG 骨架在还原微环境中的生物降解和负载药物阿霉素的还原响应释放,增加二氧化硅纳米粒生物相容性的同时,显著提高了阿霉素的治疗效果,并且在一定程度上减少了游离阿霉素的毒副作用。
4 总结与展望
纳米递药系统具有可提高疏水性药物溶解性、延长药物作用时间、被动靶向给药等诸多优势,从而成为近几十年纳米领域中的研究热点。然而,药物在未达到肿瘤部位时已经从纳米粒中提前泄漏于血液循环中,导致到达肿瘤部位的药物减少,从而使得纳米给药系统临床疗效并无明显增强。药物作用于非靶部位容易对正常组织造成损伤从而引起不良反应,仅足量作用于靶部位才能引起较好的治疗作用。因此不论基于前药自组装还是载体的纳米递药系统,药物在肿瘤部位的选择性释放对于制剂的有效性和安全性都至关重要。目前,人们开发了一系列基于二硫键的纳米前药及聚合物纳米胶束、纳米凝胶、二氧化硅纳米粒等载药体系,利用二硫键的氧化还原特性实现肿瘤部位特异性释放,有效避免了抗肿瘤药物在血液循环及进入肿瘤细胞的过程中从纳米粒中渗漏,智能触发药物在肿瘤细胞内的选择性释放,为开发安全有效的纳米制剂提供了巨大的潜力。

