胃癌组织中miR-338-3p、PTP1B的表达观察及患者预后影响因素分析
白如雪,许颖颖,刘芳,杜时雨
中日友好医院内镜中心,北京100029
胃癌是常见的恶性肿瘤之一,2018年全球新发胃癌病例148.4万。手术虽是胃癌最重要的治疗方法,但晚期胃癌仍缺乏有效治疗手段,即使采取综合治疗策略也有较大几率出现复发和转移,5年累积生存率也不足30%[1]。因此,寻找能有效评估患者病情进展和预后生物学靶标具有重要意义。微小RNA是一类非编码RNA,可调控肿瘤细胞增殖、分化、凋亡、侵袭等生物学行为[2]。近年大量研究报道,微小RNA-338-3p(miR-338-3p)在多种肿瘤组织中表达上调,在不同肿瘤类型中发挥促癌基因或抑癌基因作用[3-4]。蛋白质酪氨酸残基的磷酸化是细胞信号传导通路中重要环节,可调节肿瘤细胞增殖、分化、凋亡、侵袭等生物学行为,受蛋白酪氨酸磷酸酶(PTPs)和蛋白酪氨酸激酶(PTKs)调控[5]。蛋白酪氨酸磷酸酶1B(PTP1B)为PTPs家族一员,其与卵巢癌、乳腺癌、胰腺癌等多种肿瘤的发生和预后相关[6-8]。目前,关于miR-338-3p、PTP1B与胃癌的关系鲜有报道。2015年1月—2017年12月,我们观察了胃癌组织中miR-338-3p、PTP1B的表达变化,并分析患者预后影响因素,以期为临床有效评估患者病情进展和预后提供参考。
1 资料与方法
1.1 临床资料 选取中日友好医院接受手术治疗的胃癌患者89例,男50例,女39例;年龄47~82(61.25±7.25)岁,其中≥60岁56例、<60岁33例。纳入标准:①经术后病理检查确诊;②初次确诊,术前未接受放化疗等抗肿瘤治疗者;③患者及家属均知情研究;④病历资料完整者;⑤可接受随访者。排除标准:①合并其他部位肿瘤者;②既往恶性肿瘤病史;③心、肝、肾功能严重受损者;④合并免疫系统疾病者。肿瘤直径:≥5 cm 37例,<5 cm 52例;TNM分期[9]:Ⅰ~Ⅱ期36例,Ⅲ~Ⅳ期53例;肿瘤分化程度:未分化9例,低分化19例,中分化48例,高分化13例;浸润深度:T1 18例,T2 21例,T3 33例,T4 17例;有淋巴结转移42例,无淋巴结转移47例。手术留取胃癌及癌旁(距离癌组织>5 cm)组织各89例份。本研究经伦理委员会批准。
1.2 胃组织中miR-338-3p、PTP1B检测方法 取胃癌组织和癌旁组织标本,TRIzol总RNA抽提试剂盒(无锡百泰克生物技术有限公司)提取组织中总RNA,琼脂糖凝胶电泳检测完整性,Qiagen逆转录试剂盒(上海研卉生物科技有限公司)合成cDNA,加入引物0.6μL,miR-338-3p:5´-TGAGGGCAAGATGACAAA‑GA-3,5´-GCCCTTGCACTTGATGGTAT-3;PTP1B:5´-TTCTGAGCTGGGCTTGTTGT-3´,5´-TGCAGCTA‑AAATGCAAACCCAT-3´;miR-338-3p、PTP1B引物0.6μL(5´-TGCGGTTTGGCAATGGTAGAAC-3´,5´-CCAGTG-CAGGGTCCGAGGT-3)混匀。伯乐CFX96荧光定量PCR仪检测,反应条件:95℃、20 s,95℃、10 s,60℃、20 s,70℃、10 s,循环40次,分别以U6和GAP‑DH做内参校正,U6:5´-CTCGCTTCGGCAGCA‑CATATACT-3´,5´-ACGCTTCACGAATTTGCGT‑GTC-3;GAPDH:5´-CGAGCCACATCGCTCAGA‑CA-3´,5´-GTGGTGAAGACGCCAGTGGA-3;反应结束后得到各管Ct,2-ΔΔCt法计算miR-338-3p、PTP1B相对表达量。
1.3 胃癌患者术后随访方法 术后通过门诊复查和电话方式随访3年,随访截止2020年12月,统计3年累积生存率,定义为手术至随访截止或死亡。
1.4 统计学方法 采用SPSS26.0统计软件。计数资料以例(%)表示,组间比较采用χ2检验;偏态分布或方差不齐的计量资料以M(QL,QU)表示,组间比较采用Z检验;相关性分析采用Spearman相关分析法;Kaplan-Meier法绘制生存曲线,组间生存率比较采用Log-rank检验;多因素Cox回归分析法分析胃癌患者预后不良影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌、癌旁组织中miR-338-3p、PTP1B相对表达量比较 胃癌组织中miR-338-3p、PTP1B相对表达量分别为0.870(0.470,1.485)、1.052±0.059,癌旁组织分别为3.590(2.435,4.570)、0.544±0.116,两者比较,P均<0.05。
2.2 胃癌组织中miR-338-3p与PTP1B表达水平的相关性 胃癌组织中miR-338-3p与PTP1B表达水平呈负相关(rs=-0.626,P<0.05)。
2.3 miR-338-3p、PTP1B表达水平与胃癌临床病理参数的关系 miR-338-3p、PTP1B表达与胃癌临床病理参数的关系见表1,由表1可知,miR-338-3p、PTP1B表达与胃癌TNM分期、浸润深度、淋巴结转移相关(P均<0.05)。
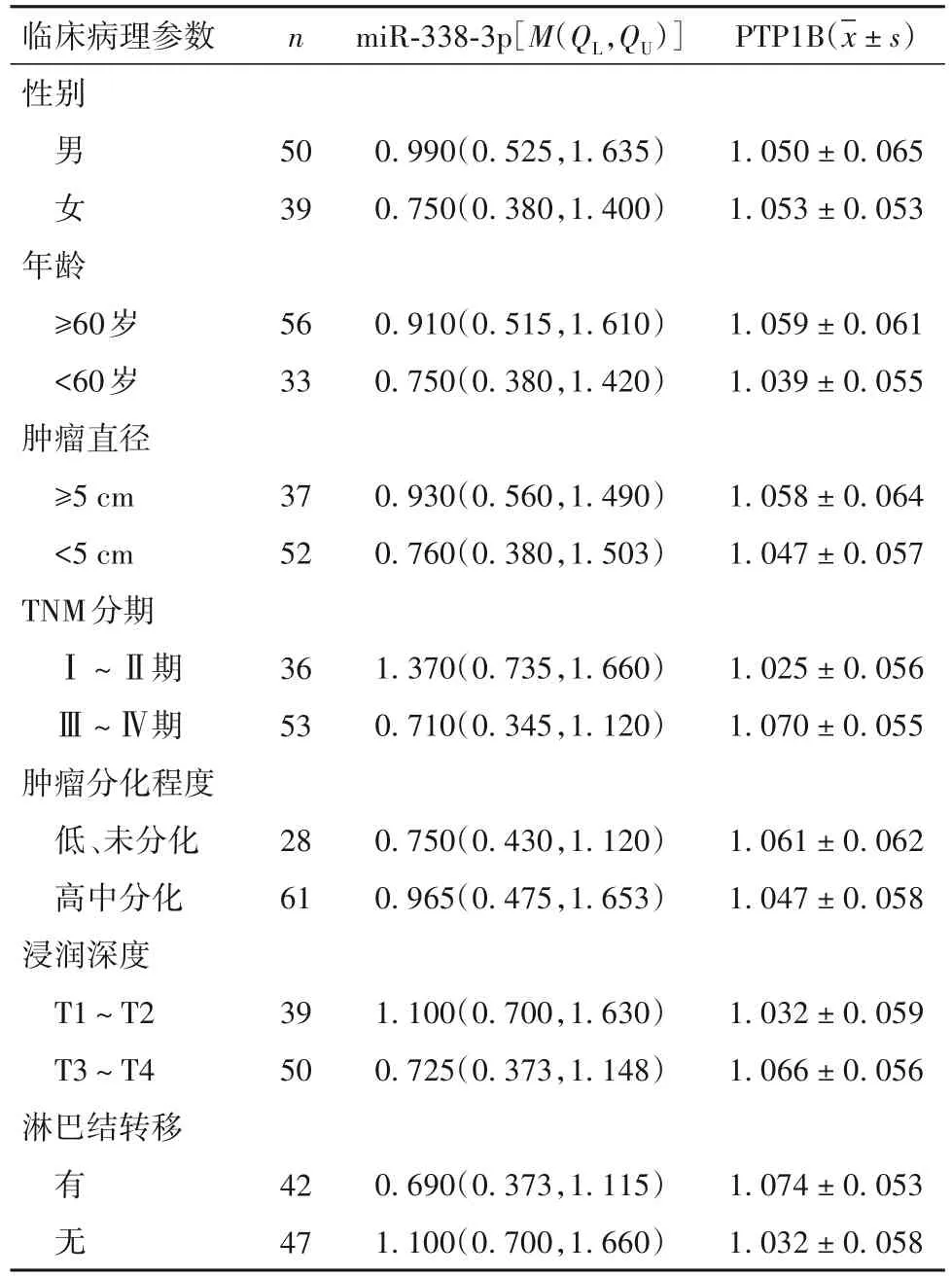
表1 miR-338-3p、PTP1B表达水平与胃癌临床病理参数的关系
2.4 miR-338-3p、PTP1B表达水平与胃癌患者预后的关系 以miR-338-3p中位数和PTP1B平均值为界将89例胃癌患者分为高、低表达组。miR-338-3p高表达组(43例,≥0.87)、miR-338-3p低表达组(46例,<0.87)3年累积生存率分别为76.74%(33/43)、47.83%(22/46),两组比较,P<0.05;PTP1B高表达组(45例,≥1.05)、PTP1B低表达组(44例,<1.05)3年累积生存率分别为44.44%(20/45)、79.55%(35/44),两组比较,P<0.05。
2.5 胃癌患者预后不良影响因素单因素和多因素Cox回归分析结果 随访3~36(20.59±8.37)个月,死亡34例,存活55例。死亡组男性22例(64.71%)、年龄≥60岁27例(79.41%)、肿瘤直径≥5 cm 16例(47.06%)、TNM分期Ⅲ~Ⅳ期28例(82.35%)、低未分化12例(35.29%)、浸润深度T3~T4 24例(70.59%)、淋 巴 结 转 移24例(70.59%)、miR-338-3p 0.392(0.141,0.633)、PTP1B 1.102±0.041,存活组分别为28例(50.91%)、29例(52.73%)、21例(38.18%)、25例(45.45%)、16例(29.09%)、18例(32.73%)、1.302(0.871,1.662)、1.022±0.053,两组年龄≥60岁比例、TNM分期Ⅲ~Ⅳ期比例、浸润深度T3~T4比例、淋巴结转移比例及PTP1B表达水平、miR-338-3p表达水平比较,P均<0.05。以年龄(≥60岁=1,<60岁=0)、TNM分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、浸润深度(T3~T4=1,T1~T2=0)、淋巴结转移(有=1,无=0)、miR-338-3p、PTP1B为自变量,预后为因变量(死亡=1,存活=0),经多因素Cox回归分析,显示TNM分期Ⅲ~Ⅳ期、淋巴结转移、高PTP1B表达水平为胃癌患者预后不良独立风险因素,高miR-338-3p表达水平为独立保护因素(P均<0.05)。详见表2。

表2 胃癌患者预后不良影响因素的多因素Cox回归分析结果
3 讨论
胃癌是常见的消化道恶性肿瘤,也是全球第3大癌症死亡原因,一般起源于胃黏膜细胞,与饮食习惯、Hp感染、遗传、种族等因素有关,主要症状为腹痛,但早期常无症状,大多患者确诊时已达中晚期(Ⅲ~Ⅳ期)[10]。早期胃癌的癌组织浸润仅限于黏膜层和黏膜下层,治疗相对容易,若癌症浸润胃壁、全层甚至出现转移,则需要联合治疗,但由于恶性程度较高,通常预后较差[11]。近年来,随着分子病理学进入临床,临床评估胃癌治疗方案更加精细,通常在手术治疗基础上给予放化疗、免疫治疗、靶向治疗等辅助治疗,使得肿瘤治疗效果升高,但目前以个体化精准化为特征的免疫或靶向治疗仍然没有达到令人满意的效果,基于基因谱和蛋白表达谱分类的分子病理学是胃癌辅助治疗的新基础[12-13]。因此尚需深入研究胃癌的发生发展机制,以期改善个体化精准化治疗效果。
miRNA是一种单链非蛋白质编码RNA,由19~23个核苷酸组成,可结合靶mRNA的3´非翻译区,调节60%的编码基因,改变目标基因表达,引起目标mRNAs翻译抑制和降解。尽管目前尚不明确大多数miRNAs功能作用,但诸多研究表明其参与了各种生理病理过程,包括细胞增殖、分化、凋亡等,且大多位于肿瘤相关的脆性位点或基因区域,与肿瘤发生发展密切相关[2]。miR-338位于人染色体17q25,染色体17q23~25为多种恶性肿瘤突变“热点”,该染色体突变与肿瘤恶性生物学行为密切相关,提示miR-338可能参与了肿瘤恶性进程[14]。miR-338-3p为miR-338成熟的miRNA序列,其在多种恶性肿瘤中呈异常表达。QIAN等[15]发现,宫颈癌中miR-338-3p表达明显上调,可通过上调缺氧诱导因子-1α促进宫颈癌细胞增殖和侵袭。孙超等[16]认为,肾癌中miR-338-3p表达明显下调,可通过下T细胞生长因子4抑制肾癌细胞增殖和侵袭。上述研究提示,miR-338-3p在不同肿瘤类型中发挥不同作用。本研究显示,胃癌组织中miR-338-3p表达水平明显低于癌旁组织,与TNM分期、浸润深度、淋巴结转移相关,提示miR-338-3p在胃癌中可能作为一种抑癌基因参与胃癌发生,与胃癌TNM分期、浸润深度、淋巴结转移相关,符合近年研究报道[17]。进一步分析发现,miR-338-3p高表达组术后3年累积生存率高于低表达水平组,且是患者预后不良的独立保护因素,说明miR-338-3p可能成为胃癌患者预后评估生物标志物。神经纤毛蛋白1可结合血管内皮生长因子配体,促进肿瘤新生血管生成和抑制肿瘤细胞凋亡,促进癌细胞生长、迁移、侵袭[18]。JIN等[19]通过生物信息学分析和双荧光素酶报告实验发现,神经纤毛蛋白1为miR-338-3p直接调控靶基因,转染miR-338-3p可抑制神经纤毛蛋白1表达,抑制胃癌细胞增殖、迁移、侵袭,促进其凋亡。
细胞增殖、分化、迁移、凋亡等功能改变由信号传导控制,其是由多条信号通路构成的复杂信号网络,蛋白质磷酸化和去磷酸化作为一种分子开关,在细胞信号转导进程中发挥重要作用[20]。酪氨酸为蛋白质磷酸化常见位点,PTKs和PTPs一起调控多种关键信号分子的酪氨酸磷酸化状态,其中PTKs负责酪氨酸残基的磷酸化,PTPs负责去磷酸化[5]。PTP1B为首个被分离、纯化、克隆的PTP,最初研究发现其在机体代谢过程中发挥重要作用,随着研究进展,越来越多研究表明,PTP1B还参与了肿瘤发生发展。如食管癌中PTP1B上调表皮生长因子受体表达增强癌细胞迁移和入侵能力,具有促癌基因作用[21]。JAK激酶/信号转导和转录激活因子信号通路激活是恶性淋巴瘤生存和增殖基础,恶性淋巴瘤中PTP1B基因失活突变与JAK激酶/信号转导和转录激活因子信号通路降低或失活相关,说明PTP1B具有抑癌基因作用[22]。本研究显示,胃癌组织中PTP1B表达水平高于癌旁组织,且与TNM分期、浸润深度、淋巴结转移相关,提示PTP1B在胃癌中可能作为一种促癌基因参与胃癌发生,与胃癌TNM分期、浸润深度、淋巴结转移相关。进一步分析发现,PTP1B高表达组术后3年累积生存率低于低表达水平组,且为患者预后不良独立危险因素,说明PTP1B可能成为胃癌患者预后评估生物标志物。目前,尚不明确PTP1B在胃癌中促癌机制,但大量研究[23-24]显示沉默PTP1B表达能显著抑制胃癌生长、增殖、迁移、侵袭能力,推测与PTP1B去磷酸化后改变原有蛋白质构象,激活某些细胞信号转导途径,引起胃癌细胞恶性进程有关。
本研究还显示,胃癌组织中miR-338-3p与PTP1B表达水平呈负相关,提示miR-338-3p与PTP1B可能共同影响胃癌病情进展和预后。SUN等[25]通过miRanda和TaegetScan生物信息学网站预测显示,PTP1B的3´非翻译区中有两个miR-338-3p潜在结合位点,双荧光素酶报告实验证实在胃癌中miR-338-3p可负向调节PTP1B发挥抑制肿瘤生长和转移作用。进一步验证了本研究结果。本研究结果还显示,TNM分期Ⅲ~Ⅳ期、淋巴结转移为胃癌患者预后不良独立风险因素,考虑与Ⅲ~Ⅳ期浸润较深,已经扩散甚至转移至其他器官,难以完全切除,因此术后转移复发几率高,预后差。
总之,胃癌组织中miR-338-3p表达水平降低,PTP1B表达水平升高,两者均与胃癌TNM分期、浸润深度、淋巴结转移相关,高PTP1B表达水平是胃癌患者预后不良的独立风险因素,高miR-338-3p表达水平是胃癌患者预后不良的独立保护因素,两指标可能作为患者术后预后的评估指标。

