烟曲霉极性生长相关基因研究进展
刘慧敏 马彦
(山西医科大学第二医院皮肤性病科,太原 030001)
烟曲霉(Aspergillusfumigatus)是自然界中普遍存在的条件致病菌,是临床中第二类重要的真菌病原体。它以孢子的形式经过呼吸道而进入人体,在免疫力正常的人群中可以腐生定植,但在癌症、器官移植、艾滋病等群体中可以引起以肺为主要靶器官的侵袭性感染,占人类侵袭性感染的65%[1]。真菌细胞壁是动态的细胞器,是真菌与周围环境接触的第1个环节,也是抗真菌治疗的独特靶点,而细胞壁重塑也是极性生长过程中的重要程序[2]。极性生长即有方向地生长,是真菌中普遍存在的一种生长模式,过程极其复杂,涉及细胞壁的合成和塑性、孢子出芽、细胞膜延伸等,烟曲霉的生命周期开始于分生孢子的萌发,当分生孢子休眠被打破时,便开始由同向生长转变为极性生长[3],从周围环境中摄取营养,在菌丝的顶端或分枝处增加新的物质,同时可以维持真菌在宿主体内的菌丝形态以防止被宿主正常的免疫功能所清除,从而引起侵袭性感染的发生,如图1所示。极性生长对于烟曲霉正常的生长和毒力有重要作用,而真菌细胞壁又是抗真菌药物的重要靶点,所以对于烟曲霉极性生长以及细胞壁的研究以期发现新的抗真菌药物靶点尤为重要。
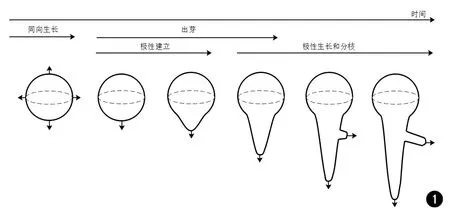
图1 烟曲霉孢子极性建立至出芽、形成菌丝及分枝示意图
1 可影响细胞壁成分含量变化的极性生长相关基因
烟曲霉细胞壁中多糖成分主要有β-1,3葡聚糖、半乳甘露聚糖、几丁质等,是细胞壁三维网络结构的基础[4],细胞壁合成受损时会影响烟曲霉的极性生长过程。
1.1 α-葡萄糖苷酶I基因
Romero等[5]在1997年定义了酵母中cwh41基因编码α-葡萄糖苷酶I(CWH1P),且该基因间接参与了β-1,6-葡聚糖的合成[6]。cwh41基因在烟曲霉中的研究较少,Zhang等[7]在2008年通过在烟曲霉中敲除cwh41基因观察到突变株在分生孢子出芽和菌丝延长时出现了异常的极性生长,分生孢子的形成明显减少、细胞壁的完整性途径(CWI)受损,并且引起烟曲霉所分泌蛋白的N-聚糖加工过程受限,所以他们当时推测可能是因为该基因敲除后影响了参与细胞壁合成的蛋白质的功能而引起的。之后又进一步研究了ΔAfcwh41突变株表型变化的分子基础,几丁质合成酶基因chsEb表达量下降,LHSLP(Hsp70伴侣家族成员之一)、钙联蛋白以及参与泛素介导降解的RPT6,E3泛素蛋白连接酶和组蛋白泛素化蛋白表达量均增加,也因此认为烟曲霉中cwh41基因缺陷会引起内质网应激。通过对ΔAfcwh41突变体的细胞骨架进行染色,在出芽的早期阶段和菌丝延长的阶段,分别观察到几丁质斑块集中分布在肿大的分生孢子中而在菌丝中是随机分布的,在第一、二芽管处尤其是生长的尖端以及菌丝尖端并没有荧光的聚集,这与在野生菌株中观察到的结果截然不同,说明ΔAfcwh41突变株中极性的异常是由于肌动蛋白细胞骨架错误的极性定位所引起的[8]。
1.2 1,2-α-甘露糖苷酶基因
ɑ-甘露糖苷酶类对人类和牛等哺乳动物的生长发挥着重要的作用。ɑ-甘露糖苷酶分为I类和II类,在不同的物种有不同的活性。1993年Yoshida等[9]在橘青霉中克隆并定义了msdS基因编码的1,2-ɑ-甘露糖苷酶,之后其在米曲霉[10]、构巢曲霉[11]中均成功表达。烟曲霉中,msdS基因编码的1,2-α-甘露糖苷酶(1,2-ɑ-mannosidase)属于I类1,2-ɑ-甘露糖苷酶。ΔmsdS突变体的细胞壁的完整性受损,分生孢子的形成下降,细胞壁中α-葡聚糖、甘露糖蛋白、β-葡聚糖和几丁质含量都减少,但在免疫缺陷的小鼠模型中证明了msdS基因对于烟曲霉的生长和毒力并不是必须的。37℃,野生型菌株以经典的双极模式在18°方向分生孢子出芽,并且在第一芽管附近的“颈部”的位置形成隔膜,而ΔmsdS突变株中第二芽管的出现是在12°方向生长的,隔膜是在新生芽管颈部的部位形成的,而且要早于野生菌株中第二芽管生长(7~8 h)。突变株的芽管要比野生型菌株的芽管更加肿胀,且4轮有丝分裂后在菌丝尖端没有形成隔膜,突变株形成多核、少梗基的囊泡都证明了msdS基因缺陷降低了菌丝生长过程中的极性生长和分隔作用[12]。
1.3 锌指转录因子Crz1同源物
钙调磷酸酶途径(calcineurin pathway)是真菌中重要的信号转导通路,调节真菌的生长、形态、压力反应及致病性。CrzA(锌指转录因子Crz1同源物)是烟曲霉中钙调磷酸酶途径中重要的下游因子,CrzA的缺陷引起了细胞壁β-1,3-葡聚糖含量降低[13]。在烟曲霉ΔcrzA突变株中观察到出芽减少并且时间延长,菌丝极性生长比野生型要少68%,并且扫描电镜下观察到菌丝尖端变钝且存在畸形;分生孢子形成较少且其表面相对平滑,说明CrzA参与烟曲霉极性生长过程,但同时可能也有其它的基因参与着菌丝极性生长和形态发生。CrzA还可以促进钙胁迫耐受[14],且在特定的位点控制分生孢子的产生和烟曲霉的毒力[15]。
1.4 Rho GTP酶基因家族
Rho GTP酶基因家族包括rhoA、cdc42、racA,从真菌至人类都是高度保守的,它们调节细胞外信号,激发肌动蛋白细胞骨架的变化[16],在细胞极性生长方面扮演着中心角色。在新生隐球菌中,racA同源基因在ras1下游发挥作用,并与ste20协同来共同控制新生隐球菌在高温下的生长和细胞分化[17]。在白念珠菌中,racA以及其激活剂dck1对于侵袭性丝状真菌的生长是必需的。在解脂耶氏酵母[18]和马尔尼菲篮状菌[19]中均已发现racA基因参与极性生长过程。在烟曲霉中,racA参与菌落的增殖和分生孢子的产生,ΔracA菌株形成的菌落更致密,菌落直径要比野生型短,菌丝过度分枝且变钝,末端变卷曲,Fortwendel等[20]也发现该基因缺陷后出芽及菌丝形态表现异常且细胞壁完整性途径受损,这些都表明racA参与了烟曲霉极性生长[21],其介导的ROS信号途径可能是极性生长的发育信号[22]。
烟曲霉中rhoA基因缺陷后细胞壁中β-1,3-葡聚糖的含量和葡萄糖胺的含量减少,细胞壁完整性受损,致病性也降低,同时抑制了分生孢子向肺上皮细胞的移动以及炎症因子的释放[23]。cdc42已经发现参与了裂殖酵母[24]、白假丝酵母菌[25]的极性生长过程,烟曲霉中cdc42以及rhoA可以介导胶霉菌素引发的烟曲霉细胞内在化,从而引起侵袭性感染[26]。极性生长相关基因sho1敲除后引起Rho GTP酶基因家族的表达量下降[27]。
此外,既参与极性生长过程又可以影响细胞壁成分含量的变化的基因还有很多,如几丁质合成酶chs基因、α-1,3葡聚糖合成酶基因(ags1,ags2,ags3)等。
2 可影响细胞壁塑型的极性生长相关基因
细胞壁的三维空间结构需要细胞壁各个组分进行重构、交联后形成,常需要特定的转移酶或通过GPI锚定在细胞壁上的蛋白来完成[4],参与这一环节的基因缺陷后会影响烟曲霉极性生长过程。
2.1 磷酸乙醇胺转移酶基因
真菌中有很多维持细胞壁功能以及参与真菌致病的蛋白质都是通过糖基磷脂酰肌醇(GPI,glycosylphosphatidylinositol)锚来固定在真菌细胞表面的,磷酸乙醇胺(EtN-P,phosphoethanolamine)与GPI锚的连接、移动及修饰对于GPI锚定蛋白的成熟和分类有重要作用。在酵母菌中已经证明gpi7基因敲除后细胞壁的完整性有所受损[28],Δgpi7的出芽模式、胞质分裂、细胞形态以及细胞壁结构都有异常[29]。烟曲霉中gpi7基因编码了EtN-P转移酶,Δgpi7第一、二、三芽管的出现及出芽都要早于野生型菌株,且93.1%的突变株显示菌丝高度分枝且在其尖端有几丁质聚集;Δgpi7没有形成芽体且产生的孢子数仅仅是野生型菌株的30%都说明gpi7参与了烟曲霉极性生长[30],但烟曲霉中关于gpi7基因的研究相对较少。
2.2 β-1,3-葡糖基转移酶基因
gel基因家族编码的β-1,3-葡糖基转移酶可引起烟曲霉细胞壁中β-1,3葡聚糖的延伸[31]。烟曲霉中,gel家族共有7个开放阅读框架:gel1-gel7,在菌丝生长过程中表达的只有gel1、gel2和gel4。gel1最初由Mouyna等[32]定义,其编码的GPI-锚定蛋白与酿酒酵母中GAS1P[33]以及白假丝酵母菌中PHRP同源[34],参与真菌细胞壁的合成,但gel1基因的敲除并未引起表型的改变。gel2与gel1同源,但GEL2P并不能完全补充gel1基因敲除株的生长缺陷,Δgel2中生长明显降低,分生孢子的形态学方面也有较大差异,有的很短,有的却类似菌丝,并且在感染的小鼠模型中观察到Δgel1Δgel2和Δgel2的毒力降低[35]。gel4的表达量比gel1和gel2要多[31],且GEL4P有双β-1,3-葡聚糖延伸和分枝活性[36]。gel1和gel4参与了同向和极性生长,而gel2和gel5仅在分生孢子的极性生长过程中表达[2]。Zhao等[37]首次说明了gel7的功能,gel7可能对gel1和gel2有一定的补偿作用,但功能又各自不同,gel7参与分生孢子的形成,敲除后引起出芽延迟,分生孢子数量减少且分生孢子头部表现出类似“秃顶”的区域。以上均说明gel家族参与了分生孢子形成、形态发生及细胞壁塑性过程。
2.3 α-1,2甘露糖基转移酶基因
烟曲霉中主要的甘露聚糖结构是与β-1,3-葡聚糖-几丁质细胞壁核心交联的半乳甘露聚糖。ktr基因家族(kre2/mnt1家族)编码的α-1,2甘露糖基转移酶参与蛋白质的糖基化过程,在不同真菌的细胞壁、菌丝、孢子等方面发挥着不同的作用,参与了极性生长过程。在酿酒酵母和白假丝酵母菌中,ktr基因家族分别包括9个和5个成员,烟曲霉中仅有3个成员:ktr1、ktr4、ktr7[38]。ktr1、ktr4和ktr7在休眠的分生孢子、芽管和菌丝中均有表达。ktr1是烟曲霉中第3个ktr同源基因,Δktr1突变株在37℃时孢子形成及分生孢子出芽无明显异常,只是菌丝细胞壁较薄,在48℃时孢子数量明显减少且形成短的芽管,可能是由于基因敲除后细胞壁的不稳定性引起了菌丝尖端的泄露[39]。ktr4和ktr7编码的蛋白是细胞壁半乳甘露聚糖产物的关键酶,二者与酵母中ktr4和ktr7同源。Δktr4和Δktr7突变株在极性生长和分生孢子发芽方面表现出了严重的生长表型缺陷,分生孢子活力显著降低,形成了密集的菌丝且过度分枝,可能与基因敲除后分生孢子通透性增加有关系,且Δktr4和Δktr7最多可形成7个芽管且没有特定的出芽位点。
还有很多基因既参与了烟曲霉极性生长过程又参与细胞壁多糖合成后的交联、水解等,如负责几丁质与葡聚糖交联的crh基因家族,α-1,3葡聚糖水解酶、bgt1和bgt2基因等。
3 小 结
烟曲霉是我国侵袭性曲霉病中占主要地位的致病菌,侵袭性曲霉病的发病率逐年升高,但烟曲霉菌株出现耐药的现象也明显增多。烟曲霉极性生长参与其在人体内存活、繁殖及毒力等过程,是一个极其复杂的过程,其机制尚未完全清楚,而细胞壁作为烟曲霉与宿主接触的首要环节而发挥着重要作用。近年来研究发现多个基因可以通过不同的信号通路或者彼此之间相互作用来影响烟曲霉的生长,对于烟曲霉极性生长相关基因与烟曲霉细胞壁的研究有助于我们发现新的抗真菌药物靶点,从而研制更多可用于临床的抗真菌药物。

