布鲁氏菌16M BtpA和BtpB真核表达载体的构建及在293T细胞中的表达
乔连江,杨 森,张 萍,杨艳玲
(中国农业科学院特产研究所农业部经济动物疫病重点实验室,吉林长春 130122)
布鲁氏菌病(Brucellosis)又称布病、布氏杆菌病、马耳他热,是由布鲁氏菌属引起的一种常见的动物疫源性传染病,是世界上最古老的疾病之一[1-2]。布鲁氏菌(Brucella)是一种微小的球状、杆状或球杆状的革兰氏阴性兼胞内寄生菌,主要侵染单核-巨噬细胞,可引起人和多种家畜的慢性感染[3-4]。根据主要宿主的特异性、生化特性和抗原成分,把布鲁氏菌属分为10个种19个生物型,目前以羊种、牛种、猪种对人类和家畜的危害性最强[5]。人患病后多表现为大汗、反复高热并伴胸膜炎、关节炎和骨髓炎等继发症,家畜感染本病则常出现流产、空怀、繁殖成活率降低,给人类健康和畜牧业发展构成了巨大威胁[6-7]。
Ⅳ分泌系统(type Ⅳ secretion system,T4SS)是布鲁氏菌重要的毒力因子,由virB操纵子编码,基因序列高度保守,是横跨细菌内外膜的多蛋白复合物,对布鲁氏菌在宿主细胞内复制和存活必不可少的[8]。研究表明,Ⅳ分泌系统毒力作用主要依靠分泌的效应蛋白来实现,效应蛋白常作用于关键的信号通路分子,以多种方式帮助布鲁氏菌逃避宿主免疫监视进而在胞内建立持续性感染。Myeni S等[9-10]通过TEM-1和CyaA报告系统鉴定发现了效应蛋白BtpA和BtpB,已有研究表明,BtpA和BtpB是T4SS毒力依赖性效应蛋白。但BtpA和BtpB进入宿主细胞后如何调控核因子κB(nuclear factor kappa B,NF-κB)信号通路仍存在争议,以及与哪些宿主分子相互作用还有待挖掘。鉴于此,本研究以布鲁氏菌T4SS virB效应蛋白BtpA和BtpB基因为靶标,通过提取布鲁氏菌16M总RNA、反转录、PCR、酶切等构建真核表达载体,获得了具有活性的BtpA和BtpB效应蛋白,为进一步研究布鲁氏菌的致病机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞和质粒 羊布鲁氏菌16M标准毒株菌株由军事兽医研究所保存;293T细胞由中国农业科学院特产研究所特种动物病原团队实验室保存;真核表达载体pcDNA3.1购自上海索宝生物科技公司;pMD18-T Vector、感受态细胞DH5α购自Takara公司。
1.1.2 主要试剂与仪器 DNA Marker和反转录试剂盒,北京全式金生物公司产品;细菌总RNA提取试剂盒,杭州博日科技有限公司产品;限制性核酸内切酶EcoRⅠ、XbaⅠ,NEB公司产品; PrimeSTAR®HS DNA Polymerase、DNA琼脂凝胶回收试剂盒、质粒提取试剂盒、T4 DNA连接酶,Takara公司产品;HiFiTaqMix,四正柏生物科技有限公司产品;LipofectamineTM2000、恒温恒湿培养箱,赛默飞世尔科技公司产品;超敏ECL化学发光试剂盒、HRP标记山羊抗兔IgG(H+L)、HA tag Rabbit Monoclonal Antibody,碧云天生物科技公司产品;PCR扩增仪、凝胶成像系统,美国Bio-Rad公司产品;摇床,美国Crystal公司产品。
1.2 方法
1.2.1 引物设计和合成 根据NCBI数据库已公布的布鲁氏菌BtpA基因序列(Gene ID:29594531)和BtpB基因序列(Gene ID:29594062),利用Oligo 7软件分别针对BtpA和BtpB基因设计上、下游扩增引物,并在合适位置加入了酶切位点和HA蛋白标签序列,送吉林省库美生物有限公司合成。引物序列信息见表1。

表1 BtpA和BtpB基因的引物序列
1.2.2 总RNA的提取、反转录及PCR扩增 于-80℃冰箱取出羊布鲁氏菌16M菌种,取20 μL接种于5 mL TSB液体培养基中,于37℃恒温摇床,190 r/min培养72 h。提取1.2 mL菌液12 000 r/min离心2 min,收集菌泥,并按照博日科技总RNA提取试剂盒说明书,提取布鲁氏菌16M总RNA。对提取的RNA立即进行反转录合成cDNA。以上述得到的羊布鲁氏菌16M cDNA为模板,利用表1中的引物,分别对BtpA和BtpB基因进行了PCR扩增。PCR反应体系均为50 μL:5×Primer STAR Buffer 10 μL,dNTP MIXture 4 μL,Primer STAR HS DNA Polymerase 0.5 μL,2×Taq0.5 μL,上、下游引物各1 μL,模板2 μL,灭菌水补齐。PCR反应程序均为 :98℃ 2 min ;98℃ 10 s,55℃ 10 s,72℃ 1 min,30个循环;72℃ 10 min;4℃结束反应。对PCR产物用10 g/L琼脂糖凝胶电泳进行检测,对阳性产物回收纯化。
1.2.3 重组质粒pMD18T-BtpA和pMD18T-BtpB的构建和鉴定 将回收纯化的PCR产物BtpA和BtpB片段分别与pMD18-T Vector连接。连接体系为:BtpA片段/BtpB片段4 μL,pMD18-T Vector 1 μL,Solution 5 μL。连接后的产物分别转化入感受态细胞DH5α中,均匀涂布于含Amp+(100 mg/L)LB平板上,于37℃恒温培养箱进行过夜筛选培养后,挑取单个菌落进行增菌培养。对增菌培养的菌液进行质粒提取后,利用EcoRⅠ和XbaⅠ进行双酶切鉴定。将鉴定正确的阳性重组质粒分别命名为pMD18T-BtpA和pMD-18T-BtpB,并送长春库美生物有限公司,利用通用引物进行测序分析。
1.2.4 重组质粒pcDNA3.1-BtpA-HA和pcDNA3.1-BtpB-HA的构建和鉴定 利用EcoRⅠ和XbaⅠ分别对重组质粒pMD18T-BtpA、pMD18T-BtpB和真核表达载体pcDNA3.1进行了双酶切,经10 g/L琼脂糖凝胶电泳后,对酶切产物进行胶回收,获得了大量纯化的BtpA、BtpB和线性化的pcDNA3.1片段。在T4连接酶的作用下,将纯化的BtpA和BtpB片段分别与线性化的真核表达载体pcDNA3.1,于16℃过夜连接。根据感受态细胞DH5α说明书对连接产物进行转化操作,经含Amp+(100 mg/L)LB平板筛选后,挑取单个菌落进行增菌纯培养。对菌液进行质粒提取,并对质粒进行双酶切鉴定,将阳性重组质粒命名为pcDNA3.1-BtpA-HA和pcDNA3.1-BtpB-HA。
1.2.5 Western blot检测BtpA和BtpB基因的表达
1.2.5.1 293T细胞的转染 将传至第4代的293T细胞用2.5 g/L胰酶消化后,铺于6孔板中,待细胞密度生长到70%~85%左右。利用LipofectamineTM2000分别将重组阳性质粒pcDNA3.1-BtpA-HA和pcDNA3.1-BtpB-HA转染至293T细胞,同时将空质粒pcDNA3.1转染至293T细胞设为空白对照组。将转染后的细胞置于37℃、体积分数为5% CO2恒温细胞培养箱中,培养24 h。弃掉细胞培养液,使用RAPA强裂解液得到总蛋白样品,进行蛋白浓度的测定,置-20℃保存。
1.2.5.2 BtpA和BtpB表达检测 取出蛋白样,加入5×SDS-PAGE蛋白上样缓冲液于水浴锅中加热10 min,以充分变性蛋白。以100 g/L SDS-PAGE电泳分离蛋白,先将电压调为70 V,30 min之后改调为120 V,直至溴酚蓝刚跑出即可终止电泳进行转膜。采用湿转法,将蛋白转印至甲醇激活的PVDF膜上,60 g/L脱脂乳4℃封闭过夜,用TBST 10 min/次洗膜1次,加入抗HA一抗,于37℃摇床孵育2 h,用TBST 15 min/次洗膜3次,加入HRP标记山羊抗兔二抗,于37℃摇床孵育1 h,用TBST 15 min/次洗膜3次,最后用ECL化学法发光液进行检测。
2 结果
2.1 BtpA和BtpB基因的扩增
以羊布鲁氏菌16M cDNA为模板,经PCR扩增,分别获得了BtpA(873 bp)和BtpB(924 bp)基因片段,其大小与预期相符,且条带单一,无非特异性扩增(图1)。

M.DNA标准DL 2 000;1.BtpA基因片段;2.BtpB基因片段M.DNA Marker DL 2 000; 1.BtpA fragment; 2.BtpB fragment
2.2 重组质粒pMD18T-BtpA和pMD18T-BtpB酶切鉴定
对重组质粒pMD18T-BtpA和pMD18T-BtpB进行双酶切电泳鉴定,结果见图2。由图2可得,BtpA和BtpB片段均成功连至pMD18-T质粒。为进一步验证,取酶切鉴定正确的重组质粒送吉林库美生物有限公司测序,对测序结果比对后发现,与已报道的BtpA和BtpB序列序列一致。
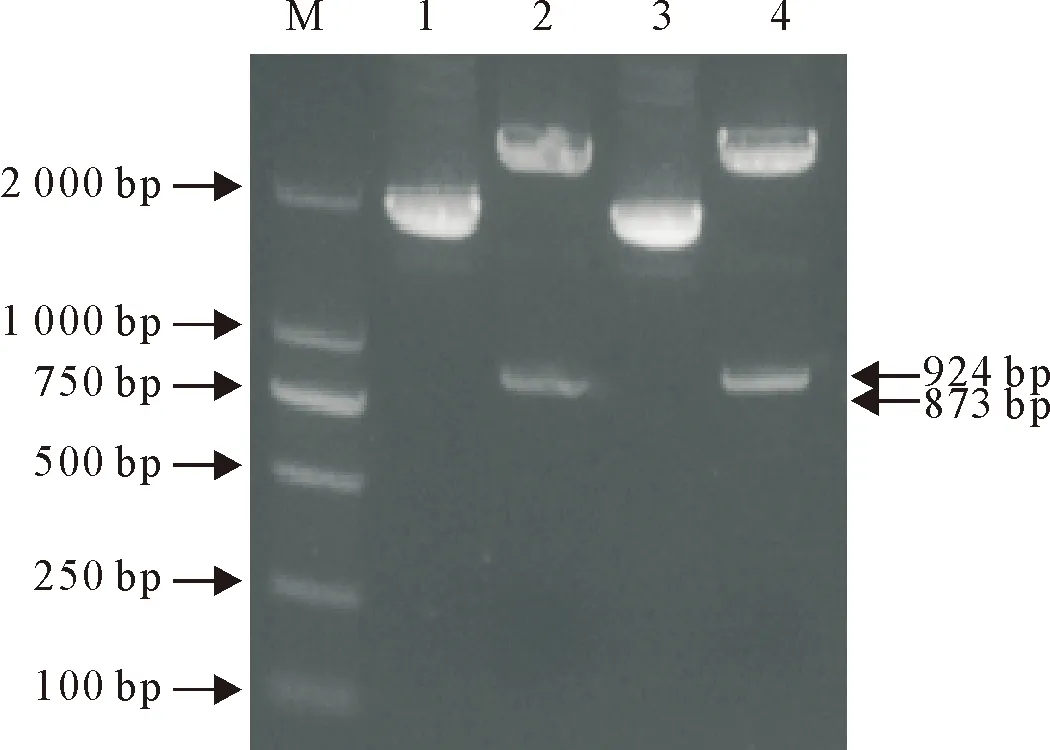
M.DNA标准DL 2 000;1.未酶切pMD18T-BtpA;2.双酶切pMD18T-BtpA;3.未酶切pMD18T-BtpB;4.双酶切pMD18T-BtpB
2.3 重组质粒pcDNA3.1-BtpA-HA和pcDNA3.1-BtpB-HA酶切鉴定
利用EcoRⅠ和XbaⅠ分别对空质粒pcDNA3.1、重组质粒pcDNA3.1-BtpA-HA和pcDNA3.1-BtpB-HA进行双酶切鉴定,结果见图3和4。由图3可知,空质粒pcDNA3.1被双酶切开,呈线性化,条带上移。由图4可知,BtpA和BtpB片段均成功连至线性化质粒pcDNA3.1,未酶切的质粒呈2条带。对阳性重组质粒双向测序验证,显示插入方向、碱基未突变和阅读框正确,说明真核表达载体pcDNA3.1-BtpA-HA和pcDNA3.1-BtpB-HA构建成功正确。
2.4 Western blot检测BtpA和BtpB的表达
Western blot检测结果如图5所示。由图5可知,转染空载体的对照组未出现条带,转染pcDNA3.1-BtpA-HA组和pcDNA3.1-BtpB-HA组分别在32 ku和35 ku处出现了条带,与预期结果相符。说明BtpA和BtpB基因在293T细胞中成功表达。
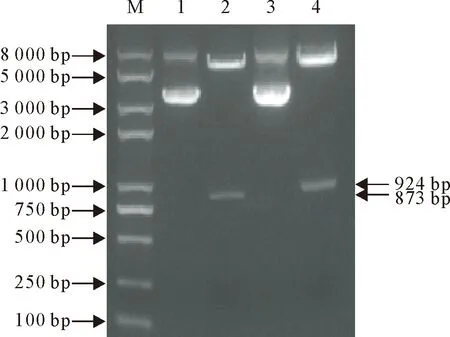
M.DNA标准DL 8 000;1.未酶切pcDNA3.1-BtpA-HA载体;2.双酶切pcDNA3.1-BtpA-HA载体;3.未酶切pcDNA3.1-BtpB-HA载体;4.双酶切pcDNA3.1-BtpB-HA载体
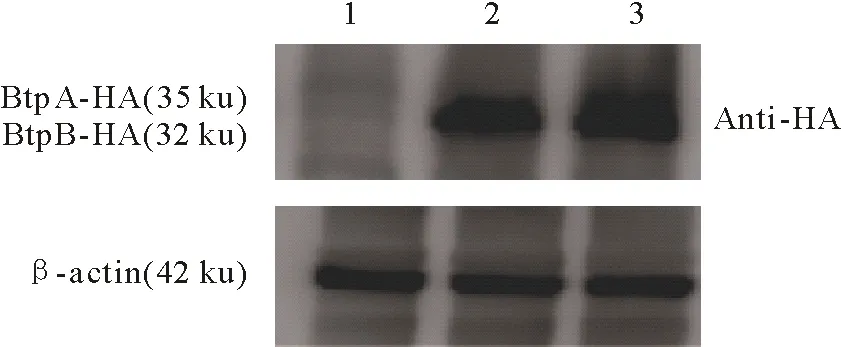
1.空质粒pcDNA3.1;2.载体pcDNA3.1-BtpA-HA;3.载体pcDNA3.1-BtpB-HA
3 讨论
布鲁氏菌是一种隐形病原体,可依靠毒力因子Ⅳ分泌系统以多种途径抑制宿主固有免疫进而以“静默”的方式侵染宿主细胞[11]。已有研究证明,Ⅳ分泌系统效应子BtpA和BtpB是含Toll-IL-1受体结构域蛋白,在感染早期可转位于宿主胞内,干扰宿主Toll样受体(Toll-like receptors,TLRs)信号,导致树突状细胞(dendritic cells,DC)成熟减少,进而抑制促炎细胞因子的分泌和影响NF-κB信号通路的激活[12]。该过程对促进布鲁氏菌胞内感染,建立慢性感染阶段尤为重要。TLRs是一种跨膜蛋白,在结构上分为胞外区、跨膜区和胞内区,可以识别病原成分并启动先天免疫信号级联反应。而TIR结构域为TLRs的胞内功能区,是TLRs活化后招摹接头蛋白向下传递信号的区域。因此,效应子BtpA和BtpB含有TIR区域,可竞争性与TLRs下游的信号分子MyD88或TIRAP相互作用,进而达到抑制宿主免疫反应的目的[13]。如前所述,效应子BtpA 和BtpB都可影响NF-κB的活化。但有些研究表明,BtpA 和BtpB在活化NF-κB信号通路时有着相反的作用,BtpA有抑制作用而BtpB可激活NF-κB活化[14-15]。而有些研究认为, BtpA和BtpB均能抑制NF-κB信号通路的激活[16-17]。此外,Felix等发现BtpA和BtpB含有结构WxxxE基序,该基序对保护微管解聚很重要。WxxxE基序在BtpA和BtpB与微管的结合中起着结构作用,和WxxxE gef家族蛋白一样,其中,该基序定位了一个相邻的催化环,对与特定的Rho GTPase相互作用很重要。这在一定程度上可以解释布鲁氏菌不引起细胞凋亡的分子机制,但与哪些宿主分子互作,以及如何发挥作用还不清楚[17]。综上所述,虽然目前对于Ⅳ分泌系统效应蛋白BtpA和BtpB的研究很多,但仍有许多未解之谜需要进一步试验验证,基因克隆表达技术为其提供了新的思路与手段。本研究成功构建了表达BtpA和BtpB蛋白的真核载体,转染293T细胞,Western blot检测,分别于32 ku和35 ku处出现了目的条带,说明293T细胞表达的蛋白有良好的反应原性,为下一步解释布鲁氏菌效应子BtpA和BtpB在活化NF-κB信号通路的“争议”,以及钓取宿主互作蛋白提供了工具材料。
本研究选取了普遍使用的、可高水平稳定表达目的蛋白的pcDNA3.1真核表达载体,该载体含SV40启动子,多克隆位点,双重筛选标记和复制区域,可融合表达多种外源基因,在基因表达中广泛使用[18-19]。HA标签序列为YPYDVPDYA[20],是目前广泛应用的表位标签之一,对外源蛋白空间结构影响小,易构建成标签蛋白融合到N端或C端,可利用通用的Anti-HA抗体检测。293T细胞是常用来表达研究外源基因的细胞株[21-22]。因此,以pcDNA3.1为骨架,在设计引物时,加入了EcoRⅠ和XbaⅠ酶切位点及HA标签,并将其成功转染入293T细胞,成功的表达了BtpA 和BtpB蛋白。为筛选效应蛋白BtpA和BtpB在宿主细胞的互作蛋白,从宿主分子角度阐述布鲁氏菌逃避免疫的机制奠定了基础。

