猫杯状病毒分离鉴定及其VP1基因序列分析
王 洁,丁航天,廖均乐,钱 鹏,刘玉秀,3,习向锋,张许科,3*,田克恭,3*
(1.河南农业大学动物医学院,河南郑州 450002;2.国家兽用药品工程技术研究中心,河南洛阳 471000;3.普莱柯生物工程股份有限公司,河南洛阳 471000)
猫杯状病毒(Feline calicivirus,FCV)是引起猫呼吸系统疾病的主要病原之一。FCV是属杯状病毒科(Caliciviridae)水疱疹病毒属(Vesivirus)的无囊膜单股正链不分节段RNA病毒[1],病毒粒子直径为35 nm~39 nm,核衣壳呈20面体对称。FCV基因组大小约7.7 kb,包含3个开放性阅读框(open reading frames,ORFs)。ORF1编码非结构蛋白,ORF2编码结构蛋白VP1[2],包括A~F 6个区域,A区高度保守,含有一段FCV共有序列,在衣壳蛋白VP1成熟过程中被裂解掉;B、D和F区相对比较保守;E区包含主要的B细胞表位[3],其变异性是基于序列区分分离株的基础。C和E区是高变区。E区分为3个区域,中心相对保守区域将5′端高变区和3′端高变区分隔开。E区的5′端高变区和C区参与病毒的中和作用,而它们的多变性是大部分FCV毒株相互间交叉保护低的原因。C、D和E区核苷酸的改变会影响FCV的反应原性。
FCV复制过程中RNA依赖RNA聚合酶转录过程缺乏校对和低保真性,这种容易出错的复制机制为FCV提供高度基因可塑性和适应性[4]。该病毒在免疫压力下容易产生变异以更快适应新环境生态位,导致FCV核苷酸进化树呈现“星状”系统发育。早期的FCV流行株感染猫症状为眼鼻分泌物增多、发热、口腔溃疡、鼻塞等一系列上呼吸道症状,随着疫苗使用和环境压力,FCV突变出可引起肺炎下呼吸道症状、跛行、胃肠道症状等毒株。2000年前后出现的高致病性FCV(virulent-systemic feline caliciviruses,VS-FCV)会引起全身性皮肤溃疡、黄疸、肝炎等不同于经典FCV的强毒力系统性疾病[5],病死率高达67%,有免疫史的猫对VS-FCV仍易感,国内已有VS-FCV的相关报道[6]。FCV部分感染猫康复后仍会继续排毒,持续时间为30 d至数年不等[7]。有报道显示,2005年欧洲FCV横向流调感染率为20%~40%,FCV纵向流调结果显示感染率为30%~75%[8-9]。目前国内FCV的预防主要依赖于进口猫三联疫苗。
本研究在2019年1月~3月从天津、北京两地采集患病猫眼、鼻、肛拭子,利用F81细胞分离鉴定得到5株FCV,并对其进行VP1基因测序分析,与疫苗株及国内外流行毒株进行同源性比对,以期了解天津和北京地区FCV分子流行病学特点和病毒遗传变异情况,为FCV流行动态追踪和诊断及预防提供理论基础。
1 材料与方法
1.1 材料
1.1.1 病料与细胞 2019年1月~3月,从天津、北京4家宠物医院采集猫眼、鼻、肛拭子,采样过程不区分患病猫是否有上呼吸道症状,加入1 mL PBS(pH 7.0),涡旋混匀,置-80℃冰箱备用。F81细胞,由国家兽用药品工程技术研究中心保存。
1.1.2 主要试剂 病毒DNA/RNA提取试剂盒,Geneaid公司产品;反转录试剂盒和pEasy-Blunt载体,北京全式金生物技术有限公司产品;胶回收试剂盒,TIANGENA公司产品;DNA Marker DL 2 000、DNA Marker DL 5 000、PrimeSTAR Max Premix DNA,宝生物工程(大连)有限公司产品;鼠抗FCV单抗为洛阳普泰生物技术有限公司惠赠;FITC标记羊抗鼠IgG,Sigma公司产品;RPMI 1640培养基、胰酶,美国Gibco公司产品;胎牛血清,德国Cegrogen公司产品。
1.1.3 仪器设备 涡旋振荡仪(VOKTEX-5),海门市其林贝尔仪器制造有限公司产品;离心机(minispin plus),Eppendorf公司产品;生物安全柜(NU-543-400S)、二氧化碳培养箱(CCL-170B-8),ESCO公司产品;恒温水浴锅(HS-4),华利达实验设备有限公司产品;超低温冰柜(MDF-86V50),中科都菱商用电器股份有限公司产品;PCR仪(C1000 Touch)、紫外凝胶成像仪(GelDoc XR+)、电泳仪(PowerPac),Bio-Rad公司产品;倒置荧光显微镜(Nikon Ts2),Nikon公司产品。
1.2 方法
1.2.1 病料PCR检测 参照文献[10]合成FCV、猫疱疹病毒1型(Feline herpesvirus type 1,FHV-1)和猫泛白细胞减少症病毒(Feline panleukopenia virus,FPV)的特异型性鉴定引物,引物序列见表1,由金唯智生物科技有限公司合成。参照商品化病毒DNA/RNA提取试剂盒说明书对处理后样品进行病毒核酸提取,利用表1的鉴定引物进行PCR或RT-PCR扩增,PCR产物采用10 g/L琼脂糖凝胶进行电泳检测。

表1 引物序列信息
1.2.2 FCV的分离培养与纯净性检验 将眼、鼻、肛拭子溶液漩涡混匀后,加入无血清RPMI 1640培养液至1 mL,4℃、5 000 r/min离心5 min,取上清经过0.22 μm滤膜过滤除菌,将滤液接种单层F81细胞,体积分数为5% CO2、37℃温箱中吸附1 h。弃上清,用无血清RPMI 1640培养液洗涤1次,补充含20 mL/L FBS的RPMI 1640培养液,在体积分数为5% CO2、37℃条件下培养。每12 h观察细胞状态,待出现变圆、皱缩、聚集成葡萄串状和脱落等细胞病变且病变达到80%~90%时收获细胞培养物,冻融1次后收至-80℃冰箱备用;若未出现细胞病变,盲传3代,期间出现上述细胞病变,则进行相同操作收毒,若无细胞病变,则视为未分离到病毒,弃去。对5株分离株进行FCV、FHV-1和FPV 3种病毒PCR检测。
1.2.3 分离毒株间接免疫荧光鉴定 将分离株接种单层F81细胞,设正常细胞对照,置体积分数为5% CO2、37℃温箱培养,待18 h~24 h后出现明显病变,弃接种液,PBS洗涤3遍;800 mL/L冷丙酮4℃固定20 min,PBS洗涤3遍;加入鼠抗FCV一抗,37℃孵育1 h,PBS洗涤3遍,加入FITC标记羊抗鼠IgG,37℃避光孵育1 h,PBS洗涤3遍,置于倒置荧光显微镜下观察结果。
1.2.4 FCV温度抵抗力试验 F2019TJ1株FCV的P1代接种于F81细胞,置于体积分数为5% CO2、37℃温箱中培养18 h~24 h,待细胞病变达80%~90%以上冻融收毒P2代,分装为若干小样,分别置于4℃环境中静置1、2、3、4、5、6 d,25℃环境中静置2、4、6、8、10 h,37℃环境中静置1、2、3、4、5、6、7 h。按每孔约2×104个F81细胞(100 μL)铺于96孔细胞板中,将处理后的病毒培养物用无血清RPMI 1640培养液进行10倍连续稀释(10-1~10-10),每个稀释度以每孔100 μL接种6孔F81细胞,设立正常细胞对照,置于体积分数为5% CO2、37℃温箱中培养72 h~96 h,每日观察细胞病变,记录病变孔数,根据Reed-Muench法计算病毒含量。
1.2.5 分离毒株VP1基因序列扩增与序列分析 病毒提取RNA后,按照商品化反转录试剂盒合成cDNA,根据GenBank数据库中已发表的FCV VP1基因全长序列,利用Primer Premier 5.0软件设计特异性引物FCV-CXF:CCTACACTGTGATGTGTTCG和FCV-CXR:GCAGCTTTGTCCAATTCAAT。PCR反应体系为50 μL:2×Prime STAR Max Premix DNA Polymerase 25 μL,FCV-CXF(10 μmol/L)和FCV-CXR(10 μmol/L)各2 μL,cDNA 5 μL,加ddH2O 16 μL补至50 μL。反应条件:95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 10 s,共33个循环;72℃ 10 min。用商品化胶回收试剂盒回收PCR产物,将回收产物克隆于pEASY-blunt载体后转化Trans 5α化学感受态中构建质粒,经菌落PCR鉴定选取5个阳性重组质粒送至金唯智生物科技有限公司进行测序。使用MegAlign对测序结果和NCBI上已发表的FCV VP1基因核酸序列进行同源性比对分析,使用MEGA7.0软件构建FCV VP1基因序列系统发育树,采用邻接法以Boot Strap值(1 000)进行可靠性分析。
2 结果
2.1 病料样品中的PCR检测结果
2019年1月~3月从北京、天津两地宠物医院共采集到297份猫病料,采样过程不区分患病猫是否有上呼吸道症状,病料样品分为眼鼻拭子和肛拭子。核酸检测结果显示FCV阳性率为15.49%(46/297),FHV-1阳性率为30.98%(92/297),FPV阳性率为30.64%(91/297)。本研究共调查宠物猫297例,检测结果见表2。其中年龄在1岁以下的猫FCV阳性率为19.57%,1岁及以上的猫FCV阳性率为11.54%;不同性别猫感染FCV差异不大,其阳性率均在14.35%左右;进口猫三联灭活疫苗的免疫率为55.37%,已免疫猫FCV阳性率(11.94%)低于未免疫猫阳性率(16.67%);采集的眼鼻拭子中FCV检出率(15.83%)高于肛拭子的检出率(10.53%)。其中有5份症状背景信息明确病料用FCV特异性引物RT-PCR扩增出大小约为321 bp的条带(图1),与预期FCV阳性片段条带大小保持一致,而FHV-1和FPV特异性引物PCR扩增结果为阴性。

表2 样品信息统计

M.DNA标准DL 2 000; 1.F2019TJ1; 2.F2019TJ2; 3.F2019TJ3; 4.F2019BJ1; 5.F2019BJ2; 6.阳性对照; 7.阴性对照
2.2 FCV分离培养与纯净性检测
将RT-PCR鉴定结果为FCV单纯感染的5份猫眼鼻拭子接种于F81细胞,12 h~16 h后细胞出现变圆、皱缩、聚集成葡萄串状等细胞病变(图2),28 h后细胞病变达80%及以上,而正常细胞未出现细胞病变。5株分离株FCV核酸检测结果均为阳性,FHV-1和FPV PCR检测结果均为阴性,表明分离的5株病毒纯净性良好。

A.F2019TJ1; B.F2019TJ2; C.F2019TJ3; D.F2019BJ1; E.F2019BJ2; F.正常F81细胞A.F2019TJ1; B.F2019TJ2; C.F2019TJ3; D.F2019BJ1; E.F2019BJ2; F.Normal F81cells
2.3 分离毒株的间接免疫荧光鉴定
以鼠抗FCV单抗为一抗,FITC标记羊抗鼠IgG为荧光二抗,对5株FCV分离株进行间接免疫荧光鉴定(indirect immunofluorescence,IFA),结果显示,空白对照组未见绿色荧光,5株分离株接种的F81细胞均出现特异性绿色荧光(图3),结果表明5株分离株均为FCV,将其分别命名为F2019TJ1株、F2019TJ2株、F2019TJ3株、F2019BJ1株和F2019BJ2株。

A.F2019TJ1; B.F2019TJ2; C.F2019TJ3; D.F2019BJ1; E.F2019BJ2; F.正常F81细胞A.F2019TJ1; B.F2019TJ2; C.F2019TJ3; D.F2019BJ1; E.F2019BJ2; F.Normal F81cells
2.4 分离毒株病毒温度抵抗力试验结果
F2019TJ1株进行病毒温度抵抗力试验见图4。结果显示,分离株于4、25、37℃静置一段时间后,病毒含量出现不同程度的下降。其中4℃环境下分离株病毒含量下降最慢,静置144 h从109.50TCID50/mL降至108.50TCID50/mL;37℃环境下分离株病毒含量下降最快,放置7h从109.50TCID50/mL降至107.50TCID50/mL。由此表明FCV对温度敏感。
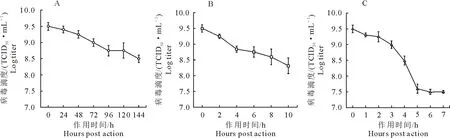
A.4℃;B.25℃;C.37℃
2.5 分离毒株VP1基因序列扩增和遗传进化分析
将5株FCV VP1基因测序结果与已发表的疫苗株和国内外流行的FCV VP1基因序列进行同源性分析,构建基因系统进化树(图5),结果显示5株FCV与国内外流行毒株之间核苷酸和氨基酸同源性分别为73.4%~83.6%和80.1%~92.1%。其中5株FCV分离株中F2019BJ1株与F2019BJ2株属于同一分支,而F2019TJ1株、F2019TJ2株和F2019TJ3株则分散在参考毒株之间。F2019BJ1株、F2019BJ2株和F2019TJ1株与美国的UTCVM-H2株遗传距离最近,核苷酸和氨基酸同源性分别为76.4%~78.8%和84.2%~85.8%;F2019TJ2株和F2019TJ3株与国内的FCV-GD株遗传距离最近,核苷酸同源性分别为81.2%和83.6%,氨基酸同源性分别为88.2%和92.1%。
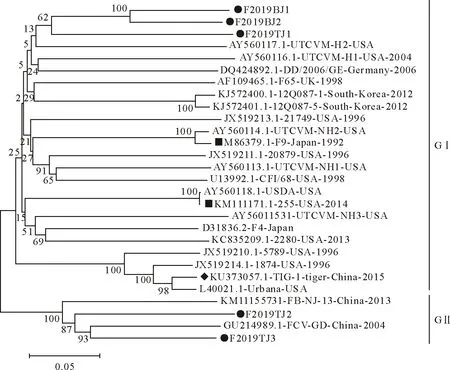
图5 不同FCV VP1基因核苷酸序列系统进化树
3 讨论
本研究是国内首次对京津两地同时进行FCV流行病学调查。2019年1月~3月京津两地患病猫眼鼻肛拭子中FCV、FHV-1和FPV阳性率分别为15.49%、30.98%、30.64%,与2018年广西南宁市[11]FCV阳性率(18.20%)差异不大,但2018年北京地区[12]FCV阳性率较高,为33.3%,其原因是样本来源为宠物医院上呼吸道感染的患猫。对不同年龄、不同性别猫数据进行比较发现,不同性别的猫对FCV易感度差异不大;不同年龄的猫均可感染FCV,小于1岁的猫对FCV更易感。这可能与年龄较小的猫免疫力较弱,在未接种疫苗的情况下,易受到上呼吸道病原的侵入有关。虽然宠物猫接种进口猫三联商品化疫苗已十分普遍,有研究发现已免疫FCV疫苗的猫场仍会暴发FCV,发病率达30%[13]。本试验数据显示已免疫的猫可感染FCV,而未免疫的猫更易感,说明目前进口猫三联商品化疫苗对天津、北京地区FCV流行毒株并不能产生完全的保护。在宠物医院观察发现,虽然FCV疫苗不能完全避免感染,但可以一定程度下减轻感染后的临床症状,因此疫苗的接种是十分必要的。目前已知FCV引起的临床症状为呼吸道症状、跛行和全身性症状,胃肠道症状一直被忽视,而杯状病毒科大多造成宿主胃肠道症状[14]。本次试验从部分患病猫肛拭子中检测到FCV核酸阳性,说明FCV可能通过肠道分泌物进行传播,对FCV的防控提出了更加严格的要求。
2015年,黄倩倩[15]研究发现,FCV在50℃静置30 min或70℃静置5 min即可灭活,但近期关于温度对FCV病毒滴度影响的报道较少。本研究对F2019TJ1株进行病毒温度抵抗力试验,结果显示,4、25、37℃条件下病毒滴度从109.5TCID50/mL下降到108.5TCID50/mL所需时间分别为144、9、4 h,其中37℃条件下病毒滴度下降最快,其次是25℃,最后是4℃。虽然FCV是一个无囊膜病毒,但其对热的抵抗力较弱。在环境温度处于30℃~50℃时,FCV表面蛋白质变性,破坏病毒完整性,导致病毒无法与细胞受体相结合或病毒无法正常脱壳,从而影响核酸的正常逸出,使病毒失去感染性。FCV中和试验过程中,应考虑FCV对温度敏感性的特点以及抗原与抗体在37℃中和1 h的影响,在进行FCV中和试验计算中和用毒病毒含量时,适当降低稀释倍数。
本研究对京津地区分离到的5株FCV进行VP1基因序列分析,发现5株FCV与疫苗株255株和F9株之间核苷酸同源性(73.4%~77.4%)和氨基酸同源性(82.5%~86.4%)较低。王浩等[16]分离到的1株广西分离株与疫苗株255株和F9株氨基酸变异率分别为46.7%和26.7%,这可能是疫苗免疫后不能对部分猫提供完全保护的重要原因。5株FCV与虎源性FCV毒株TIG-1株的核苷酸同源性(75.6%~76.8%)及氨基酸同源性(83.9%~86.7%)与其他毒株数据差异不大。杨清等[17]成功分离到1株虎源性FCV,提示FCV可能在猫和老虎甚至是其他猫科动物进行不同种属间的传播。相关研究发现基于ORF2核苷酸序列可将FCV毒株分为GⅠ和GⅡ两大进化群,GⅡ株群主要以国内分离的FCV毒株为主[18]。F2019BJ1株、F2019BJ2株和F2019TJ1株均属于GI株群,该株群主要以国外高致病性毒株为主,其原因可能是北京作为中国首都与国际间交流较多,而天津是因为与北京相邻的地理位置。F2019TJ2株和F2019TJ3株属于国内经典的GⅡ株群,这为后续筛选国内疫苗株提供了基础数据。虽然部分分离株属于同一株群,但其之间核苷酸同源性较低,更加证明了FCV的频繁变异。
FCV从发现能引起猫呼吸道症状至今已有50多年的历史了,由于其病毒聚合酶缺乏校对、保真度较低和不同FCV毒株之间的基因组重组而表现出高度的遗传多样性[19]。目前,在猫群中控制FCV的主要手段是接种疫苗。疫苗接种对于家养宠物猫能达到较好的防疫效果,但对于数量较多的流浪猫基地或其他猫养殖场所,病毒传播的概率更大,在疫苗接种的同时应加强饲养管理,定期对猫舍进行消毒,用餐时注意营养搭配且避免猫饲养密度过大。通过贝叶斯网络建模分析表明,减少群体规模和接种疫苗是与FCV感染直接相关的两个因素,也是控制FCV感染的主要目标[20]。商品化FCV疫苗分为弱毒苗和灭活苗,目前国内多使用多联灭活疫苗,免疫后能减轻一定的临床症状,但不能完全预防该病的发生,且接种过疫苗的猫对VS-FCV仍易感。FCV疫苗首免在6周龄~8周龄,3周~4周接种1次,共接种3次,之后每年注射1次进行免疫加强。感染FCV的猫大多食欲差,其原因主要是发热、口腔溃疡和因鼻腔充血引起的嗅觉失灵,可通过混合食物以增加香味,而非甾体抗炎药可用于治疗发热和口腔疼痛。对于较严重的与FCV相关的呼吸系统疾病,一般配合广谱抗生素进行治疗,以减少继发性细菌感染及相关的潜在并发症。目前,还没有直接作用的抗病毒药物被批准用于治疗FCV感染,VS-FCV的治疗也仅限于支持治疗[21-22],所以FCV的疫苗接种和定期消毒十分重要。