猪圆环病毒2型对外周血单核细胞中PD-1、PD-L1和IL-21转录水平的影响
朱艳平,何 勇,刘 佳,2,朗梦圆,岳 锋,郭东光,李 鹏,孙丽莎,马广飞,王选年
(1.新乡学院生命科学与基础医学学院/动物疫病分子诊断河南省工程实验室,河南新乡 453003; 2.郑州大学生命科学学院,河南郑州 453000;3.新乡市人民公园,河南新乡 453003)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是引起猪圆环病毒病的主要病原,PCV2感染导致猪的免疫细胞数量减少、免疫功能减弱,导致病毒在体内持续感染[1-2]。PCV2单独或与猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)混合感染后,白细胞介素10(interleukin 10,IL-10)和T细胞表面程序性死亡受体1(programmed cell death 1,PD-1)表达水平显著升高,导致机体免疫功能下降[3]。自然感染PCV2时,PD-1的配体PD-L1和PD-L2的转录水平均上升,细胞因子IL-2和γ干扰素(IFN-γ)的转录水平降低,外周血单核细胞(peripheral blood mononuclear cells,PBMCs)增殖能力显著降低,造成机体的免疫抑制[1,4]。因此,PCV2感染过程中PD-1/PD-L1通路激活发挥免疫负调节作用,在造成机体免疫抑制中发挥着重要作用,但是关于PCV2感染后导致PD-1/PD-L1通路激活的调节机制还不清楚。
课题组前期研究发现,PCV2感染猪的PBMCs时,能够扩增出猪白细胞介素17A(interleukin-17 A,IL-17A)基因,而正常猪PBMCs无法扩增出猪IL-17A基因[5],这表明在PCV2感染过程中,猪IL-17A基因的表达水平升高。又有研究表明,IL-17A的分泌受IL-21的影响,这是由于PCV2感染过程中,IL-6表达水平升高并与其受体结合,作用于Th17细胞后,导致IL-17A和IL-21的表达水平上升[6]。此外,Kader M等[7]的研究结果表明,在猴免疫缺陷病毒感染早期,猴黏膜组织中 IL-17 mRNA 表达水平随着IL-21 的表达,约上升 10倍~35 倍。又有研究显示,口蹄疫病毒(Foot and mouth disease virus,FMDV)感染过程中,IFN-γ和IL-21的表达水平升高与FMDV的抗体水平升高呈显著正相关,这表明IL-21可以提高机体的免疫反应并发挥着抗病毒作用[8]。据此,推测PCV2感染过程中,PD-1、PD-L1和IL-21的转录水平之间存在着直接的相关性。但是,目前关于PCV2感染过程中PD-1、PD-L1、IL-21的转录水平还未见相关报道。
因此,本研究以猪PCV2为研究对象,利用荧光定量PCR检测PCV2体外感染PBMCs时对PD-1、PD-L1和IL-21的转录水平的影响,为进一步研究PCV2的致病机制和防控PCV2感染奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 毒株 PCV2、PRRSV、伪狂犬病病毒(Pseudorabies virus,PRV)、猪瘟病毒(Classical swine fever virus,CSFV)毒株,均由新乡学院生命与基础医学学院和生物技术研究中心从临床发病猪体内分离、保存。
1.1.2 试验用动物 PCV2抗体阴性3月龄的健康猪2头,饲养于新乡某猪场。
1.1.3 主要试剂和酶类 cDNA反转录试剂盒、dNTPs、TB Green Premix Ex Ⅱ,宝生物工程(大连)有限公司产品;DNA提取试剂盒、DNA凝胶回收试剂盒,天根生化科技(北京)有限公司产品;Trizol,北京索莱宝生物科技有限公司产品;IL-2重组蛋白,以色列PROSPEC 公司产品;SYBR Green Ⅰ试剂盒,美国Applied Biosystems公司产品。
1.1.4 荧光定量PCR引物 PD-1、PD-L1、IL-21和β-actin的荧光定量PCR引物由上海生工生物工程技术服务有限公司合成,具体引物序列如表1。

表1 荧光定量PCR引物序列
1.1.5 主要仪器设备 微量核酸蛋白分析仪(Thermo Fisher Nanodrop One)、PCR反应仪(Veriti 96-Well Thermal Cycler)、荧光定量PCR仪(Quant Studio 6 Flex Real-Time PCR System),美国Thermo Fisher公司产品;倒置显微镜(Carl Zeiss primo vert 45510-1101-000),德国ZEISS公司产品;电子天平(Metle Toledo PL403),德国SaqRTorius公司产品;荧光显微镜(Nikon Ti -S/L100),尼康仪器有限公司产品。
1.2 方法
1.2.1 PBMCs的分离及PCV2的感染
1.2.1.1 PBMCs的分离 通过前腔静脉采集健康猪的血5 mL,加入1 mL的抗凝剂制成抗凝血,按照本实验室建立的方法分离PBMCs[5]。将获得的PBMCs在37℃、体积分数为5%CO2培养箱中培养。
1.2.1.2 PCV2体外感染猪PBMCs 将分离的PBMCs(经细胞计数,细胞浓度1×106个/mL)置于6孔板中,加入终浓度为6 μg/mL刀豆蛋白A(concanavalin,ConA)刺激,然后参考文献[9]的方法,加入100 μL 100 g/L RPMI-1640培养基、25 IU/mL IL-2重组蛋白、4 mmol/L L-谷氨酰胺、10 μL除菌猪血浆、100 IU/mL青霉素和100 μg/mL链霉素,37℃、体积分数为5% CO2培养箱中培养。将利用PK-15细胞增殖的PCV2,以100 TCID50的量感染PBMCs,设置空白细胞对照,每个试验做3个重复,轻轻摇匀,放入37℃、体积分数为5% CO2恒温培养箱中培养,吸附培养60 min。用PBS洗去未吸附的病毒,然后加入含20 mL/L胎牛血清、无菌的PCV2抗体阴性猪血清的RPMI1640培养基培养细胞。
1.2.2TaqMan探针实时荧光定量PCR检测PCV2方法的建立 通过建立PCV2的荧光定量PCR方法检测PCV2的病毒载量,根据病毒载量判断PK-15细胞增殖的PCV2能够感染PBMCs。
1.2.2.1 PCV2目的基因组DNA阳性标准品的制备 根据PCV2的基因序列(GenBank编号:TK19404.1),采用生物软件Primer Premier 5.0设计PCV2特异性引物和TaqMan探针,上游引物:5′-GGAAGTAATCAATAGTGGAA-3′,下游引物:5′-ACCCCTATGTAAACTACTC-3′,探针序列:5′-(FAM) ACCATAACCCAGCCCTTCTCC (Eclipse)-3′。利用DNA提取试剂盒提取PCV2的DNA,以提取的DNA为模板进行PCR。PCR反应结束后,用10 g/L琼脂糖凝胶电泳检测。利用PCR产物构建重组阳性质粒,经测序、比对正确的样品,作为阳性标准品,用核酸蛋白分光光度计测定质粒纯度,计算质粒拷贝数。将获得的质粒进行10倍倍比稀释,稀释度为1×102copies/μL~1×107copies/μL,置-80℃保存备用。
1.2.2.2 PCV2TaqMan探针实时荧光定量PCR标准曲线的建立 利用稀释的阳性标准品,以 10-1~10-5梯度倍比稀释作为标准模板,同时设置阴性对照孔。荧光定量PCR反应程序:DNA 2 μL,上、下游引物各0.4 μL,Premix ExTaqTM(Probe qPCR)(2×),10.0 μL,探针 0.8 μL,ROX Reference Dye Ⅱ(50×),0.2 μL;ddH2O 补至25 μL,进行PCR扩增,反应程序:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环:72℃ 8 min。检测标准品的6个浓度梯度(102copies/μL~107copies/μL),将不同浓度的质粒模板进行3次重复,得到相应的扩增曲线和标准曲线。根据R2值和扩增曲线判断其重复性。取稀释好的标准品9×103、9×102、9×101copies/μL,用建立的荧光定量PCR方法进行检测,确定该检测方法的灵敏度。分别提取PCV2、PRRSV、PRV、CSFV的cDNA或DNA为模板进行TaqMan荧光定量PCR检测,确定该检测方法的特异性。
1.2.3 感染PCV2的猪PBMCs中病毒核酸载量 分别于PCV2接种PBMCs后的12、24、36、48、60、72 h收集细胞,将孔板置-80℃反复冻融3次,4℃离心20 min,收集上清。抽提病毒基因组DNA,按照建立的荧光定量PCR方法进行检测,每个样品做3个重复,记录CT值,根据标准曲线计算PBMCs中PCV2的病毒载量。
1.2.4 PCV2感染猪PBMCs中PD-1、PD-L1和IL-21核酸的定量检测 按照RNA提取试剂盒的说明书提取PCV2感染的PBMCs的RNA,进行反转录,反转录步骤如下:37℃孵育15 min,85℃水浴5 s,4℃冷却即为cDNA。利用本实验室建立的猪PD-1、PD-L1和IL-21的荧光定量PCR方法[9],进行PD-1、PD-L1和IL-21的检测。
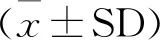
2 结果
2.1 猪PBMCs的分离
将获得的PBMCs在37℃、体积分数为5%CO2培养箱中培养,能够看到细胞透亮、分散均匀,死亡细胞和细胞碎片都比较少,能够满足后续试验的需要(图1)。

图1 健康猪外周血分离的PBMCs(200×)
2.2 PCR扩增PCV2目的基因鉴定结果
提取病毒DNA后进行普通PCR。PCR产物电泳检测显示,目的条带与预期条带大小一致,如图2所示。产物经回收、连接、转化后挑选获得阳性克隆,经测序比对与预期结果一致。提取质粒后,OD260 nm/OD280 nm值均在1.8~2.0之间,单位体积中质粒的拷贝数为9×1010copies/μL。

M.DNA标准DL 2 000;1~3.PCV2的PCR产物;4.PCV2阴性对照
2.3 标准曲线的绘制
将阳性标准品1∶10倍倍比稀释,浓度从107copies/μL~102copies/μL,建立标准曲线,如图3和图4所示,扩增曲线良好,直线方程为y=-3.591x+40.773。通过标准曲线可知,变异系数R2≥0.999,表明该试验误差较小,并且可靠、准确,可以用于目的基因的检测。

1.9×107 copies/μL;2.9×106 copies/μL;3.9×105 copies/μL;4.9×104 copies/μL;5.9×103 copies/μL;6.9×102 copies/μL

图4 标准品的标准曲线
2.4 方法的重复性
将不同浓度的模板做3个平行,结果见图3,均有良好的扩增曲线,表明建立的TaqMan探针荧光定量PCR方法具有良好的稳定性。
2.5 方法的敏感性
将标准品以10倍倍比稀释,取浓度分别为9×103、9×102、9×101copies/μL标准品,获得动力学曲线,如图5所示,标准品浓度为9×103copies/μL和 9×102copies/μL时均出现良好的扩增,9×101copies/μL时,扩增曲线不理想。结果表明,TaqMan探针荧光定量PCR方法检测质粒的灵敏度达到9×102copies/μL。
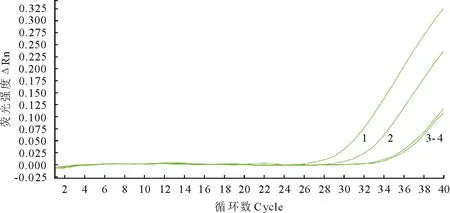
1.9×103 copies/μL;2.9×102 copies/μL;3.9×101 copies/μL;4.阴性对照1.9×103 copies/μL;2.9×102 copies/μL;3.9×101 copies/μL;4.Negative control
2.6 方法的特异性
对PCV2、PRV、PRRSV、CSFV所抽提的DNA或cDNA为模板和双蒸水进行TaqMan 荧光定量PCR检测。由图6可知,该方法对PCV2 DNA样品有良好的适应性,只有PCV2样品的检测结果有荧光产生且扩增曲线良好,对PRRSV、CSFV、PRV和无菌水检测结果均无荧光产生,证明该方法在病毒样品PCV2的检测中有很好的特异性。

1.PCV2;2.阴性对照;3.狂犬病病毒;4.猪繁殖与呼吸综合征病毒;5.猪瘟病毒1.PCV2;2.Negative control;3.PRV;4.PRRSV;5.CSFV
2.7 猪PBMCs PCV2病毒核酸载量
PCV2感染猪PBMCs后,分别在12、24、36、48、60、72 h收集细胞,提取病毒DNA,利用建立的TaqMan荧光定量PCR方法检测PCV2的病毒载量,获得其不同时间点在细胞中的增殖。结果显示,PCV2在PBMCs中随着时间的延长,病毒载量逐渐升高,一直持续到72 h,说明PCV2能在体外感染PBMCs进行增殖,结果如图7所示。
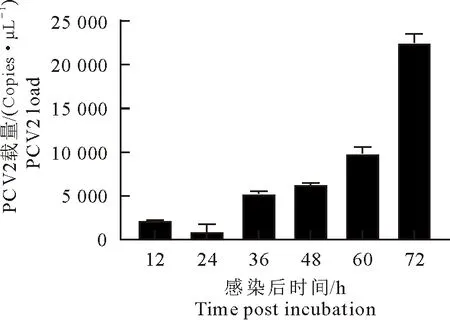
图7 PCV2感染PBMCs过程中的病毒载量变化
2.8 荧光定量PCR检测PCV2感染猪PBMCs中PD-1、PD-L1和IL-21的转录变化
当PBMCs体外被PCV2感染后,分别于12、24、36、48、60、72 h收取细胞,提其RNA并反转录成cDNA,然后进行荧光定量PCR扩增。结果显示,PD-1和PD-L1都转录上调,PD-1在60 h~72 h上调最明显,在72 h时达到峰值(P<0.01);PD-L1在12 h~72 h表达上调很明显(P<0.01),并且转录水平都高于PD-1,如图8所示。

“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)“* ”indicates significant differences (P<0.05),“**” indicates extremely significant differences (P<0.01)
PCV2体外感染PBMCs后,每间隔12 h收集细胞样品直至72 h。利用RNA抽提试剂盒提取其RNA,并反转录成cDNA,然后进行荧光定量PCR扩增。结果显示,IL-21明显转录上调,并且在12 h~24 h和60 h~72 h上调最明显(P<0.01),60 h时达到峰值,结果如图9所示。
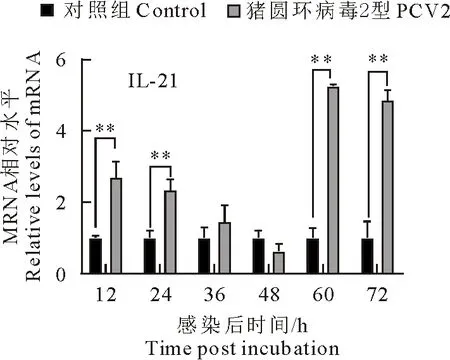
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)
3 讨论
PCV2作为一种重要的动物免疫抑制性疾病病原,给我国养猪业带来严重的经济损失[10]。目前,PCV2主要依靠各种疫苗进行预防,减少经济损失[11-12]。此外,PCV2致病机制的研究集中在与免疫相关的细胞因子分泌变化的调节机制。研究表明,PCV2感染过程中,PD-1、PD-L1的转录水平上升,导致正向免疫调节的细胞因子IL-2和IFN-γ的转录水平降低,PBMCs增殖能力显著降低[1]。IL-21属于IL-2家族的成员,与 IL-2 结构类似,主要由活化的CD4+T细胞和NK细胞分泌产生。由于其受体表达于多种免疫细胞(B细胞、T细胞、NK细胞、巨噬细胞和树突状细胞)表面,在先天性和适应性免疫应答中发挥重要的免疫调节作用,尤其在机体的细胞免疫和体液免疫方面发挥着至关重要的作用[13]。体外培养艾滋病病毒患者的PBMCs发现IL-21能够增加CD8+T细胞的毒性作用,抵抗艾滋病病毒的感染。因此,IL-21对调节机体的免疫和清除病毒感染至关重要。然而,关于PCV2感染和IL-21表达水平之间的研究还鲜有报道,目前只有对FMDV和PRRSV感染后的研究,发现IL-21能够提高机体的抗体水平发挥抗病毒作用[8]。前期研究发现,与IL-21相关的IL-17A转录水平升高[5]。据此,推测PCV2感染过程中IL-21的转录水平也升高。因此,为了研究PCV2感染过程中IL-21的转录水平变化,利用PCV2体外感染PBMCs,建立PCV2的病毒载量的检测方法,分析PCV2在PBMCs增殖后对IL-21转录水平的影响。
PCV2感染后IL-6的表达水平上升,并通过与其受体结合,活化信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3),导致IL-17和IL-21的转录水平上升[13],而IL-21又可以直接增加T细胞上PD-1的表达[14],从而降低IL-21的抗肿瘤作用[15]。相关研究表明,磷酸化的STAT3和PD-1共同促进IL-17的表达。因此,STAT3可能在IL-21和PD-1、PD-L1的表达调控中发挥着重要的作用。同时,查阅文献也发现,IL-21也是PD-L1和PD-L2的刺激物[16],IL-21升高促进PD-L1的表达,这在研究结果中也有体现。我们的研究还发现,PCV2感染后IL-21的转录水平升高,进一步促进了PD-L1的转录水平上升,在48h达到峰值。但是还发现PD-1/PD-L1通路激活后,IL-21的转录水平反而下降,并且在48h达到最低值,比正常细胞还要低。这也体现在自然感染PCV2时,随着时间延长,PD-L1转录水平上升,正向免疫调节的细胞因子IL-2、IFN-γ等转录水平降低[4]。因此,PCV2体外感染PBMCs时,随着病毒载量的增加,PD-L1和IL-21的转录水平增高,这与预期的试验结果相一致。
随着PD-1、PD-L1的转录水平增高,抑制了IL-21的转录水平,通过荧光定量PCR方法检测发现,在PCV2感染后60 h时IL-21的转录水平达到峰值,一直持续到72 h仍然显著增高;同时,PD-1、PD-L1的转录水平也增高,但是转录水平低于IL-21。由于IL-21通过STAT3磷酸化提高PD-1的表达水平[14,17],引起病毒感染。另外,IL-21也能够提高PD-L1和PD-L2的表达水平,激活PD-1/PD-Ls通路,导致机体发生免疫抑制。
综上所述,PCV2在体外感染PBMCs时,随着病毒载量的增加导致PD-1、PD-L1和IL-21的转录水平上升,但是由于PD-1和PD-L1转录水平升高又反过来抑制了IL-21的转录;机体为了清除病毒,调动免疫系统产生更多的IL-21。但是,PCV2感染过程中PD-1、PD-L1与IL-21之间的相互作用机制还不清楚。又由于IL-21能够通过提高STAT3磷酸化提高PD-1的表达[14],因此推测STAT3可能在PD-1、PD-L1和IL-21之间的相互调控中发挥重要作用。本文为进一步研究PD-1、PD-L1和IL-21的之间的相互调控机制奠定了理论基础,也为后期阻断PD-1/PD-L1控制PCV2感染提供新的途径。