酶法修饰对大豆分离蛋白凝胶性质 影响的研究进展
王佳蓉,丁阳月,姜云庆,董和亮,王秋野,程建军,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江省质量监督检测研究院,黑龙江 哈尔滨 150028)
随着现代大豆加工业的发展,目前可利用的大豆蛋白种类和产品日益增多,如脱脂大豆粉、大豆分离蛋白(soybean protein isolate,SPI)、大豆浓缩蛋白及大豆组织蛋白等[1]。其中SPI是以低温脱溶大豆粕为原料,去除可溶性及不可溶性碳水化合物、灰分等得到的蛋白质量分数达90%(干基)以上的一种全价蛋白,具有来源广泛、经济价值以及营养价值较高等特点,是一种被广泛应用的食品基料[2]。
SPI分子经热处理而发生解聚,未折叠分子通过二硫键、氢键、疏水相互作用和/或范德华力发生不可逆排列和聚集,从而形成三维网络结构[3-4]。SPI凝胶具有较高的黏度、弹性和可塑性,既可以作为水、糖类和其他物质的载体,也可作为风味物质。近年来,SPI凝胶常被用作新型食品包材[5-6]。该类包装薄膜常具有适度的机械性能以及突出的氧与油脂阻隔能力;此外,SPI凝胶的物理性质与肌肉蛋白(尤其是肌球蛋白)凝胶类似,在肉品工业中还常被用作黏合剂[7],以改善粉碎肌肉食品的功能特性。同时,SPI凝胶还可用作生产具有紧密组织状结构的肉类类似物[8],以降低配方成本,具有较高的增值潜力。在医药方面,基于SPI凝胶制得的生物聚合物纳米载体[9-10]可以防止药物受到工艺和环境条件的破坏,将药物安全地输送到靶向器官和细胞。
然而,因加工过程和工艺参数的差异,SPI的凝胶性质常受到破坏;其中采用“碱溶酸沉”传统方法生产的SPI往往发生部分变性。特别是因SPI分子质量较大,一旦体系碱性降低,静电斥力随之减弱,蛋白质会迅速折叠与聚集,最终常会以热力学稳定的水不溶性大聚集体和/或 沉淀形式出现[11],对其凝胶性能产生不利影响。为了更好地满足食品工业发展的需要,通常要对SPI进行改性。
与物理、化学改性相比,酶法改性不仅能改善蛋白的各种功能特性,而且还具有安全性高、专一性强、能提高SPI制品营养价值等优点。有很多研究者在此方面做了大量研究,例如赵新淮等[12]将SPI经胰蛋白酶酶解后,发现其凝胶性得到显著改善,主要表现在SPI的凝胶结构变得更为紧密。酶法修饰是大豆蛋白降解改性方法中的一种,通过限制性水解肽键,可使大豆蛋白体系中的官能团暴露量增加,为后续改性提供更多的反应位点。
近年来的研究发现酶法修饰对SPI凝胶性能产生影响的作用机理主要包括利用酶限制性水解蛋白的肽键或酰胺键以暴露出更多的SPI反应位点、连接特殊的功能基团以及增加蛋白分子间/内交联3 个方面[13]。因此,本研究分析了SPI凝胶的形成机理,重点讨论了3 种酶法修饰手段(即限制性酶解、酶诱导的侧链接枝反应以及酶诱导的交联反应)对于SPI凝胶性能(如凝胶强度、持水能力以及凝胶表面形貌等)产生的影响,为以SPI凝胶为基质的产品生产提供一定的理论依据。
1 SPI凝胶形成机理
凝胶是由变性蛋白分子经聚集而形成的具有特定空间结构的物质。这种特定的空间结构是蛋白质分子间斥力(如静电斥力与蛋白质的水合作用)与引力(如静电引力、蛋白质分子间/内氢键、二硫键、疏水相互作用及范德华力)达到平衡(图1)的作用结果[14-15]。此外,凝胶在微观上表现为蛋白分子间的引力与斥力达到平衡,在宏观上则表现为形成了半固体倒置不流动的胶状物质。此外,蛋白质凝胶的形成还与诸多外界条件,如温度、pH值或离子强度有关,这些因素增强了原来有限的蛋白质-蛋 白质相互作用,弱化了蛋白质的水合作用,从而诱导凝胶形成;在酶法修饰SPI的凝胶形成过程中,外界条件可能会通过影响酶的活性从而影响最终的凝胶性能[16-17]。

图1 SPI分子中的化学键[14]Fig.1 Chemical bonds in SPI molecules[14]
1.1 SPI热凝胶的形成
SPI凝胶的制备主要是通过高温处理或加入盐类、酸类凝固剂等方法。大多数球蛋白经加热可形成凝胶,SPI中球蛋白相对含量最高可达90%[18],故SPI受热时易形成凝胶。SPI热凝胶的形成一般包括4 个阶段[19-20](图2):1)天然SPI球蛋白的小聚集体在加热过程中解离;2)分离后的蛋白再次结合,形成半径在30~50 nm致密且近似球形的颗粒;3)这些颗粒随机聚集,形成分形维数约为2的自相似聚集体,且这些聚集体中蛋白分子间的键作用力足够强,可以抵抗外力的破坏;4)这些聚集体之间通过各种相互作用形成凝胶网络结构。
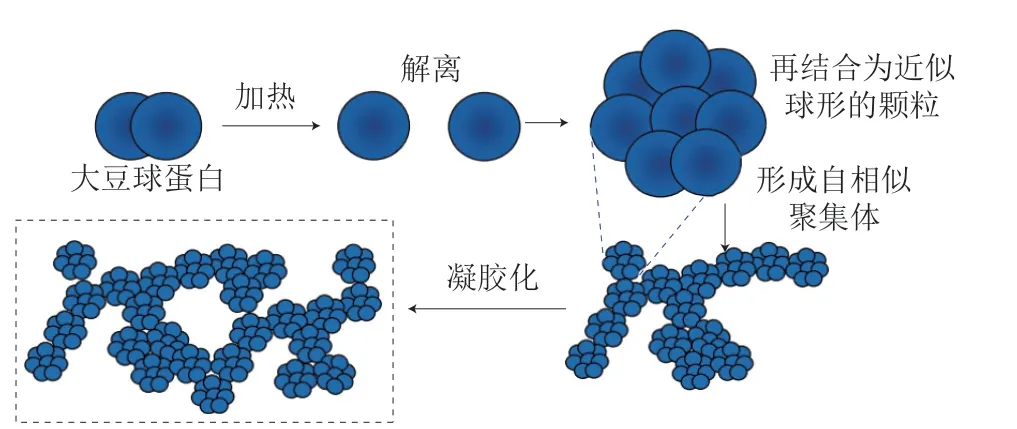
图2 热致SPI凝胶化示意图[19-20]Fig.2 Schematic diagram of thermally induced SPI gelation[19-20]
1.2 SPI冷凝胶的形成
Bryant等[21]发现蛋白质冷凝胶的形成可以分为两个阶段:1)热变性球蛋白溶液的制备;2)在室温下诱导变性蛋白的凝胶化,其中诱导因素包括酸和盐两种。
利用热变性的大豆蛋白溶液可以通过逐渐酸化来诱导形成凝胶。SPI的酸化方式[22]主要有两种:1)当体系中有产酸微生物存在时,在乳酸发酵过程中,糖代谢成乳酸,使pH值逐渐降低[23-24];2)利用葡萄糖酸-δ-内酯(glucono-δ-lactone,GDL)诱导凝胶的形成(图3)。这主要因为GDL是水溶性的,可缓慢地水解成葡萄糖酸,使体系pH值均匀下降且操作过程无需搅拦。当体系的pH值向蛋白质等电点靠近时,蛋白分子间的静电斥力逐渐减小,通过随机聚集诱导凝胶形成。此类凝胶通常由大的随机聚集体组成,最终会形成较粗糙的蛋白质网络。
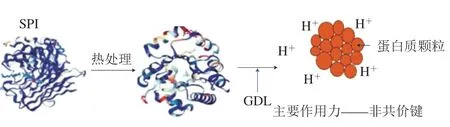
图3 GDL酸诱导大豆蛋白凝胶[22]Fig.3 Glucono-δ-lactone acid induced soybean protein gelation[22]
盐诱导也是SPI冷凝胶形成的常用途径,不同盐离子对SPI凝胶的作用机制差异较大[25],其中较为常用的是向大豆蛋白溶液中添加钙离子盐,可以通过Ca2+的“盐桥”作用充当蛋白质分子带电羧基间的桥梁,以降低蛋白质分子间的静电斥力,诱导SPI三维凝胶结构形成[26-27]。Kao等[27]研究发现,与其他凝固剂(如MgCl2、MgSO4和CaCl2)相比,利用CaSO4制备形成的凝胶结构更均匀、平滑。
2 限制性酶解改善SPI凝胶性
2.1 限制性酶解
Lamsal等[28]发现通过控制SPI的酶水解过程可以获得具有所需特定功能的成分。其中,具有高凝胶强度和高黏度的大豆蛋白可以在粉碎的肉制品和肉汁中用作保水剂,而具有较弱凝胶特性和低黏度的大豆蛋白则在酸奶、汤料和婴儿配方食品中应用广泛。水解对蛋白质凝胶的增强作用是水解产物的特殊性质,Panyam等[29]发现酶水解会导致蛋白水解产物的分子质量降低,电离基团数目增加,同时使先前包埋于分子内部的疏水性基团暴露。关于酶解处理对SPI凝胶性能的影响,早期研究主要集中在水解对大豆蛋白凝乳与即食豆腐的生产中[30-31]。钟芳等[32]通过添加6 种商用蛋白酶诱导大豆蛋白胶凝以制备速凝豆腐粉,并探究此过程体系黏弹性质的变化,研究发现木瓜蛋白酶和碱性蛋白酶具有较强使大豆蛋白胶凝的 能力;同时进一步研究发现通过添加以上两种酶诱导SPI胶凝,维持凝胶结构的主要作用力是氢键和疏水相互作用(次级键),而离子键和二硫键的贡献则较低[32-33]。
根据酶解后蛋白质分子质量的范围及酶解程度,可将蛋白酶解过程分为轻度酶解(约90%的多肽分子质量大于5 000 Da)、中度酶解(约46%的多肽分子质量大于5 000 Da)及深度酶解(90%的多肽分子质量小于500 Da)3 类[28]。其中限制性酶解(轻度或中度酶解)与SPI凝胶性能关系密切,这主要因为凝胶的形成有赖于蛋白分子间的相互作用,而水解程度过高可能导致蛋白质-蛋 白质相互作用减少、水解物表面疏水性降低和/或水解肽之间电荷排斥力增加,降低酶解蛋白的凝胶能力,以及引起食品中不良风味“苦味肽”的产生[34-35];反之,适当的水解程度有利于肽链中反应位点的暴露,可以增加蛋白分子间相互作用的可能性[36]。Creusot等[30]的研究表明,适度的酶促水解可使埋藏在蛋白分子内部的非极性氨基酸残基暴露,增强蛋白分子间的疏水相互作用,改善凝胶结构。
2.2 限制性酶解对SPI热致凝胶性质的影响
酶解处理对SPI凝胶性能的改变是具有高度酶特异性的[12,27-28,37],为实现对SPI水解过程的控制,了解常用蛋白酶的作用特性意义重大(表1)。赵新淮等[12]通过添加中性蛋白酶和胰蛋白酶在不同水解度(1%和2%)下对SPI进行酶解,发现经中性蛋白酶在较低水解度下处理后,SPI的凝胶性能良好;而经胰蛋白酶处理后,SPI的凝胶性可以得到显著改善。这主要是因为中性蛋白酶催化反应的作用位点比胰蛋白酶多,水解程度大,水解产物分子质量较低,由此会形成较弱的凝胶结构。Hrčková等[17]通过添加Alcalase碱性蛋白酶、Novo蛋白酶和风味蛋白酶对脱脂大豆粉进行酶解,发现经风味酶水解处理后,大豆蛋白凝胶强度显著提高。这是因为风味蛋白酶兼有内切蛋白酶与外切肽酶两种活性,产生的作用效果更明显。此外,部分研究还发现菠萝蛋白酶会对SPI凝胶的硬度造成损害。Fuke等[37]发现采用菠萝蛋白酶诱导SPI凝胶化时,菠萝蛋白酶主要作用于大豆球蛋白,并将其水解成低分子质量片段继而诱导蛋白聚集;与热致SPI凝胶相比,经菠萝蛋白酶诱导的凝胶结构较柔软。Lamsal等[28]采用菠萝蛋白酶对大豆蛋白产品正己烷脱脂豆粉、挤压膨化大豆粉、大豆浓缩蛋白和SPI进行水解改性,使其水解度分别达到2%和4%,结果表明在水解过程中尽管储能模量下降明显,但水解产物一直保有胶凝能力;而与未水解的大豆蛋白产品相比较,经水解后,蛋白凝胶的硬度均有所下降。

表1 SPI酶解过程中商用酶的种类及特征Table 1 Types and characteristics of commercial enzymes used for SPI enzymatic hydrolysis
2.3 限制性酶解对SPI酸致凝胶性质的影响
由于SPI的水解过程可以在室温下发生,因此酶水解是改善SPI冷凝胶性质一种有效手段。Kuipers等[16]通过Carlsberg枯草杆菌蛋白酶制备了水解度高达10%的SPI水解产物,并添加GDL诱导冷凝胶形成,研究表明随着水解度的增加,SPI水解物的凝胶化起始pH值也会提升,凝胶变得更柔软。比较明显的是,未水解的SPI在pH值约为6.0时形成凝胶,而水解度5%的SPI水解液在pH值约为7.6时方可形成凝胶。由此可知,在中性或弱酸性的食品中,可以通过控制水解度来提高SPI凝胶化的起始pH值。
3 转谷氨酰胺酶诱导的侧链接枝与交联反应改善SPI 凝胶性
转谷氨酰胺酶(transglutaminase,TG)现已被广泛应用于改善包括大豆蛋白、小麦蛋白、豌豆蛋白、乳清蛋白、酪蛋白、肌原纤维蛋白和肌球蛋白在内的多种食物蛋白的凝胶性和质构特性[42]。
TG作用机制可分为3 类[43-44]:1)氨基导入交联:这也是TG途径[45]糖基化过程的反应机理,近年来有关酶催化接枝反应对SPI凝胶性能影响的研究主要集中在探究TG诱导的SPI糖基化接枝反应;2)共价交联作用:当蛋白质中有赖氨酸、谷氨酰胺等含氨基氨基酸存在时,该交联即可发生(图4);3)脱酰氨基反应:体系中无氨基存在时,水会成为酰基受体,发生催化水解,谷氨酰胺残基脱去氨基生成谷氨酸残基。
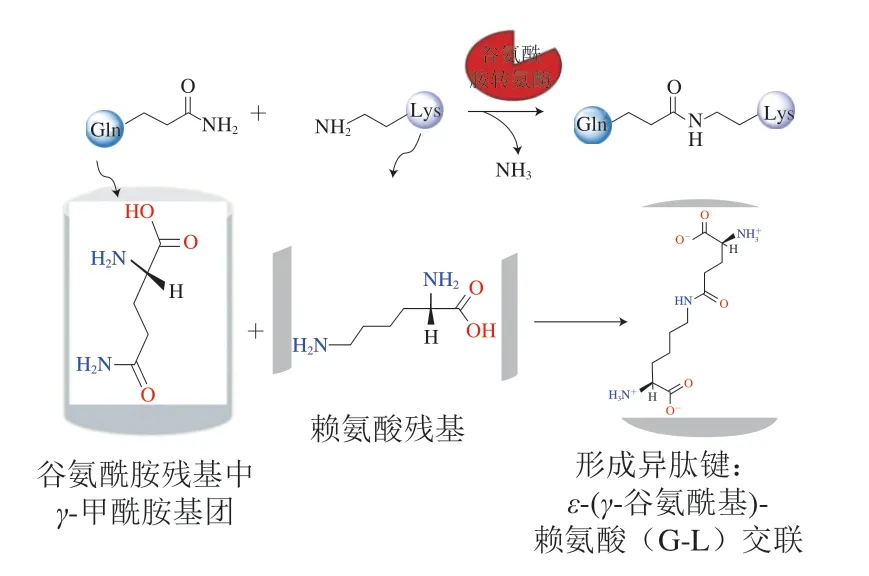
图4 TG催化的共价交联反应[44]Fig.4 TG-induced covalent cross-linking reaction[44]
TG的催化会促使蛋白结构改变,从而引起蛋白质的多种功能特性(如凝胶性、热稳定性、乳化性、保水性、流变性等)发生变化,获得新型的SPI产品。催化技术的新方向是利用酶对蛋白质结构进行不切割的共价修饰。 研究发现,添加TG诱导的各种反应都会对蛋白的结构 产生影响,这会导致其功能性质发生变化,影响蛋白的溶解性、凝胶性、乳化性、起泡性与黏性等,并获得更稳定、复杂且具有增强或创新质构特性的产物[46](图5)。
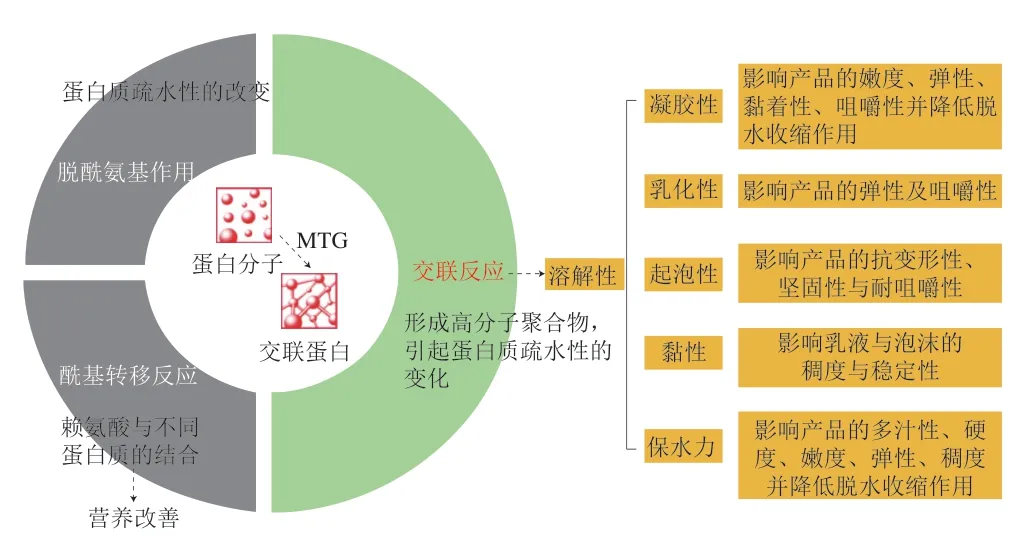
图5 TG催化的反应对蛋白功能性质的影响[46]Fig.5 Effects of transglutaminase (TG)-induced reactions on the functional properties of proteins[46]
3.1 TG诱导的糖基化接枝反应改善SPI凝胶性
Fan Junfu[47]、Yang Anshu[48]和Li Weiwei[49]等研究发现SPI经糖基化接枝改性,可以将亲水性的糖类物质以共价键的方式插入蛋白质分子中,使糖基化蛋白既具有蛋白质的功能特性,又具有糖类物质的亲水能力。
SPI经酶解处理后,蛋白中的有序结构含量迅速减少,无规卷曲结构含量增多,使蛋白的折叠结构打开更充分,有利于后续接枝反应的进行。Zhang Yating等[50]以SPI和麦芽糊精为主要原料,采用蛋白酶解-糖基化接枝和糖基化接枝-蛋白酶解两种复合改性手段制备多功能食品乳化稳定剂;结果发现,通过以上两种途径制备的微胶囊表面均呈现均一、多孔的显微结构。
3.2 TG诱导的交联反应改善SPI凝胶性
SPI凝胶的形成依赖于分子间/内作用力的平衡,Qin Χinsheng等[51-52]的研究表明TG在SPI的交联过程中可以诱导分子间二硫键的形成,降低体系游离巯基的含量,从而明显改善SPI凝胶的流变性,形成更致密均匀的凝胶三维网络。Χing Guangliang等[53-54]在以大豆蛋白/牛奶蛋白为原料研制“生物豆腐”的过程中发现,添加TG可以有效地控制能量的摄入以及降低蛋白的致敏性。总体而言,添加TG可以使SPI中的赖氨酸免受化学反应的破坏,且酶促反应条件温和而广泛,有助于改善蛋白凝胶的弹性和保水能力。与其他化学交联剂如单宁酸、京尼平等相比,TG具有更高的安全性与经济性。
在任何以蛋白质为基础的食品体系中,TG催化的共价交联反应都比酰基转移和脱酰胺反应进行得更快[44]。即使在相当低的蛋白浓度下,TG也可诱导形成具有高弹性和不可逆的凝胶结构[55]。将与TG混合的蛋白溶液平铺于玻璃板上并烘干后,可获得透明、耐水和耐热的蛋白薄膜,这种蛋白膜可被消化酶缓慢消化。相反,未经TG处理的薄膜和凝胶则会立即被消化酶消化。此外, 水包油型乳液中的蛋白也可被TG诱导形成凝胶。此外,TG催化异源蛋白,可诱导形成具有更优异机械性质和流体力学性质的杂聚合物凝胶(图6)。

图6 由TG催化的异源蛋白间的交联[55]Fig.6 Crosslinking between heterologous proteins catalyzed by TG[55]
近几年的研究中,TG主要被用于催化异源蛋白间的交联,这为更精确地改变凝胶食品的微观结构和质构特性提供了更大的可操作性。在凝胶类食品的冷冻和解冻过程中,伴随着冰晶的形成与消失,使得凝胶质地受损,影响产品的整体品质;研究发现,明胶具有控制产品中冰晶生长的能力[56],Chen Zhenjia等[57]为改善SPI凝胶的冻融稳定性,利用TG催化SPI与明胶交联制备混合蛋白凝胶,发现将此复合凝胶体系冷冻保存后,凝胶的持水率提高,凝胶结构也得到有效保护。此外,明胶还具备优异的成膜能力,可与SPI凝胶协同使用,现已将此特性用于制作新型食品包装材料[58]、豆腐乳[59]等。综上,应用TG催化异源蛋白混合制备复合凝胶,可使SPI和明胶劣势性能得到改良。Cui Qiang等[60]应用TG催化SPI和乳清分离蛋白交联制备复合凝胶,其中乳清分离蛋白的凝胶性较差,SPI的乳化性较差,将SPI与乳清分离蛋白复合使用可使两者优势互补。Qin Χinsheng等[51-52]通过TG催化SPI和小麦面筋蛋白交联,SPI中富含赖氨酸但缺乏谷氨酰胺,这与小麦面筋蛋白的性质截然相反,二者交联有助于相互均衡与改良摄入的营养结构。此外,由TG催化的交联反应也存在一定弊端,主要是因为该交联反应形成了较高分子质量的蛋白质聚合物,对改性蛋白的溶解度、乳化特性和体外消化率等产生了不 利影响[52-53]。Sheng Wenwen等[61]应用TG交联SPI和明胶后,使用胰蛋白酶对复合凝胶材料进行水解,发现水解产物比SPI具有更强的流变性能和持水能力,比SPI与明胶的交联凝胶产物具有更好的乳化和吸油能力。这表明经TG催化的交联产物经蛋白酶进一步水解后,可能会对复合凝胶的性能有改良作用,是一种潜在的新型食品加工蛋白原料。
4 其他酶诱导的交联反应改善SPI凝胶性
漆酶作为一种糖蛋白可以氧化酚羟基在内的多种底物,底物中的电子在漆酶的作用下可以转移到氧分子上形成水,漆酶的作用底物广泛且活性高[62-63]。SPI中的酪氨酸和甜菜果胶中的阿魏酸均可被漆酶高效利用。Feng Liping等[62]以甜菜果胶/SPI为基质通过漆酶催化与热诱导交联制备乳液填充凝胶,发现添加适当浓度的乳液有利于改善凝胶的质构特性和微观结构;而当添加乳液质量分数达到10%时,凝胶的硬度、黏性达到最高值,可形成性能稳定的缓释输送系统。
过氧化物酶是一种血红素酶,与漆酶类似,过氧化物酶也可作用于多糖中的阿魏酸与蛋白质中的酪氨酸,催化多糖与蛋白交联形成复合凝胶。Yan Jinxin等[64]使用过氧化物酶和Ca2+两种交联剂分别诱导阿拉伯木聚糖(arabinoxylans,AΧ)和SPI形成凝胶网络,制备混合凝胶。研究发现,双诱导AΧ-SPI混合凝胶比AΧ凝胶的内部结构更加规则且均匀。傅里叶变换红外光谱分析结果表明,过氧化物酶可诱导AΧ中的阿魏酸与SPI中的酪氨酸产生交联。此外,以不同顺序加入两种诱导剂形成的复合凝胶结构也存在差异;当先加入Ca2+时,SPI分子快速聚集产生空间位阻效应,阻碍AΧ分子的交联。这也表明通过调整交联剂的加入顺序,可以制备出具有不同力学性能和网络结构的凝胶。
5 酶法修饰与其他技术结合改善SPI凝胶性
5.1 酶解与其他技术结合
天然SPI因具有复杂的三、四级结构[36]使其酶促反应速率低下,在研究中将酶解与其他处理手段,如热变性[65]、 超声等相结合,可以增加SPI的酶切位点。Lamsal等[28]发现天然与变性SPI在水解过程中的表现截然不同,天然的球状蛋白通常对酶水解有抗性,因为SPI紧密的三级结构会保护蛋白分子中的肽键;而变性蛋白与大多数经过加工的大豆蛋白产品类似,分子内部的反应位点已暴露出来。考虑到SPI酶解过程的高成本,加热已成为一种最高效、直接的辅助处理手段。
5.2 TG催化交联反应与其他技术结合
将TG处理与蛋白物理改性技术相结合可明显改善SPI的凝胶性能,该复合改性技术现已广泛应用于豆腐、奶酪、肉类蛋白、香肠、火腿肠和蛋白饮料等食品蛋白凝胶工业中。Cui Qiang等[60]发现经超声处理后,利用TG催化交联的SPI/乳清蛋白复合凝胶强度和持水率均显著提高,这可能是由于超声处理产生的空化效应使蛋白分子内部基团暴露,增加了TG作用位点。此外,Zhou Guowei等[66]发现适度的超声处理(360 W)可以提高SPI凝胶的冻融稳定性。Qin Χinsheng等[42]的研究也表明,适当的微波预处理(700 W)可加速蛋白结构的展开和反应位点的暴露,促进酶促交联反应。Qin Χinsheng等[51]还探讨了超高压(100~400 MPa)预处理对TG诱导的SPI和小麦面筋蛋白混合凝胶特性的作用,发现超高压处理可诱导SPI/面筋蛋白分子内去折叠和聚集,促使体系中游离巯基含量和表面疏水性增加,最终形成更致密均匀的凝胶网络结构。
6 结 语
SPI凝胶用途日渐广泛,大量研究发现天然SPI凝胶性能较差,因此使用多种手段来改善其功能特性。其中, 酶法处理已被证实对SPI凝胶结构有着明显的修饰效果,且更多元的酶改性方式也逐渐被探索。酶法修饰对SPI凝胶性能的作用方式主要有3 种:1)利用蛋白酶限制性水解蛋白的肽键或酰胺键以暴露出更多的SPI反应位点,而且酶解处理对SPI凝胶性能的改变具有高度酶特异性,主要与不同种类酶的活性中心、作用方式有关。2)利用酶使蛋白侧链连接特殊的功能基团,如利用TG诱导SPI的糖基化接枝反应,使改性糖基化蛋白既具有蛋白质的功能特性,又具有糖类物质的亲水特性,同时有助于SPI凝胶表面形貌的改善。3)酶诱导蛋白分子间/分子内的交联会对蛋白的凝胶、乳化和起泡性质有明显改善效果;此外,利用TG、漆酶及过氧化物酶等催化SPI与其他蛋白交联,形成性能互补的新型SPI凝胶现已成为研究热点。
近年来,对SPI采用复合处理手段进行改性逐渐成为一大研究热点,但总体还存在过程复杂、转化率低、产品得率低等问题,故未能充分运用到生产中。今后可从以下几个方面对SPI的凝胶化进行深入研究:1)探讨如何将酶修饰处理手段与其他处理手段协同以平衡不同因素的负面影响,同时将酶修饰手段与新型加工技术(脉冲电场、脉冲光技术)相结合研究其对SPI凝胶品质和功能性的影响。2)研究SPI凝胶结构对营养物质的包埋和输送传递的控制以及如何通过多种技术的结合获得更稳定和高效的凝胶聚集体。3)热量对豆奶颗粒特性与凝胶化行为的影响尤为显著,通过分析热量在豆奶和豆奶凝胶加工中的作用,将有助于设计特定的加热条件以生产新型的SPI凝胶制品。4)SPI与异源蛋白混合形成的凝胶具有独特的结构与性能,但对凝胶体系质构与营养价值的影响还有待探究。5)将其他来源的球状蛋白与SPI进行功能特性的比较,有助于深入了解多种球蛋白并开发新型产品。6)不同加工过程与其他食品填充物料对SPI凝胶结构及功能性质的影响也有待研究。

