生物活性硒肽的研究进展
贾 蕾,向极钎,殷红清,何 慧,侯 焘,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.恩施土家族苗族自治州农业科学院,湖北 恩施 445000)
硒是人体所必需的微量元素之一,有着重要的生理功能[1],也是组成具有抗氧化活性的硒蛋白的必需成分,如谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、硫氧还蛋白还原酶(thioredoxin reductase,TrxR)、脱碘酶(iodothyronine deiodinases,DIOs)等[2]。 近年来,硒的营养价值引起广泛关注,市场上出现了不少富硒产品,例如富硒酵母、富硒玉米、富硒茶等。同时,研究人员也对硒及其衍生物进行了更加深入的研究,主要集中在膳食硒与人体健康的关系、硒蛋白的合成及发挥作用的机制、硒的代谢研究等多个方面,并取得了一定成果[3-6]。
生物活性肽以高亲和力、特异性和促进健康的高效性而著称,随着消费者健康意识的增强,食源性生物活性肽成为功能性食品和营养保健品的重要组成部分[7-8],使得活性多肽类物质的研究成为一个活跃领域。生物活性硒肽来源广泛,不仅可从含硒动植物蛋白及微生物蛋白中获取,也可人工合成,具有极大的开发潜力和应用价值。多年来,对于硒肽的研究多集中于硒肽制备及分离纯化等方面[9-10],对于其生理活性及其发挥作用机制的探讨以及氨基酸结构组成序列的研究较少。
本文主要对硒的生物学功能及其吸收、代谢进行简要的概述,并对近年来生物活性硒肽研究的相关热点问题,如硒肽的制备、生理活性、氨基酸序列等进行综述,以期为硒及生物活性硒肽在食品、药品、医疗等多个方面的开发应用提供理论基础。
1 硒的生物学功能
硒是人体、动物体以及多种微生物体中各种重要生物学功能所必需的元素,以硒代半胱氨酸(selenocysteine,SeC)的形式掺入硒蛋白中发挥生理活性[11]。近年来,微量元素硒对人体生长和代谢的积极作用已被广泛证实,大量研究表明硒是大量硒依赖蛋白质(如GPx,TrxR,DIO等)所必需的元素,这些物质在大多数生物体内均表现出氧化还原酶的功能[12],此外,硒也被证实具有抗氧化[13]、抗炎[14]、抗病毒[15]、提高机体免疫力[16]、调节情绪[17]、预防心脑血管疾病[18]及神经退行性疾病[19](如阿尔茨海默症)等生理功能。
硒的可用资源在世界范围内有限且其分布不均匀,据估计,全世界有一亿到十亿人缺硒[20],缺硒将导致克山病以及心肌疾病等[21]。而硒的过度摄入则会导致硒中毒,其中毒机理尚不完全清楚,主流观点认为硒可以代替某些含硫氨基酸(如Met、Cys)中的硫,抑制组织呼吸酶活性,并可以降低组织中的谷胱甘肽(glutathione,GSH)水平,抑制某些硫氢化酶的活性;也有观点认为高硒水平具有促氧化作用,有助于机体内活性氧的产生[22]。硒中毒的主要症状是呕吐、腹泻、恶心以及呼吸中的大蒜味,甚至是内分泌失调、心脏及肝中毒等[23]。同时,硒摄入超标也被证实是越来越多的流行病学的诱因,如促进肥胖、胰岛素抵抗和2型糖尿病的发生、发展等[24]。
硒的有益或毒性作用不仅是剂量依赖性的,并且与其生物化学形式及生物利用度有关,诸如SeC、硒代蛋氨酸(selenomethionine,SeM)和硒甲基硒代半胱氨酸等有机硒化合物的毒性比无机硒的毒性小,且其生物利用度要优于无机硒化合物,对环境更友好[25-26]。近年来,随着硒营养和生物活性肽研究的深入,发现生物活性硒肽是有机硒的重要来源之一,已有研究表明源自多种食品的生物活性肽通常具备易于吸收、敏感性低、营养价值高、生物利用度高、副作用少的特点[27-28]。因此,补充生物活性硒肽可能是安全有效的补硒方法,关注其来源、分离检测手段以及生物活性等不仅有利于硒营养的深入研究,充分发挥硒的有益生理活性,而且对于提高国民整体健康水平具有重要意义。
2 硒元素的吸收、代谢研究
人体内硒的吸收代谢途径尚未被完全探明。普遍认为,膳食是硒的主要来源,食物中含有的几种硒在被人体摄食后通常会在肠道中被很好地吸收(吸收率在50%~100%之间),但硒的生物利用度与硒来源、人群营养状况、硒化物形式有关,且不同硒化物吸收机理不同,其生物利用度也不同[29-30]。因为硒具有与硫相似的理化性质,故可在某些反应中将硫化物中的硫替换为硒,SeM与蛋氨酸(Met)有相同的吸收途径,即通过中性氨基酸的摄取吸收机制,一般依赖Na+机制穿过小肠壁;硒酸盐则是通过主动吸收穿过小肠壁,亚硒酸盐通过被动吸收穿过小肠壁;SeC和亚硒酸盐则不会被通过主动转运而吸收,并且不受类似硫化物的影响,而是通过简单的扩散吸收[31]。
硒的代谢途径如图1所示,人体通过膳食获取的含硒化合物通过不同的生物化学反应在体内转化、代谢,硒化氢(H2Se)可视作无机硒和有机硒化合物代谢的中心物质。H2Se可以通过膳食硒转化而来,膳食硒则包括无机硒和有机硒。膳食中无机硒主要包括硒酸盐和亚硒酸盐,硒酸盐可以通过ATP酶促活化形成5’-硒磷酸盐腺苷,然后通过GSH进行非酶还原转化为亚硒酸盐[32], 而亚硒酸盐既可在TrxR的直接作用下转化为硒化氢,也可以在GSH及GPx的作用下依次转化为含硒二谷胱甘肽和谷胱甘肽硒化物,进而转化为H2Se[33];膳食中有机硒主要包括SeM和SeC,SeM不仅能够通过胱硫醚γ-裂解酶非特异性地转化为甲基硒醇后再去甲基化生成H2Se,而且能够通过转硫途径生成中间产物SeC,SeC则可被硒代半胱氨酸裂解酶分解产生H2Se[35]。H2Se则向两个方向继续转化,其一是在ATP和硒磷酸合成酶的作用下转化为硒磷酸盐,用于生成硒蛋白[36];其二是转化为硒糖、甲基硒化物、二甲基硒化物、三甲基硒鎓离子等,通过尿液、粪便和呼吸排出体外[37]。
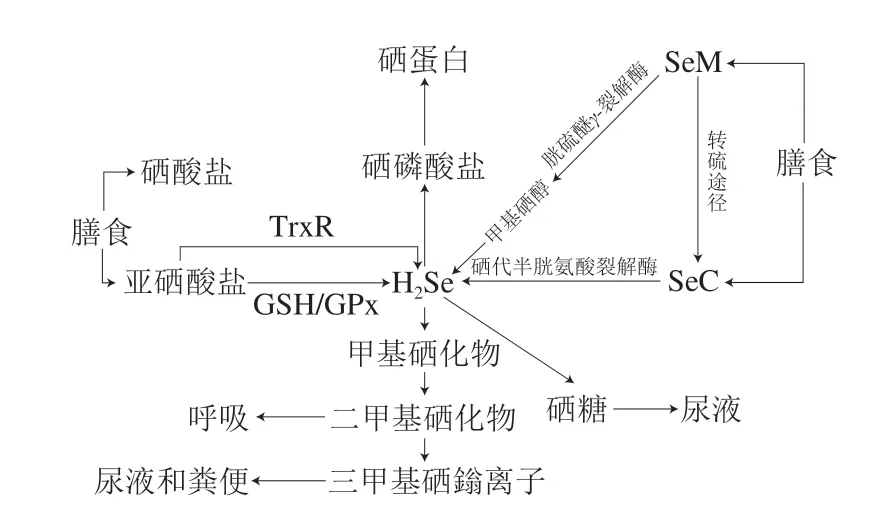
图1 硒的代谢途径[32-37]Fig.1 Metabolic pathways of selenium[32-37]
3 生物活性硒肽
3.1 硒肽的制备
目前,制备天然富硒肽的原材料种类繁多,已从富硒大豆[38]、富硒玉米[39]、富硒酵母[40]中分离并鉴定了含硒肽。同时,为了更好地开发利用硒资源和提高药用植物的价值,研究人员以堇叶碎米荠为原料提取出了含硒肽,并且从碎米荠中分离所得的硒肽含硒量要比其他植物高[41], 这是因为堇叶碎米荠是超富硒植物,其苗叶期的含硒量超过了国际上的超富硒植物的含硒临界标准(1 000 mg/kg), 远高于富硒酵母、富硒大豆、富硒小麦[42]。
酶促水解是从蛋白质中获取肽最为常见的一种策略,天然富硒肽也多通过酶促水解从蛋白质中获得。制备天然富硒肽首先要从合适的材料中提取含硒蛋白质,碱溶酸沉(等电点沉淀法)是当前较为常见的含硒蛋白分离方案,田敏爵等[43]利用碱溶酸沉法探究了富硒猴头菌中含硒蛋白提取的最佳工艺条件,张玉凤[44]在利用碱溶酸沉法获取富硒魔芋蛋白的基础上研究了该含硒蛋白的抗氧化性能,Fang Yong等[45]研究了富硒大米中硒的分布,发现碱溶性的谷蛋白中硒含量最高,并成功利用碱溶酸沉法获取了含硒蛋白质。其次是选择合适的蛋白酶以水解度、硒含量等指标优化含硒蛋白水解工艺,水解酶往往是选择各种市售蛋白酶,包括木瓜蛋白酶、碱性蛋白酶、胰蛋白酶、复合蛋白酶等。例如,为了从富硒茶中分离抗氧化性能良好的硒肽,以清除自由基能力为指标,从多种商业蛋白酶筛选出木瓜蛋白酶用于水解富硒茶蛋白,并通过单因素试验和响应面优化了酶解条件[46]。在某些情况下,可将两种或两种以上蛋白酶结合使用以生产所需的富硒肽,程天德[38]和陈里[10]相继利用枯草芽孢杆菌蛋白酶、木瓜蛋白酶混合水解富硒大豆蛋白、富硒酵母蛋白而分别获得了分子质量小于1 000、13 000 Da且生物性能良好的含硒肽。
随着生物信息学技术、基因工程和蛋白质化学修饰技术的快速发展,为了满足市场的需求、最大程度地发挥 生物活性肽的价值,人工合成硒肽也陆续出现。目前, 文献报道的人工合成硒肽多以天然的GPx和超氧化物歧化酶(superoxidant dismutase,SOD)活性中心结构设计,采用基因工程方法制备的人工模拟酶,兼具了GPx和SOD抗氧化双酶的活力。例如,以天然金属为基础设计的含硒65肽(Se-CuZn-65P)[47]。而Se-CuZn-65P难以进入细胞发挥作用,为了解决这一问题,一种包含了细胞穿透肽的含硒化合物也被成功合成[48],并通过单蛋白生产与大肠杆菌的半胱氨酸辅助营养双表达系统相结合对其进行了表达[49]。
近年来,由于微量金属元素与氨基酸/小肽螯合物有利于提高微量元素生物学效价[50],通过螯合修饰将无机硒转化为有机硒,以提高硒元素利用率和安全性的新方法逐渐在实验室内应用。有以来源于鱼类的分子质量小于3 000 Da的肽[51]、灵芝肽[52]、玉米低聚肽[53]为主体,分别与亚硒酸盐螯合后得到了抗氧化性能良好的硒-肽螯合物,此外,为了探究硒与肽的螯合机制及螯合位点的数量,硒螯合豌豆寡肽被成功合成,并发现硒与豌豆寡肽的酰胺结构螯合引起了蛋白质结构转变和价电子跃迁,两者的螯合位点在N和O附近,Se4+可以提供4d的空轨道,而N和O提供孤对电子占据空轨道,从而形成配位键[54]。
虽然制备天然富硒肽效率低、耗时耗能,在未来的工业生产中需要克服多种困难,但其活性稳定、生物安全性高、选择性好、特异性高[55-56],并且探究天然富硒肽的结构及活性是人工合成硒肽的前提,对天然富硒肽功能性肽段的挖掘及其构效关系的研究能丰富硒肽数据库,为未知硒肽的酶切位点、功能预测提供基础。人工合成硒肽则与天然富硒肽不同,制备速度快、周期短、效率高是它的巨大优势,但仍然存在着合成技术不成熟、生产成本高、缺少系统性的安全评估以及临床实验等不足。同时,硒肽螯合物的螯合率和产物得率均较低,在工业上进行量产并没有显著优势。故在未来几年,研究人员对于硒肽的探究仍会以天然富硒肽为主,而在现有天然富硒肽制备工艺的基础上,利用超声和微波辅助技术提高蛋白的产量,从而提高硒肽的得率是值得考虑的解决富硒肽生产效率低的方法。
3.2 硒肽的生物活性
硒营养和生物活性肽的开发一直以来都是营养学中的热点问题,多种来源硒肽的成功制备也为探究硒肽特有的生物活性、开发新型保健产品提供了条件。目前,对于硒肽的研究一直处于确定其生理功能的初级阶段,而对其生理机制尚未展开探究。而肽的特征结构是影响其活性的主要因素,普遍认为肽的生物活性与肽序列、肽链长度、分子质量、疏水性和氨基酸组成等因素之间有着密切联系[57],开发数据模型来统计分析化合物的活性和预测高活性结构已逐步开始应用,例如定量构效关系模型等[58-59]。
3.2.1 抗氧化作用
有氧生物的呼吸作用而形成的活性氧、自由基可以与体内的其他基团和物质迅速反应,致使细胞和组织损伤使机体出现衰老、细胞凋亡和某些严重疾病(如癌症、阿尔茨海默症、动脉粥样硬化等)[60-61],而抗氧化剂可以中断氧化和供氢的自由基链,防止氧化链反应,从而形成稳定的不引发或致使脂质或蛋白质氧化的自由基。因此,抗氧化剂的存在在维持机体平衡、改善人体健康等方面发挥着重要作用。硒肽的生物效应是多方面的,其中最重要的、研究最多的是抗氧化活性,尤其是衍生自天然食物蛋白的许多抗氧化硒肽受到了相当大的关注。
目前,尚未开发出专门用于测定肽或肽混合物抗氧化能力的测定方法或将其标准化,基于化学反应的体内外测定方法则被广泛应用于表征部分纯化的肽和/或单个肽的抗氧化效果。其中,氧自由基吸收能力测定法、总自由基捕获抗氧化剂参数法以及其他自由基(如羟自由基(·OH)、超氧阴离子自由基(O2-·)、2,2’-联氮-双(3-乙基-苯并噻唑-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基)清除法等体外抗氧化方法应用最为普遍[62-63]。Li Canpeng等[64]对硒化卵清蛋白经胰蛋白酶消化后分离鉴定出的含硒肽进行ABTS阳离子自由基清除活性、羟自由基清除活性和还原力测定,得出该含硒肽具有较高的抗氧化能力的结果,并指出硒化卵清蛋白的抗氧化活性增强是硒和蛋白质的熔融小球构象所致;Liu Kunlun等[65]利用碱性蛋白酶有效水解从富硒糙米分离出的含硒蛋白质而获得抗氧化硒肽,该硒肽对于DPPH自由基、·OH和O2-·具有强清除活性,表明该物质可作为天然食品来源的抗氧化剂。为了进一步开发利用恩施堇叶碎米荠,对该碎米荠不同提取物(碎米荠碱提取物、碎米荠富硒蛋白、碎米荠富硒多肽)的抗氧化活性进行了考察,并且将其不同的提取物与等量富硒酵母、无机硒和非富硒多肽与无机硒混合物进行了抗氧化能力的比较,结果发现等量硒的情况下,碎米荠富硒多肽的抗氧化能力优于其他含硒物质,且有机硒清除自由基的能力优于无机硒[41]。
硒肽的体内抗氧化机制(基于活性氧的产生和代谢途径)如图2所示。一方面,硒肽是特殊的含硒有机物,不同于只具备抗氧化活性的肽,硒元素有很强的亲核特性、电子转移能力,可与活性氧反应并因此被氧化生成Se—O化合物,而Se—O化合物可迅速被还原,即硒既能迅速被氧化又被快速还原,具备抗氧化的能力[66]。另外,肽本身具有抗氧化活性,但是关于肽发挥体内抗氧化作用的分子机制没有系统研究,有研究发现,低分子质量肽 可上调SOD和GPx基因表达,增强两种酶活性[67],也有观点认为肽在体内直接充当活性氧清除剂,但有待论证。另一方面,如图2所示,O2-由专门的酶(如黄嘌呤氧化酶、烟酰胺腺嘌呤二核苷酸磷酸(reduced form of nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶)催化产生或者作为细胞代谢(如线粒体电子传输链)的副产物,经SOD作用后转化为H2O2,其中,硒依赖性GPx则可以降低活性氧代谢产物H2O2以及氢过氧化物的水平,从而保护细胞免受氧化损伤[68],因此硒肽可作为硒酶如GPx等的硒元素供体,通过提高酶的抗氧化活性间接发挥其抗氧化活性。
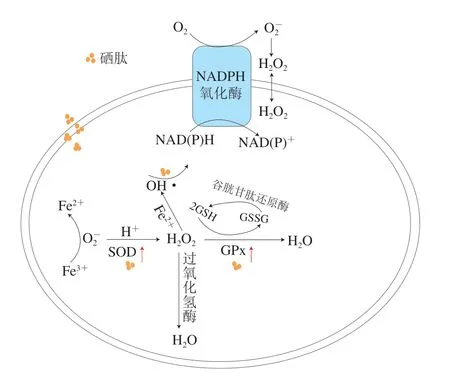
图2 硒肽基于活性氧的产生和代谢途径的体内抗氧化机制Fig.2 Antioxidant activity and underlying mechanism of seleniumcontaining peptides
此外,有研究显示,分子质量范围在1 000~5 000 Da的低分子质量级肽的抗氧化活性更好,肽序列中含有疏水性氨基酸(如Val、Leu)、芳香族氨基酸(如Trp、Tyr)、亲核的含硫氨基酸(Cys、Met)等均有利于提高肽的抗氧化活性[63,69]。而SeC是氧化还原性酶GPx的活性中心,在硒肽、硒蛋白等多种有机硒化合物的抗氧化活性方面发挥着重要作用[70-71],这就表明硒肽的抗氧化作用与其氨基酸组成密切相关,它能在体内代谢后成为GPx的合成材料,提高生物体的抗氧化能力。
3.2.2 降血压作用
高血压的控制可以通过多种相互关联的代谢途径进行,迄今为止研究最多的是肾素-血管紧张素系统对血管紧张素转化酶(angiotensin-converting enzyme,ACE)的抑制作用。肾素-血管紧张素系统中,血管紧张素原被肾素生成的血管紧张素I裂解,进而被ACE水解生成血管紧张素II,血管紧张素II通过与1型受体和2型受体结合来介导其作用,导致血管的收缩。此外, ACE可将血管舒张剂缓激肽水解成无活性的片段,导致血管扩张不足[72-73]。
控制血压的大多数策略都涉及通过食物衍生的肽抑制ACE活性,从而减少血管紧张素II生成和缓激肽失活,使血压降低[74]。近年来,陆续从富硒螺旋藻[75-76]、富硒大豆[77]、富硒茶[78]中也分离鉴定出具有抑制ACE活性的含硒肽,发现多种酶水解富硒螺旋藻蛋白获得的硒肽对ACE活性的抑制率高达89.47%,富硒大豆低聚肽的降血压效果是硒与肽协同作用的效果,富硒茶来源的硒肽抑制ACE的能力优于等量不含硒的同源ACE抑制肽。
此前,有报道指出肽结构中的Pro顺反式异构体、疏水性氨基酸的位置、肽序列的分子质量均会影响降压肽的ACE抑制效果,其中Pro的反式结构、C-末端残基为疏水性氨基酸和带正电荷的氨基酸、分子质量低(二肽和三肽)的肽均能提高降压肽的ACE抑制活性[79]。而目前对降压硒肽的结构研究较少,无法得知硒肽是否有如上特征,而且有研究指出长期暴露于高硒环境中会增加高血压的发病率[80],因此,对硒肽构效关系及量效关系的研讨是今后研究ACE抑制硒肽的重点。
3.2.3 肝脏保护作用
硒及硒蛋白与肝脏健康有着密切关系。调查研究显示,肝癌的发病率在世界范围内存在地理差异,其原因可能是不同地区人群血清/血液中硒的浓度不同[19],而且流行病学证据也表明了高硒摄入能够有效降低患肝癌的风险[81]。
近年来,陆续有学者针对硒肽的保肝作用展开了研究。高脂饮食诱导的肝损伤模型中,喂食大鼠富硒大豆肽(selenium-biofortified soybean peptides,SSPs)10 周,能提高其肝脏及血清中SOD、GPx的活性,降低丙二醛的含量,从而改善高脂小鼠的抗氧化能力,抑制脂质过氧化反应,防止脂肪肝的形成[82];半刀豆球蛋白A诱导的小鼠肝损伤模型中,硒生物强化玉米肽显著提高了肝脏中SOD和GPx的活性,降低了丙二醛含量,抑制了肿瘤坏死因子-γ、肿瘤坏死因子-α等炎症因子的分泌,从而防止肝炎的发生[83];四氯化碳(CCl4)诱导的大鼠肝纤维化模型中,SSPs抑制了肝脏中α平滑肌肌动蛋白合成,促进基质金属蛋白酶9的mRNA表达,抑制肝纤维化,此外,在该肝损伤模型中也观察到SSPs增加GSH和GPx活性的 现象[84]。合理推测,硒肽的抗氧化作用在其发挥保肝活性时发挥着重要作用,具体机制需要进一步的研究。此后,为了明确SSPs抗肝脏纤维化的作用机理,相关研究人员展开了体内外实验对其进行探究。研究表明,SSPs可能通过抑制转化生长因子-β/白细胞抑制因子7途径和加速HSC-T6细胞凋亡来防止肝细胞凋亡以及肝脏纤维化[85]。
3.2.4 免疫调节活性
免疫调节剂是可以通过改变免疫系统的任何部分(包括免疫系统的先天和适应性功能类别)来增强、减少 或改变免疫应答的任何物质,研究发现饮食成分调节免疫功能是一种有效且高效的策略,尤其是来源于食物蛋白的免疫调节肽为饮食干预免疫系统提供了更多可能[86]。
近年来,陆续发现不同来源的硒肽在免疫调节方面同样具有显著效果,揭示了硒肽有成为调节免疫功能食品的巨大潜力。分子质量低于1 000 Da的富硒大米肽经鉴定可通过降低氧化应激水平和增加细胞中抗氧化剂SOD、GSH的活性来保护细胞,保护PC12和RAW264.7细胞免受神经毒性[87];富硒大米蛋白水解物经细胞实验、巨噬细胞增殖和吞噬作用实验得出具有抗氧化和免疫调节活性后,在富硒大米蛋白水解肽中筛选出的免疫调节肽中,发现了两种先前未见报道的含硒肽序列SeMDPGQQ、TSeMMM,并指出富硒大米蛋白水解肽免疫调节活性与含硒肽结构中的SeMet序列密切相关[88-89];人工合成硒肽也被证实能有效提高脂多糖诱导的小鼠腹腔巨噬细胞的相对活力,增强细胞的吞噬能力,降低一氧化氮(NO)和H2O2的分泌水平[90]。
有研究指出具有免疫调节作用的食源性衍生肽的肽链较短(2~10 个残基),在N—或C—末端的精氨酸是一些免疫调节肽的共同结构,而且疏水氨基酸(如Gly、Val、Leu、Pro等)最常存在于具有免疫调节作用的 肽中[91]。硒肽生物活性的研究中,在一定程度上关注了结构对于其免疫调节活性的影响,但仍处于对其结构的鉴定阶段,并没有开展系统性的分析和深层次的挖掘。
3.2.5 其他
除了上述生理活性之外,对硒肽的生理功能的研究还有其他发现。大豆硒肽经证实具有排铅保健作用,铅中毒的小鼠模型在饮用质量浓度200~800 mg/L的大豆硒肽水溶液后,其体内多种器官中的铅含量均有所下降[92], 而硒和铅之间的亲和力很强,硒肽的排铅效果可能是由于硒/铅化合物的形成,该化合物可被动物体自然清除。富硒玉米肽被证实有醒酒活性,通过体内外实验发现其醒酒活性良好且其醒酒能力优于等剂量普通玉米肽[93]。适量的人工合成硒肽经动物实验发现具有在动物体内稳定降低血糖的作用,且其降血糖效果优于注射胰岛素,并维持了肝组织的氧化还原平衡[94]。
4 硒肽与不含硒同源肽的生物活性的比较研究
硫(S)与硒[95]、尿嘧啶的含硫和含硒类似物[96]、硒酶和硫酶[97]等的抗氧化活性的比较研究均已报道,其中,Se和S这两种硫属元素在氧化还原化学中表现出较大的差异,Reich等[66]认为造成这种差异的原因主要是Se无法形成所有类型的π键,与S相比,Se的亲核特性更强,与活性氧反应时速度快,这也意味着Se-O键缺少π键特征,Se-O化合物与S-O化合物相比更易被还原。Mishra等[98]在对比SeM和Met的单电子氧化自由基的反应中发现羟自由基与SeM和Met的初始反应相似,但SeM单体自由基阳离子的较高稳定性和较低的氧化还原电势也会改变反应路径,并且形成的产物更易于发生氧化还原反应,故SeM具有比Met更好的抗氧化活性,并通过循环伏安法研究以及与叠氮基的反应对其进行了验证。然而,目前对于硒肽和不含硒的同源肽之间生物活性的比较研究较少,主要集中于抗氧化活性方面。
有研究学者以富硒糙米为原料制备含硒肽SeMet-Pro-Ser(Se-MPS),通过测量自由基和活性氧的清除能力、铬的还原能力、肌红蛋白的保护和脂质过氧化的抑制能力来评判其与不含硒的同源肽Met-Pro-Ser(MPS)之间的抗氧化能力的差异及相关机理,结果显示Se-MPS相较于MPS的氢原子转移能力更强,MPS中的Ser和Se-MPS中的Se对两种肽的抗氧化能力起到关键作用,且硒和肽对抗氧化活性具有协同作用[99]。王驰等[100]在利用老龄小鼠模型和HePG2细胞模型探究富硒玉米肽(seleniumcorn peptides,SeCPs)抗氧化活性的同时,也对比了SeCPs与其不含硒的同源肽(普通玉米肽)、甲基硒代半胱氨酸(MeSeCys)及SeCPs和MeSeCys混合物之间的抗氧化能力,结果显示SeCPs的整体抗氧化能力优于普通玉米肽,在硒含量相同的情况下,SeCPs的抗氧化效果 优于富硒氨基酸,说明硒在玉米肽发挥抗氧化活性中起重要作用。
然而,除了Se-MPS和MPS抗氧化能力的对比实验外,其余实验仅关注硒肽与不含硒同源肽抗氧化能力的强弱,对其背后机理的挖掘均不够深入,故针对不同来源的硒肽与不含硒的同源肽生理活性之间的差异以及相关机制仍有非常大的探究空间,这对于进一步研究硒肽的生理功能具有重要意义。
5 硒肽的结构
生物活性肽的生理功能随着氨基酸组成的不同以及氨基酸排列顺序的不同而发生改变,而且硒肽序列一旦确定,就可以人工合成硒肽,并验证其生理活性,在必要时可进行其他表征。因此,确定肽序列对于研究硒肽的构效关系有着重要作用。
质谱法具有高精度、高灵敏度、高性价比和高通量的特点,是肽组学的基础工具,可用于肽检测并对其进行定量、定性分析,电喷雾电离-质谱法、基质辅助激光解吸电离-飞行时间质谱法、表面增强激光解吸电离-飞行时间质谱法等多种技术现都已广泛应用于肽组学中肽段的大规模分析。但由于肽所处的环境较为复杂,在质谱分析前,对样品分离以提高鉴定数量必不可少,而高效液相色谱法常用于质谱分析前的分离步骤,为了提高 分离效率,离子对反相色谱法、强阳离子交换色谱法等预分离技术也会根据研究对象的不同而应用[101-102]。通常使用软件或者软件和手动计算组合的方法从串连质谱中分析肽序列,一些研究人员还搜索数据库以确定他们鉴定出的肽序列是否新颖,例如BIOPEP数据库和Metlin代谢组数据库[103]。
近年来,随着越来越多不同来源、不同活性硒肽的成功制备,对其肽序列的鉴定也愈发受到关注,有研究先后从来源玉米的富硒肽中鉴定得到了多个含硒肽段[84,104], 也有研究对来源于富硒糙米[65]、富硒大米[89]的天然富硒肽,硒螯合肽[54]和其他多种人工合成硒肽[105-107]的序列进行了鉴定。不同来源硒肽的生理活性、肽序列及肽序列检测鉴定方法如表1所示。

表1 不同来源硒肽的生理活性、肽序列及肽序列检测鉴定方法Table 1 Physiological activities and amino acid sequences of seleniumcontaining peptides from different sources and methods use for their identification
蛋白质组学中,常利用基质辅助激光解吸电离-飞行时间质谱法和电喷雾电离质谱法鉴定含硒肽和蛋白质,从分子水平上了解硒形态[108]。目前,多项研究表明色谱分离与电感耦合质谱对于硒种类的鉴定具有灵敏性,不同种类的色谱仪与电感耦合等离子质谱仪结合用作检测器,例如体积排阻色谱-等离子体质谱、高效液相色谱-等离子体质谱法已被用于评估不同含硒有机物中硒的 种类[109]。其中高效液相色谱-等离子体质谱法的应用广泛最为广泛,归功于其检测限低、灵敏度较高,但鉴定肽序列的准确性取决于色谱峰与样品的匹配度,在富含基质的样品中会出现多原子干扰和基质效应,在应用时仍然存在一定的局限性。如表1所示,不同生物活性硒肽的肽序列不同,鉴定方法也不再仅仅局限于高效液相色谱-等离子体质谱法,更多高效的分离检测方法也逐渐得到应用。
此外,由于目前已知的具有活性的硒肽结构较少,无法针对其进行构效关系研究或者建立相关数据库,因此,今后的研究要开发更加快速、精准的鉴定方法,并开展更多的构效关系研究,通过研究硒肽的结构特征更好地理解和预测其生理活性,并建立数据模型用于设计、优化具有高生物活性的分子结构。
6 结 语
近年来,随着对硒营养价值研究的深入和肽组学的发展,硒肽的合成、吸收代谢机制、生理活性等方面的探究逐渐展开。但是,由于自然界中硒的可用资源有限且分布极不均衡,硒超蓄积植物中硒的含量也较低,故要从现有含硒动植物蛋白中获取天然富硒肽具有局限性。天然富硒肽的制备周期长、得率低,给硒肽生理活性、作用机理、吸收的代谢机制等研究带来了困难。此外,人工合成硒肽也存在着成本高、得率低、缺少相应的安全性评估等问题,其生产、研究和应用在一定程度上受到了阻碍。
硒肽相较于单一的硒化合物和普通的生物活性肽有着更高的生物活性,是生物活性肽领域中极具研究价值的新颖肽。未来需要利用蛋白组学、肽组学、基因工程等多种手段解决基础性的制备困难问题,并以当前生产工艺较为成熟的硒肽为基础,对其生理功能、机制以及对结构复杂性进行更深入的探究。另外,需要更进一步的研究来预测硒肽在人体中的稳定性、生物利用度和反应性,以促使其成为新一代膳食补充剂,并为一些疾病提供新的治疗思路。

