沉默HMGB1通过下调NF-κB信号来改善滋养细胞增殖侵袭及胰岛素抵抗和炎症反应
高艳宇, 林 娟, 王 琼, 闫咨儒
(电子科技大学医学院附属妇女儿童医院·成都市妇女儿童中心医院产科, 四川 成都 611731)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种典型的代谢性疾病,临床表现主要以妊娠期高血糖为首发症状[1]。GDM作为一种极为常见妊娠期并发症,严重影响母婴健康,研究证实GDM不仅显著增加先兆子痫,巨大儿、难产和胎儿窘迫的发生率,其同样与不良妊娠结局如流产、宫内死胎和致死性畸形等密切相关[2,3]。而胰岛素抵抗(insulin resistance,IR)是目前多数学者公认的造成GDM的重要病理机制之一。IR是指一定数量的胰岛素产生的生物效应远远低于预期的一种异常状态,在妊娠期间,多种激素分泌如孕激素、催乳素、胎盘生长素等均能抵抗胰岛素作用[4]。同时,IR还能激活炎症反应,从而干扰正常妊娠的进展[5]。高迁移率组蛋白1(HMGB1)是一种非组蛋白相关蛋白,其主要从受损的细胞中释放,并作为一种慢性炎症信号参与调节炎症、免疫刺激和趋化等过程[6]。在细胞中,HMGB1主要于与其受体如晚期糖基化终产物(RAGE)、Toll样受体2(TLR-2)和4(TLR-4)进行结合,进而激活核因子(NF-κB)信号通路发挥其生物学效应[7]。近期有研究表明,GDM患者血清HMGB1水平较正常孕妇显著升高,且与患者的IR具有相关性,但未进一步明确其具体作用机制[8]。因此,本研究通过体外建立滋养细胞IR模型并使用shRNA沉默HMGB1在滋养细胞中表达,探究其相关作用及信号通路,以期进一步阐明GDM发生发展的相关机制。
1 材料与方法
1.1细胞系和主要试剂:人绒毛膜滋养细胞系HTR-8/SVneo(HTR-8)购自武汉普若赛生命科技有限公司;RMPI-1640培养基、胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶(美国Hyclone公司);胰岛素,RIPA细胞裂解液,CCK-8试剂盒、HRP标记的山羊抗兔或大鼠IgG、DAPI染液(北京索莱宝生物科技有限公司);shRNA-HMGB1和阴性对照序列(NC)由南京金斯瑞生物科技公司合成;BCA蛋白定量试剂盒(上海碧云天生物技术有限公司);葡萄糖含量测定试剂盒(南京建成生物技术研究所);Trasnwell小室(8 μm)、PVDF膜(美国Millipore公司);TNF-α、IL-1β、IL-6的ELISA试剂盒(武汉博士德生物工程有限公司);兔抗HMGB1、GLUT1、GLUT4抗体(美国Pierce Biotech 公司);兔抗p-IRβ、IRβ、p-p65、p65(美国Cell Signaling公司);大鼠抗IRS-1、IRS-2(美国CST公司);大鼠抗p-PI3K、PI3K、p-IκBα、IκBα、β-actin(武汉三鹰生物技术有限公司);Opti-MEM(美国Gibico公司);Lipofectamine 3000转染试剂、基质胶(美国Invitrogen公司);Cy3标记的山羊抗兔IgG(美国Affinity公司);其他试剂均为国产分析纯。
1.2细胞培养、转染和分组:使用含10%FBS的RMPI-1640培养液进行培养HTR-8细胞,并置于37℃、5%CO2的培养箱中。待细胞生长融合至80%,0.25%的胰酶常规消化细胞,调整细胞密度至1×105个/mL,接种至12孔板中,培养24h后,将培养基更换为Opti-MEM,按Lipofectamine 3000使用说明书方法将shRNA-HMGB1或shRNA-NC转染入HTR-8细胞,进行沉默HMGB1表达,6h后将更换培养基至10%FBS的RMPI-1640培养液,转染24h后进行后续相关实验;按实验目的将上述转染后的HTR-8细胞进行分组,Control组为正常培养的HTR-8细胞;胰岛素抵抗组(insulin resistance,IR组)为参考相关文献[13]使用10~7moL/L胰岛素处理48 h后建立的IR的HTR-8细胞;IR+shRNA-HMGB1组为经10~7moL/L胰岛素处理48 h的转染shRNA-HMGB1的HTR-8细胞;IR+shRNA-NC组为经10~7moL/L胰岛素处理48h的转染shRNA-NC的HTR-8细胞。
1.3葡萄糖消耗实验检测滋养细胞葡萄糖消耗量:取上述各组细胞上清液,1200rpm/min离心5min后,弃沉淀,使用葡萄糖含量测定试剂盒进行检测,于分光光度计505nm处读取相应吸光值。
1.4免疫印迹(Western blot)检测滋养细胞蛋白表达:取上述各组滋养细胞,使用RIPA裂解液和蛋白酶抑制剂PMSF于冰上进行提取细胞中的总蛋白,BCA试剂盒进行检测蛋白浓度并于沸水中进行加热变性。取约40 μg变性后的总蛋白加载至SDS-PAGE凝胶上进行电泳分离,湿转法将分离后的蛋白条带转移至PVDF膜上,5%的脱脂奶粉室温下进行抗体封闭1h后加入一抗,即HMGB1(1∶500)、GLUT1(1∶1000)、GLUT4(1∶1000)、p-IRβ(1∶800)、IRβ(1∶800)、p-p65(1∶1000)、p65(1∶1000)、IRS-1(1∶800)、IRS-2(1∶800);p-PI3K(1∶1000)、PI3K(1∶1000)、p-IκBα(1∶800)、IκBα(1∶800)、β-actin(1∶20000)于4℃孵育过夜,次日TBST充分洗涤后,加入HRP标记的二抗(1∶10000)于室温下孵育2h后,加入ECL发光液使用图像分析软件进行扫描,Image J软件测定条带灰度值分析计算,以β-actin为内参。上述实验单独进行3次。
1.5免疫荧光分析滋养细胞HMGB1表达:取上述各组滋养细胞,弃除培养液后,使用4%多聚甲醛固定15min,0.1%Triton X-100透化30min,随后山羊血清进行封闭15min,加入HMGB1抗体(1∶200)孵育过夜,PBS洗涤后加入Cy3标记的山羊抗兔IgG(1∶200),孵育1h,最后滴加5μg/mL DAPI染液进行染核10min,防荧光猝灭剂封片后,使用荧光显微镜进行观察分析。上述实验单独进行3次
1.6CCK-8检测滋养细胞的增殖活力:取生长状态良好的滋养细胞,调整细胞浓度,按5×103个/孔接种至96孔板中,按方法1.2进行转染shRNA-HMGB1或shRNA-NC进行沉默细胞中HMGB1表达。转染12h后按上述方法进行处理并分组,建立IR细胞模型。细胞培养箱中孵育48h后,每孔加入10μL的CCK-8试剂,继续孵育2h后,用酶标仪于450nm处检测每孔吸光度值,每组设置5个复孔。
1.7Transwell侵袭实验检测滋养细胞侵袭能力:使用RMPI-1640将基质胶按1∶8比例进行稀释,取60μL稀释后的基质胶进行包被Transwell上室底部,取上述各组滋养细胞,调整细胞比例至1×105个/孔,Transwell上室加入600μL含15%的RMPI-1640培养液。置于上述条件的培养箱中培养24h后,轻轻擦拭上室未穿出的细胞,4%多聚甲醛室温下固定15min后,0.1%的结晶紫染色10min,显微镜下随机选取5个视野进行拍照并计数。实验单独进行三次。
1.8ELISA实验检测炎症因子TNF-α、IL-1β、IL-6表达:取上述各组细胞上清液,14000rpm/min离心10min,取上清并按照ELISA试剂盒使用说明书方法检测各组滋养细胞对TNF-α、IL-1β、IL-6的表达水平。上述实验单独进行3次。

2 结 果
2.1滋养细胞IR模型的鉴定和HMGB1的表达水平检测:葡萄糖消耗实验的检测结果显示,经10~7moL/L胰岛素处理48h后,IR组葡萄糖的消耗量较Control组明显降低(P<0.05);Western blot实验结果表明,与Control组相比,IR组HMGB1蛋白表达水平明显增加(P<0.05),见图1、表1。
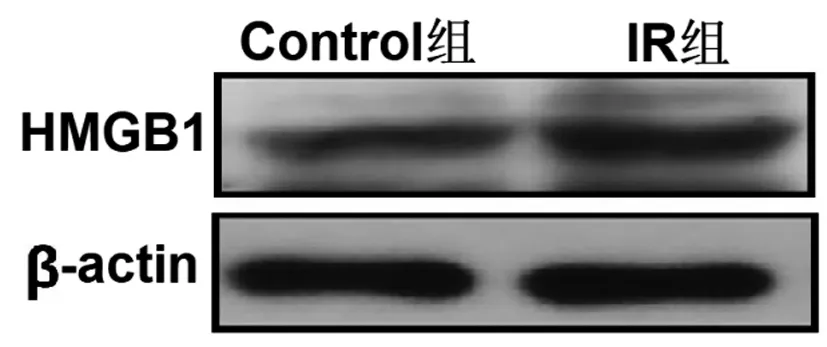
图1 免疫印迹法检测IR模型中HMGB1蛋白的表达

表1 IR模型中葡萄糖消耗与HMGB1蛋白表达水平
2.2转染shRNA后对IR条件下滋养细胞HMGB1的蛋白表达水平影响:Western blot实验结果显示,与Control组相比,IR组、IR+shRNA-NC组细胞中HMGB1蛋白表达水平均显著增加(P<0.05),而IR+shRNA-HMGB1组细胞中无明显HMGB1蛋白表达(P<0.05或P<0.01),其中IR组与IR+shRNA-NC细胞中表达无明显差异(P>0.05);细胞免疫荧光结果同样显示,HMGB1在IR组、IR+shRNA-NC组滋养细胞中的荧光强度显著高于Control组(P<0.05),前两组表达无明显差异(P>0.05),而在IR+shRNA-HMGB1组细胞中无明显表达(P<0.05或P<0.01),见图2、表2。
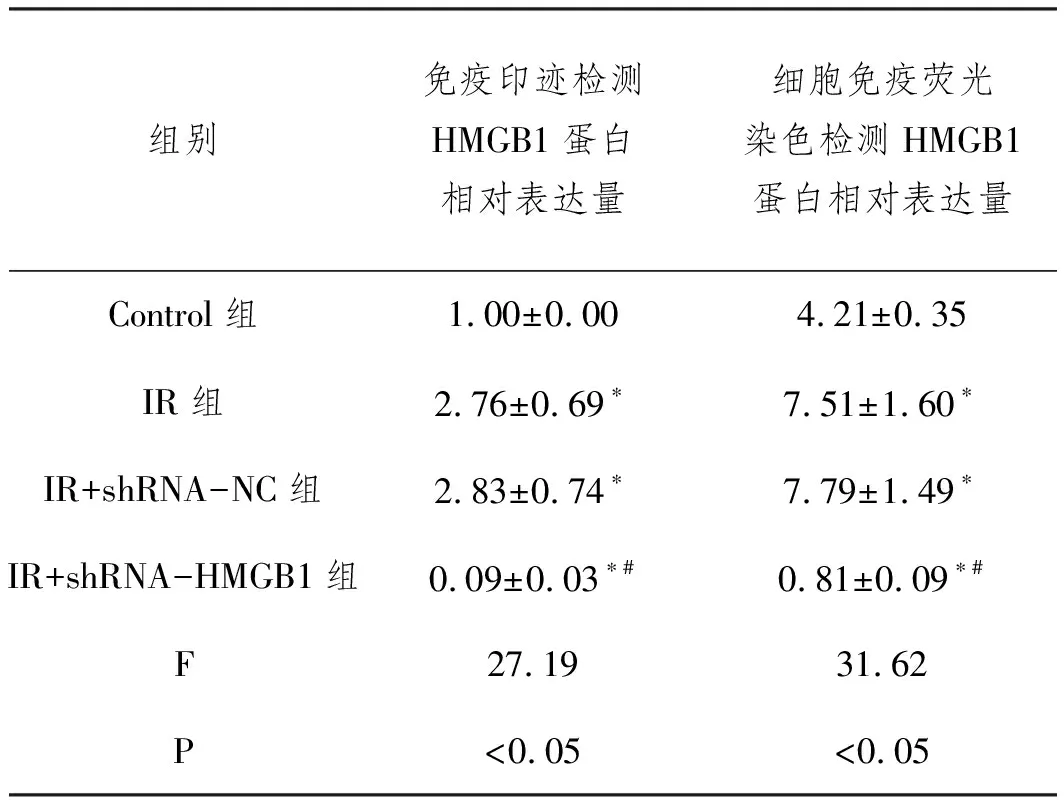
表2 各组滋养细胞中HMGB1表达的检测结果分析

图2 免疫印迹(A)和细胞免疫荧光染色(B)检测各组滋养细胞中HMGB1的蛋白表达
2.3沉默HMGB1表达对IR条件下滋养细胞增殖的影响:CCK-8实验结果显示,与Control组(0.77±0.06)相比,IR组(0.35±0.11)、IR+shRNA-NC组(0.31±0.08)和IR+shRNA-HMGB1组(0.51±0.10)的细胞侵袭能力明显降低(P<0.05),而与IR组或IR+shRNA-NC组相比,IR+shRNA-HMGB1组细胞的增殖能力显著增加(P<0.05),前两组细胞无明显差异(P>0.05),见表3。
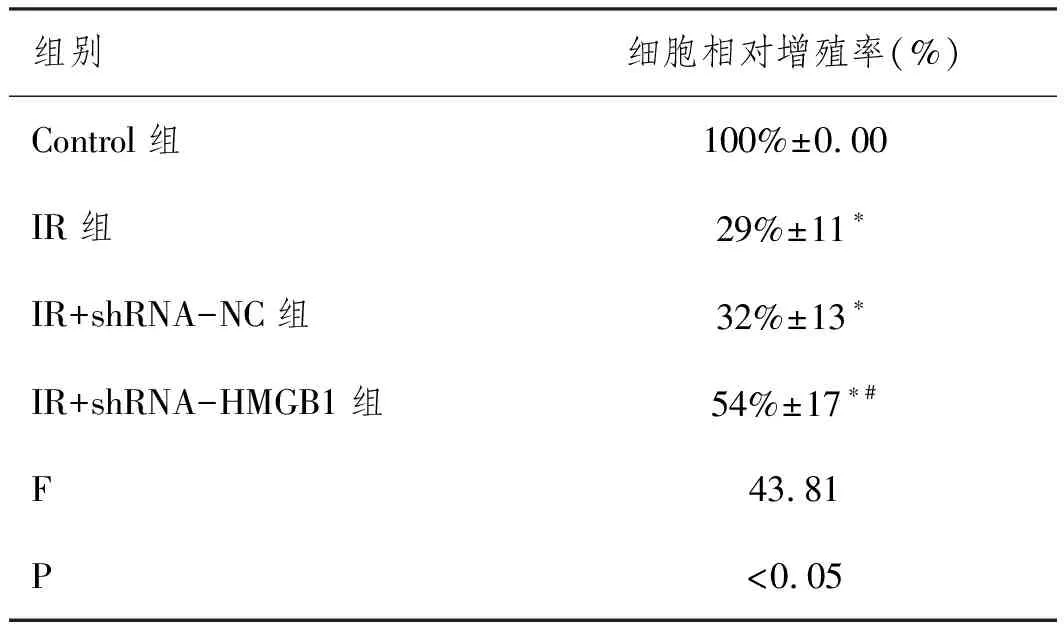
表3 CCK-8检测各组滋养细胞的增殖能力
2.4沉默HMGB1表达对IR条件下滋养细胞侵袭的影响:Transwell实验结果显示,与Control组(93±18)相比,IR组(17±6)、IR+shRNA-NC组(19±4)和IR+shRNA-HMGB1组(52±11)的侵袭细胞数量明显降低(P<0.05),而与IR组或IR+shRNA-NC组相比,IR+shRNA-HMGB1组细胞的侵袭数量显著增加(P<0.05),前两组细胞无明显差异(P>0.05),图3,表4。
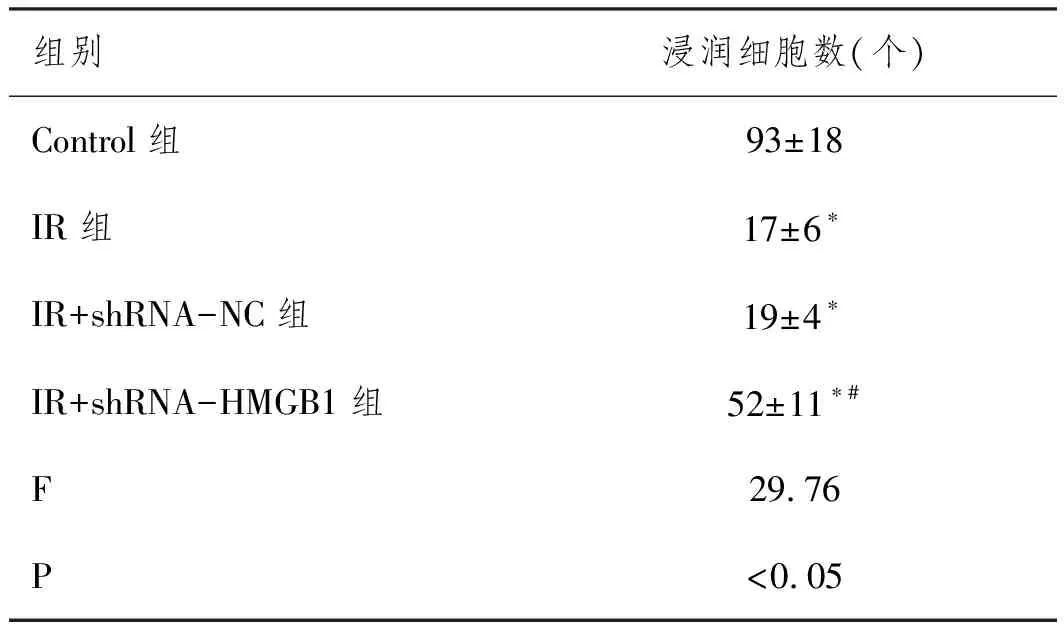
表4 Transwell检测各组滋养细胞的侵袭能力
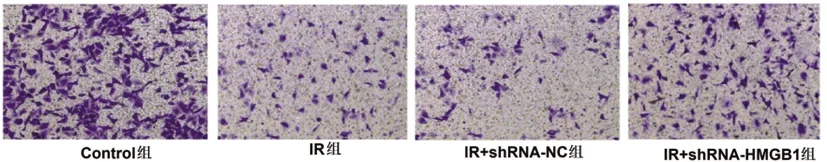
图3 Transwell检测各组滋养细胞侵袭能力
2.5沉默HMGB1表达对IR条件下滋养细胞炎症因子表达的影响:ELISA检测结果显示,与Control组滋养细胞相比,IR组、IR+shRNA-NC组和IR+shRNA-HMGB1组细胞上清液中炎症因子TNF-α、IL-1β、IL-6的表达水平均显著增加(P<0.05),而IR+shRNA-HMGB1组细胞较IR组或IR+shRNA-NC组细胞对上述炎症因子的分泌水平明显降低(P<0.05),后两组细胞之间无明显差异(P>0.05),见表5。

表5 各组滋养细胞炎症因子TNF-α IL-1β IL-6的表达水平
2.6沉默HMGB1表达对IR条件下滋养细胞胰岛素敏感性的影响:葡萄糖消耗实验结果显示,与Control组相比,IR组、IR+shRNA-NC组和IR+shRNA-HMGB1组葡萄糖消耗量明显减少(P<0.05);而IR+shRNA-HMGB1组细胞较IR组或IR+shRNA-NC组细胞的葡萄糖消耗量显著增加(P<0.05),后两组细胞之间无明显差异(P>0.05)。Western blot实验检测胰岛素敏感性相关蛋白的结果显示,与Control组滋养细胞相比,IR组、IR+shRNA-NC组和IR+shRNA-HMGB1组细胞中胰岛素相关蛋白IRβ(p-IRβ/IRβ)和PI3K(p-PI3K/PI3K)的磷酸化水平及ISR-1、ISR-2和葡萄糖转运蛋白GLUT4均明显增加(P<0.05),葡萄糖转运蛋白GLUT1表达水平均显著降低(P<0.05);而IR+shRNA-HMGB1组细胞较IR组或IR+shRNA-NC组细胞相比,IRβ与PI3K的磷酸化以及ISR-1、ISR-2和GLUT4蛋白表达水平均明显降低(P<0.05),GLUT1蛋白显著增加(P<0.05),IR组或IR+shRNA-NC组细胞的上述蛋白的表达无明显变化(P>0.05),见表6、图4、表7。

表6 各组滋养细胞中葡糖糖的消耗量
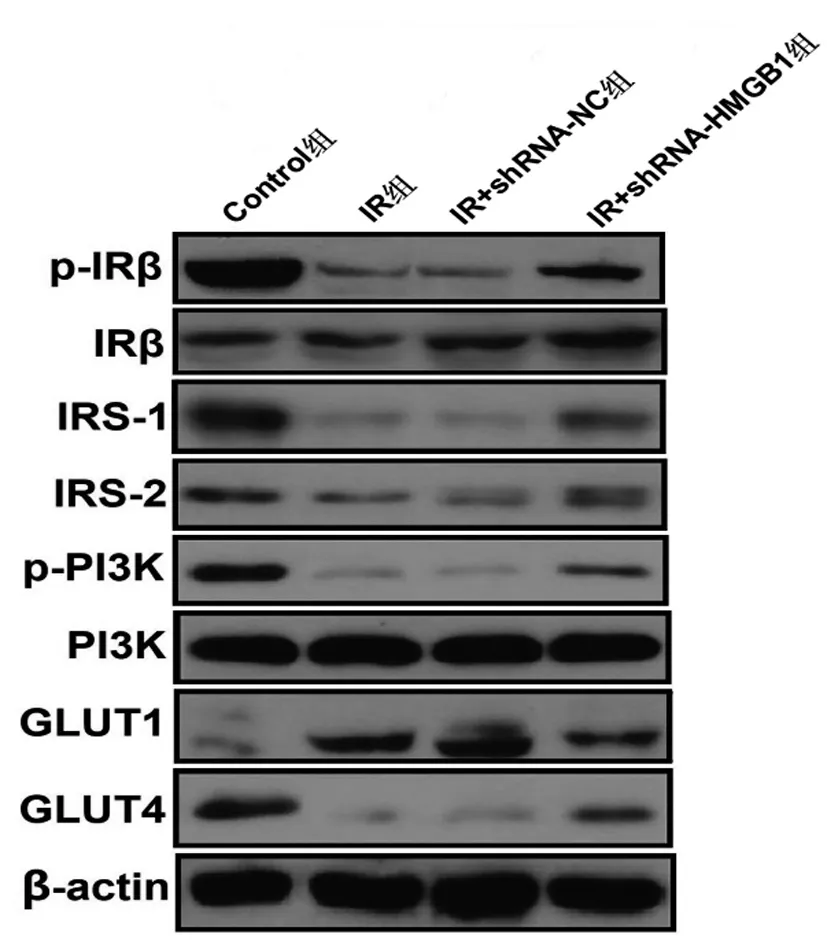
图4 免疫印迹检测各组滋养细胞中胰岛素敏感性相关蛋白的表达
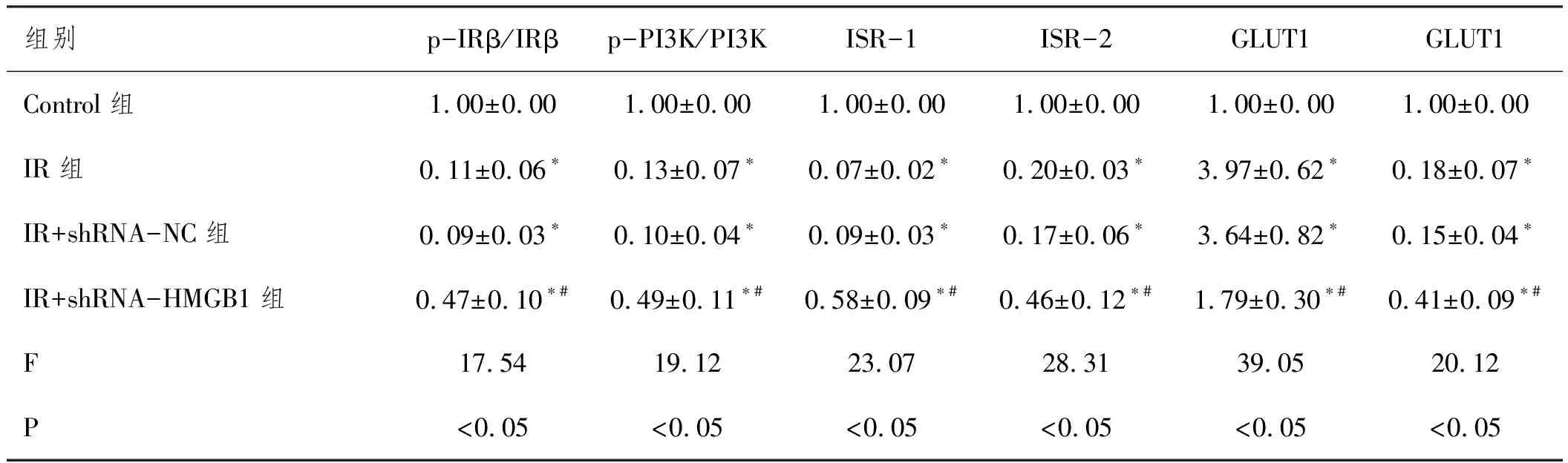
表7 各组滋养细胞中胰岛素敏感性相关蛋白的相对表达量
2.7沉默HMGB1表达对IR条件下滋养细胞中NF-κB信号通路的影响:Western blot结果显示,与Control组滋养细胞相比,IR组、IR+shRNA-NC组和IR+shRNA-HMGB1组细胞IκBα和p65蛋白磷酸化水平均明显增加(P<0.01或P<0.05),而IR+shRNA-HMGB1组细胞较IR组或IR+shRNA-NC组细胞相比,上述蛋白的磷酸化水平均显著降低(P<0.05),后两组细胞之间无明显差异(P>0.05),见图5、表8。
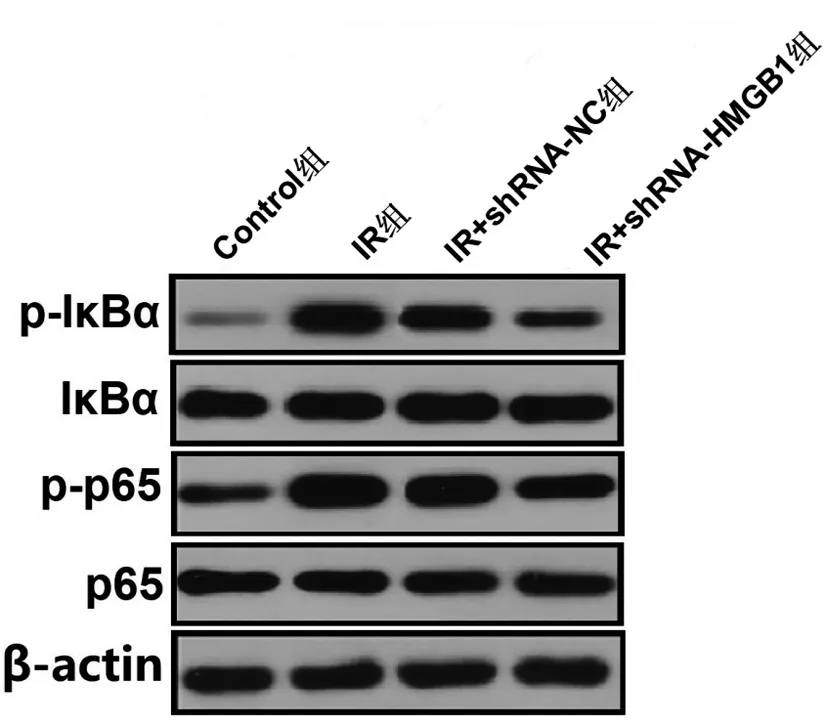
图5 免疫印迹检测沉默HMGB1抑制IR条件下滋养细胞中的NF-κB信号通路表达的影响

表8 各组滋养细胞中NF-κB信号通路的相对表达量
3 讨 论
近年来随着生活方式的改变与生育政策的逐步开放,GDM的发病率也急剧升高,流行病学统计显示:在过去十年间,我国GDM的患病率占妊娠妇女总数的9.3%~18.9%,造成沉重的家庭及社会负担[3]。大量数据表明IR是诱发GDM发生发展的病理生理基础。此外,多数学者认为GDM不仅是一种代谢相关疾病,其同样还是一种持续存在的低度慢性炎症状态,而这与细胞因子和相关介质的异常表达具有密切关系。
HMGB1是一种广泛存在于真核细胞内的,分子量为30kb的高度保守的转录调节因子[6]。正常情况下,HMGB1在细胞中介导转录因子与DNA相互作用,而在不良刺激发生时,其被分泌至细胞外,与相应受体(RAGE、TLR-2、TLR-4)进行结合后,诱导炎症反应,促进血管生成等相关生物学效应[6,7]。近期研究证实HMGB1分泌的增加是促使IR发生的一个重要原因,其可能的机制为HMGB1与RAGE受体相互作用诱导NF-κB的转录,从而与炎症因子TNF-a共同导致胰岛素受体底物1和2(ISR-1、ISR-2)的失活,最终产生IR的发生[9]。此外,HMGB1同样还能够刺激胰岛素的分泌[10]。而在GDM中,国内外均有学者报道HMGB1在GDM患者体内的表达水平显著高于正常妊娠女性,且与IR具有正相关关系,进一步分析表明HMGB1能够作为GDM的一个独立预测因子[7,8,11]。而在其他妊娠相关疾病中,有研究证实HMGB1子痫前期(PE)的外周血及胎盘组织中均异常高表达,且能够通过抑制滋养细胞的增殖,侵袭并诱导细胞发生凋亡以促进PE的发生进展[12]。上述研究提示HMGB1不仅能够诱导IR的发生,同时还能影响滋养细胞的生物学行为。胎盘作为胰岛素信号的重要效应器官,其发生的IR已被认为是GDM重要特征之一,这使得胎盘成为GDM发病机制的重点[1,2],而滋养细胞又在胎盘的形成及功能维持中发挥重要作用[2]。因此本研究通过参考相关文献[9]体外建立滋养细胞HTR-8的IR模型,以探究HMGB1在GDM发病机制中的作用。实验结果表明在IR条件下滋养细胞中的HMGB1蛋白表达显著升高,通过shRNA沉默IR条件下滋养细胞中HMGB1,验证其转染效果后,细胞增殖及侵袭实验结果显示沉默HMGB1能明显促进IR条件下滋养细胞的增殖和侵袭能力。同时,沉默HMGB1表达促进了IR条件下受损的胰岛素敏感性,抑制了滋养细胞对促炎因子TNF-α、IL-1β、IL-6的分泌。
葡萄糖摄取被认为是机体细胞存活的主要能量来源,而有效的胰岛素分泌和功能对血糖稳态的维持起着至关重要的作用。既往研究显示,在IR细胞模型中葡萄糖消耗能力严重受损,这进一步说明葡萄糖稳态缺陷与胰岛素抵抗之间的相关性[13]。胰岛素受体β(IRβ)是胰岛素的膜受体,其磷酸化的状态广泛被认为是胰岛素结合反应的标志。而胰岛素受体底物-1和2(ISR-1、ISR-2)是一种衔接蛋白,其主要作用是通过与磷脂酰肌醇激酶(PI3K)的结合将络氨酸磷酸化信号转化为脂类激酶信号,并激活下游相关蛋白的表达。其中,ISR-1与ISR-2蛋白的表达在胰岛素效应激活过程中具有重要地位[9]。此外,细胞质中葡萄糖转运体的表达水平也控制着葡萄糖的摄取,在本实验中我们也同样对葡萄糖转运体1(GLUT1)和4(GLUT4)进行了检测。HMGB1作为一种慢性炎症介质,其在细胞中主要通过NF-κB信号通路发挥促炎作用,而有研究证实介导炎症反应的NF-κB信号通路的激活可导致糖代谢的受损和全身IR,这进一步提示胰岛素作用与炎症反应的相关性[14]。本实验结果表明,沉默HMGB1的表达能够明显促进IR条件下滋养细胞中IRβ和PI3K的磷酸化水平及ISR-1、ISR-2和GLUT4的蛋白表达水平,而抑制GLUT1表达。这提示沉默HMGB1改善了IR条件下滋养细胞的胰岛素敏感性。最后NF-κB信号通路的检测结果显示,沉默HMGB1的表达能通过抑制IR条件下滋养细胞中IκBα和p65蛋白的磷酸化水平下调该信号通路的激活水平。
综上,本实验发现HMGB1表达水平在IR条件下的滋养细胞中明显升高,沉默其表达能够通过NF-κB信号通路促进滋养细胞的增殖与侵袭能力,改善细胞对胰岛素的敏感性,并降低其对促炎因子的分泌。本课题组的研究结果进一步阐明了HMGB1在IR的发生和发展中作用,为改善GDM的治疗提供了新的策略。

