特利加压素联合去甲肾上腺素对脓毒性休克患者肝功能及预后的影响
张立亚 王勇强 冯晓彤 金秋
天津市第一中心医院重症医学科300192
0 引言
脓毒症是指因感染引起宿主反应失调进而导致危及生命的器官功能障碍[1]。脓毒性休克是在脓毒症基础上出现持续性低血压,经充分容量复苏后仍需血管活性药物来维持平均动脉压(mean arterial pressure,MAP)≥65 mmHg(1 mmHg=0.133 kPa)以及血乳酸水平>2 mmol/L(>18 mg/dl)[1]。肝脏是脓毒症早期易损器官之一,脓毒症的任何阶段均可能发生急性肝损伤[2]。因此,早期诊断脓毒性休克并发肝损伤,及时给予有效的预防及治疗对脓毒性休克患者尤为重要。特利加压素(terlipressin,TP)是一种垂体后叶素类似物,为人工合成的高选择性V1受体激动剂。作为一种长效血管加压制剂,TP可较好地维持脓毒性休克患者的MAP,并清除机体炎症因子[3],改善血流动力学。本研究旨在探讨TP对脓毒性休克患者肝功能及预后的影响,为临床应用提供依据。
1 资料与方法
1.1 临床资料
选择2018年6月至2019年12月天津市第一中心医院重症医学科(intensive care unit,ICU)收治的资料完整的96例脓毒性休克患者进行前瞻性研究。入选标准:①符合脓毒性休克诊断标准[1]。②肝功能损伤定义为总胆红素(total bilirubin,TBIL)>34.1μmol/L和/或转氨酶>2倍正常值[4]。③有创机械通气。④48 h内去甲肾上腺素(norepinephrine,NE)用量最高为1.0μg/(kg·min)。排除标准:住院时间<24 h;年龄>85岁或<18岁;恶性肿瘤;急性冠状动脉综合征、心源性休克;妊娠期妇女;慢性肝脏疾病;器官移植等。本研究符合2013年修订的《赫尔辛基宣言》的要求,所有患者均签署知情同意书。
按随机数字表将研究对象分为对照组和试验组,各48例。对照组男性29例,女性19例;年龄范围43~82岁,年龄(64.6±11.5)岁,急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)评分为(25.73±2.43)分;肺部感染24例,腹腔感染10例,泌尿系感染7例,其他7例。试验组男性27例,女性21例;年龄范围40~81岁,年龄(66.1±10.7)岁,APACHEⅡ评分为(24.73±2.25)分;肺部感染20例,腹腔感染13例,泌尿系感染8例,其他7例。两组患者年龄、性别、APACHEⅡ评分等一般资料差异均无统计学意义(均P>0.05)。
1.2 方法
两组患者入科后均给予常规治疗,包括选择敏感抗生素、液体复苏、控制血糖、维持电解质平衡等。若充分液体复苏后MAP仍<65 mmHg,则加用血管活性药物维持MAP≥65 mmHg。对照组患者经中心静脉持续泵入NE(国药准字H12020621,规格1 ml∶2 mg,天津金耀药业有限公司),起始剂量为0.1μg/(kg·mi n),48 h内用量最高为1.0μg/(kg·mi n);试验组患者予以中心静脉持续泵入NE的同时联合泵入TP(国药准字H20093804,规格1 mg,深圳翰宇药业股份有限公司),以20μg/h起,最大输注速率为160μg/h,TP持续输注的最大剂量为4 mg/d。根据血压情况调整两组患者的血管活性药物用量,可停用或增加剂量。
记录两组患者治疗前和治疗24、48 h后肝功能指标[谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、血清TBIL]及心率、MAP、血乳酸水平变化;对两组患者的机械通气时间及住院时间(ICU住院时间、住院总时间)进行比较,并统计28 d病死率及相关严重不良反应。
1.3 统计学方法
采用SPSS21.0统计学软件处理数据,符合正态分布的计量资料以均值±标准差(Mean±SD)表示,治疗前后比较采用配对t检验,其余行成组t检验;计数资料以例数(百分比)表示,两组间比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 治疗前后肝功能指标变化
由表1可知,治疗前对照组与试验组患者的各项肝功能指标(ALT、AST及TBIL)水平比较,差异均无统计学意义(均P>0.05);经积极抗休克治疗24、48 h后对照组与试验组患者的ALT、AST及TBIL水平均较治疗前明显下降,差异均具有统计学意义(均P<0.01);治疗24、48 h后试验组患者的ALT、AST及TBIL水平较相同时间点的对照组下降更明显,差异均具有统计学意义(均P<0.05)。
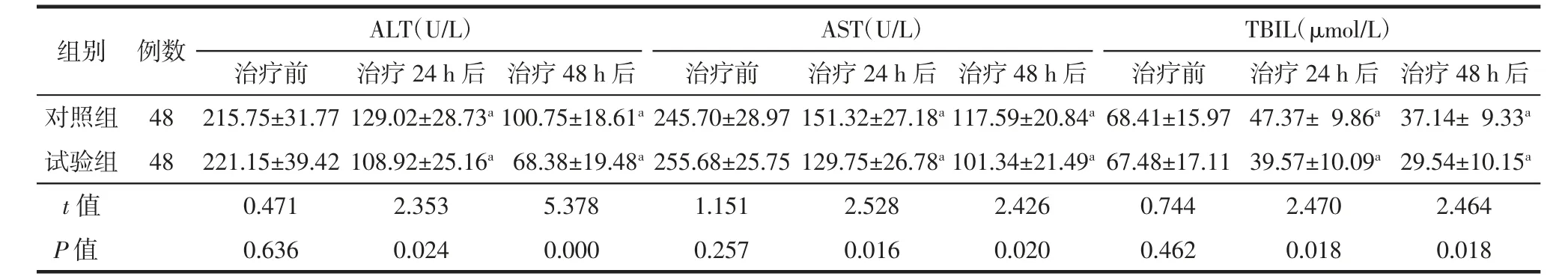
表1 两组脓毒性休克患者治疗前与治疗不同时间后肝功能指标变化(Mean±SD)
2.2 治疗前后心率、MAP、血乳酸水平变化
由表2可知,治疗前对照组与试验组患者的心率、MAP及血乳酸水平比较,差异均无统计学意义(均P>0.05);经积极抗休克治疗24、48 h后,对照组与试验组患者的心率和血乳酸水平均较治疗前明显下降(均P<0.01),MAP均较治疗前有所升高(均P<0.01);与对照组相比,试验组患者治疗48 h后的心率及治疗24、48 h后的血乳酸水平下降更明显(均P<0.05),试验组患者治疗48 h后的MAP升高更明显(P<0.05),但两组患者治疗24 h后的心率、MAP比较差异均无统计学意义(均P>0.05)。
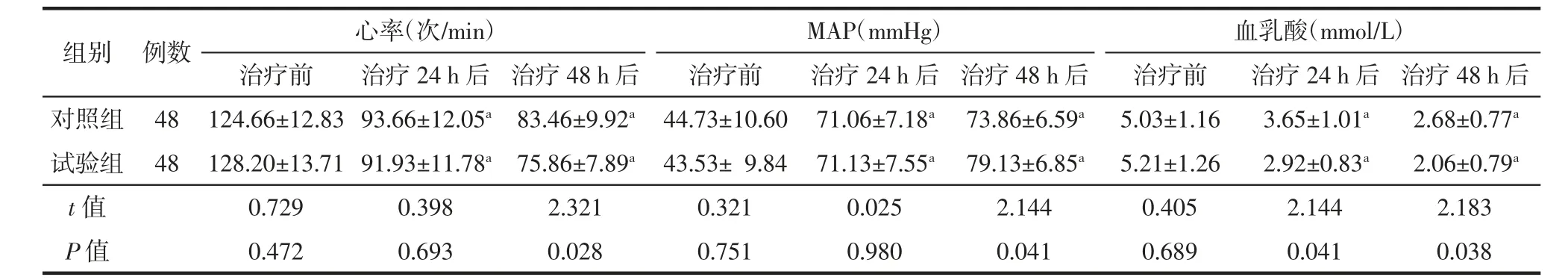
表2 两组脓毒性休克患者治疗前与治疗不同时间后心率、MAP及血乳酸水平变化(Mean±SD)
2.3 机械通气时间及住院时间比较
由表3可知,两组患者的机械通气时间、ICU住院时间、总住院时间差异均无统计学意义(均P>0.05)。
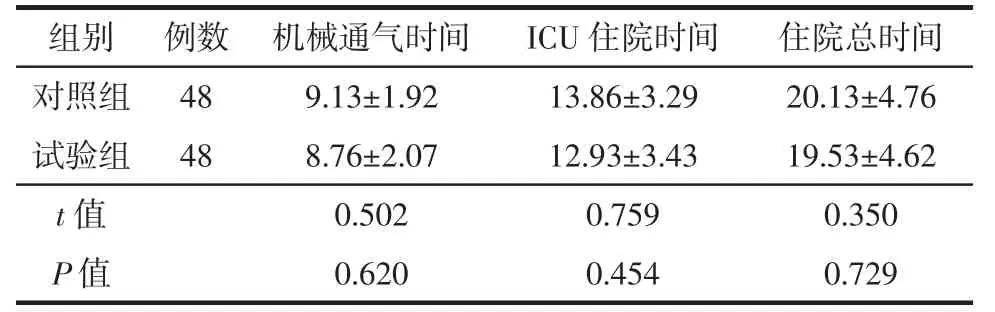
表3 两组脓毒性休克患者机械通气时间、ICU住院时间及住院总时间比较(Mean±SD,d)
2.4 28 d病死率与不良反应比较
治疗后28 d对照组患者死亡14例,试验组患者死亡12例,两组患者28 d病死率差异无统计学意义(29.16%比25.00%,χ2=0.211,P=0.646)。此外,两组患者均未出现指端缺血坏死、心肌梗死等严重不良反应。
3 讨论与结论
脓毒性休克属于分布性休克,是ICU患者主要死亡原因之一,其病理机制为大量具有舒张血管作用的炎症因子释放导致全身血管舒张,血流重新分布,动脉血压降低及器官组织灌注不足。而血管活性药物是维持血流动力学、保证重要器官组织灌注的重要手段。NE是治疗脓毒性休克的一线药物[1],主要作用于外周阻力血管的α-肾上腺素能受体,可增加心脏后负荷,从而降低患者的容量反应性。但NE可能诱发危及生命的心律失常(如室性心动过速、心室颤动)[5],大剂量使用NE还可增加病死率[6-7]。因此,寻找替代的血管活性药物已成为脓毒性休克治疗和研究的重点。
近年来研究结果发现,血管加压素血浆浓度对于维持血管张力非常重要,血管加压素及其类似物通过V1、V2受体发挥作用。其治疗脓毒性休克的主要机制为作用于血管平滑肌V1受体,通过与磷脂酶C结合及增加细胞内钙离子浓度介导收缩内脏血管平滑肌,减少内脏血流量,增加有效循环血量和心输出量,从而升高血压[8]。脓毒性休克早期内源性血管加压素分泌增加,血管加压素血浆浓度升高,利于血压稳定;而脓毒性休克晚期内源性血管加压素分泌减少,其血浆浓度降低,血管加压素不足甚至耗竭[9];同时体内高水平的NE会抑制血管加压素的合成,导致患者体内血管加压素合成障碍,出现血管加压素相对或绝对不足,血管张力降低[10]。文献报道,当出现对儿茶酚胺反应降低或抵抗时,低剂量地输入外源性血管加压素能恢复血管收缩张力[11]。TP化学名为三甘氨酰赖氨酸加压素,是加压素的合成类似物,其本身无活性,在体内经氨基肽酶作用脱去其N末端的3个甘氨酰残基,释放具有生物活性的赖氨酸加压素,从而实现血管收缩作用[12]。由于酶解作用的不同特点,与精氨酸加压素相比,TP作用时间更长,半衰期为6 h,而精氨酸加压素的半衰期为24 min,且精氨酸加压素对血管V1受体和V2受体的亲和力相同,而TP对V1受体的亲和力高于V2受体(亲和力比为2.2∶1),因此TP升压作用更有效、更持久[13-15]。研究结果发现,小剂量TP联合NE对脓毒性休克患者具有协同作用[16]。本研究结果显示,两组脓毒性休克患者经积极治疗(24、48 h)后,心率、MAP均较治疗前有所改善,且试验组治疗48 h后的心率、MAP改善更明显,提示NE联合TP能更好地降低心率,提高MAP,从而稳定血流动力学。
乳酸是组织灌注受限或氧化代谢受损的标志物,研究结果发现血乳酸水平可能有助于临床医师评估患者预后[17]。乳酸产生增加的机制为低灌注导致无氧代谢,在糖酵解增加的同时,儿茶酚胺刺激Na-K泵,降低了丙酮酸脱氢酶活性;另外,乳酸清除率降低,其主要原因为肝脏灌注不足或肝功能障碍,可能与乳酸产生增加同时存在[18]。不论何种机制,乳酸升高程度与疾病严重程度及病死率密切相关,严重脓毒症或脓毒性休克患者合并乳酸≥4 mmol/L及低血压时病死率高达44.5%[19]。本研究结果显示,脓毒性休克患者的血乳酸水平明显升高,经积极治疗后对照组与试验组的血乳酸水平均降低,但试验组治疗24、48 h后血乳酸水平下降更为明显,提示联合TP持续泵入在改善内脏器官灌注方面更有优势,这与罗俊华等[20]的研究结果一致。
肝脏是脓毒症早期易受损的器官之一。脓毒症患者早期出现肝损伤,是病情进入多器官功能障碍综合征的重要标志,是预测死亡的一项重要预警指标[21]。脓毒性休克引起肝损伤的机制主要为脓毒性休克引起肝微循环障碍,肝脏缺血缺氧,肝窦内皮细胞功能紊乱,中性粒细胞浸润,从而导致肝细胞缺血和坏死[22]。血清AST、ALT及TBIL水平是反映肝损伤的间接指标。本研究结果显示,经积极治疗后对照组与试验组患者的AST、ALT、TBIL水平均明显下降,且试验组治疗24、48 h后的上述指标均较对照组改善更为明显,表明TP联合NE治疗脓毒性休克在一定程度上可保护肝功能。
综上所述,对于脓毒性休克患者,与单用NE相比,联合小剂量TP有利于降低心率、提高MAP、改善组织灌注,从而对脏器功能起到一定的保护作用;但在缩短机械通气时间、ICU住院时间、住院总时间及降低28 d病死率方面未显示出优势,且两组患者均未发生严重不良反应,这可能与样本量少有关,有待大型临床研究进一步证实。
利益冲突所有作者均声明不存在利益冲突

