齐墩果酸通过SIRT1减轻蛛网膜下腔出血后早期脑损伤的作用研究
韩雨薇 王晨辰 李晓明
北部战区总医院神经外科,沈阳110016
0 引言
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种危及生命的脑血管疾病,患者预后极差。早期脑损伤被认为是SAH预后不良的主要原因,诸多研究结果表明炎症在该过程中起着至关重要的作用[1]。
高迁移率族蛋白1(high-mobility group box 1,HMGB1)是一种经典的损伤相关分子,在弯曲DNA、稳定核小体形成和调控基因转录方面起着关键作用[2]。在病理状态下,HMGB1可由坏死细胞被动释放,也可由免疫细胞或非免疫实质细胞主动分泌。文献报道HMGB1水平显著上调,并与SAH不良预后和病死率相关[3],且SAH后引发炎症进而导致早期脑损伤的发生发展。
沉默调节蛋白1(sirtuin 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖的脱乙酰化酶,也是SIRT家族中研究最多的脱乙酰化酶之一。在脓毒症条件下,SIRT1可通过抑制HMGB1乙酰化进而抑制HMGB1的细胞外释放。已有研究结果证实可通过HMGB1中赖氨酸的脱乙酰化来调节炎症反应[4-5],HMGB1可能是SIRT1的一个新的去乙酰化靶点。
笔者所在课题组前期研究结果表明五环三萜类化合物齐墩果酸(oleanolic acid,OA)对SAH后的早期脑损伤具有保护作用,但作用机制尚未完全清楚。因此本研究建立了大鼠SAH模型,进一步探讨OA对SAH后早期脑损伤的保护机制。
1 材料与方法
1.1 主要材料与仪器
OA(纯度98%,天津士兰科技有限公司),兔抗小鼠HMGB1单抗、兔抗小鼠乙酰化HMGB1单抗(美国Cell Signaling Technology公司),山羊抗兔SIRT1单抗(美国Abcam公司),兔抗小鼠β-肌动蛋白单抗(美国Santa Cruz公司),二喹啉甲酸蛋白定量试剂盒、蛋白酶磷酸酶抑制剂、RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶配制试剂盒、5×上样缓冲液、TUNEL细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),Trizol试剂、HMGB1引物(美国Invitgen公司),Promega反转录试剂盒(美国Promega公司),二甲亚砜、Sirtinol(SIRT1抑制剂)(美国Sigma公司)。健康清洁级雄性Sprague-Dawley大鼠176只,体质量范围200~250 g,购自北部战区总医院实验动物中心,许可证号SCX K(辽)2020-0001。饲养条件为温度18~23℃,相对湿度60%~70%,光照节律为12 h光照/12 h黑暗,自由进食饮水。本研究严格遵守美国国立卫生研究院1996年编订的National Institutes of Health Guide for the Care and Use of Laboratory Animals。
Sunrise酶标仪(奥地利Tecan公司),TY-80R脱色摇床(金坛市医疗仪器厂),Mini Protean 3 Cell全湿法电转膜仪、ChemiDoc MP化学发光凝胶成像系统、CFX96Touch荧光定量PCR仪(美国Bio-Rad公司),Axiovert 40荧光显微镜(德国Zeiss公司),Z-323K冷冻离心机(美国Sigma公司)。
1.2 方法
1.2.1 SAH大鼠模型的建立
大鼠经腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,暴露左侧颈动脉及其分支。将钝化的4-0单丝尼龙缝线从颈外动脉刺入颈内动脉并停止,直至出现阻力。然后穿刺大脑前动脉和大脑中动脉分叉处造成SAH。缝合后将大鼠置于37℃加热垫上。
1.2.2 动物分组及给药
采用完全随机法将大鼠分为假手术组(Sham组)(n=48)、SAH组(n=48)、OA组(n=48)和Sirtinol组(n=32)。SAH组、OA组和Sirtinol组大鼠均按1.2.1节方法建立SAH模型,Sham组大鼠不实施穿刺。采用二甲亚砜溶解OA,注射前以氯化钠注射液进行稀释(二甲基亚砜终体积分数为10%)[6]。造模后1 h,OA组大鼠腹腔注射OA(20 mg/kg),Sirtinol组大鼠侧脑室注射Sirtinol(2 mmol/L,30μL/kg)[5],Sham组和SAH组大鼠均注射等体积的氯化钠注射液。
1.2.3 SAH评分和Garcia评分
SAH后24 h采用SAH分级标准评估SAH的严重程度[7]。基底池分为6部分,每部分根据出血量从0~3进行评分,标准如下:3分,血块覆盖所有动脉;2分,中等血流量,可见动脉;1分,极少量SAH;0分,无SAH。同时,根据改良的Garcia评分标准评估SAH后24 h大鼠的神经功能,包括对自主运动、运动协调、身体活动和躯体感觉的评估。分别对触觉反应、肢体对称性、身体本体感觉、攀登、自发活动和前肢伸展这6项测试进行评分,并计算总分,总分范围为3~18分。由一名独立的观察员进行上述所有评分。
1.2.4 脑组织含水量检测
SAH后24 h,每组随机选取8只大鼠实施安乐死,取左右半球脑组织,立即称质量(湿重),然后放入105℃烤箱中烘干72 h,再称量脑组织质量(干重)。按照下式计算脑组织含水量[8]
脑组织含水量(%)=(湿重-干重)/湿重×100%
1.2.5 伊文思蓝染色
SAH后24 h,每组随机选取8只大鼠实施麻醉,左股静脉注射伊文思蓝染料(20 g/L,5 mL/kg);循环1 h后用0.01 mol/L磷酸盐缓冲液灌流;取大鼠左右半球脑组织,称质量后置于甲酰胺溶液中,60℃恒温孵育24 h;收集浸出液,采用酶标仪测定浸出液于620 nm处的吸光度值[9]。
1.2.6 蛋白质印迹法
SAH后24 h,每组随机选取8只大鼠,取大鼠脑组织于冰上加入RIPA裂解液提取蛋白,4℃、12000×g离心10 min,取上清,采用二喹啉甲酸蛋白定量试剂盒检测蛋白浓度;每组取60μg蛋白,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;转膜后加入质量浓度为50 g/L的牛血清白蛋白,室温封闭1 h;分别加入山羊抗兔SIRT1单抗、兔抗小鼠HMGB1单抗、兔抗小鼠乙酰化HMGB1单抗和兔抗小鼠β-肌动蛋白单抗,4℃孵育过夜;加入对应的二抗,室温孵育1 h;经化学发光、显影、定影后对X射线胶片进行扫描,并用Image J软件进行定量分析。
1.2.7 实时荧光定量PCR
SAH后24 h,每组随机选取8只大鼠取脑组织。按照Trizol试剂说明书提取大鼠脑组织总RNA。用Promega反转录试剂盒将RNA反转录成cDNA,再以SYBR Green法进行实时荧光定量PCR。HMGB1正向引物为5′-TCCTTCGGCCTTCTTCTTGT-3′,反向引物为5′-CGGCCTTCTTTTCATAGGGC-3′。实时荧光定量PCR条件为:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40个循环。
1.2.8 免疫荧光染色
SAH后24 h,每组随机选取8只大鼠,先以氯化钠注射液灌注,再以质量浓度为40 g/L的多聚甲醛溶液灌注固定脑组织。取脑组织浸泡于40 g/L的多聚甲醛溶液中过夜,依次进行脱水、透明、浸蜡、包埋、切片(厚度为4 mm)。在切片上滴加兔抗小鼠HMGB1单抗,4℃孵育过夜,磷酸盐缓冲液洗涤3次;滴加异硫氰酸荧光素标记的山羊抗小鼠Ig G(H+L)抗体,室温孵育1 h,磷酸盐缓冲液洗涤3次;滴加4′,6-二脒基-2-苯基吲哚复染细胞核,置于荧光显微镜下进行观察。
1.2.9 TUNEL染色
SAH后24 h,每组取8只大鼠,按1.2.8节方法制作脑组织切片。采用TUNEL细胞凋亡检测试剂盒检测脑组织切片中的凋亡细胞,具体方法参照试剂盒说明书,染色后置于荧光显微镜下进行观察。
1.3 统计学方法
采用SPSS19.0统计学软件处理数据,符合正态分布的计量资料以均值±标准差(Mean±SD)表示,对所有数据进行单因素方差分析,然后通过Tukey检验进行多重比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 OA对神经功能障碍和血脑屏障的影响
如图1A所示,SAH组SAH评分明显高于Sham组(P<0.001),OA给药后SAH评分明显降低(P<0.001),出血情况减轻;与OA组相比,Sirtinol组SAH评分升高(P<0.01),出血情况加重。另外,OA能明显提高Garcia评分(P<0.01),改善神经功能;而Sirtinol组较OA组Garcia评分明显降低(P<0.001),神经功能障碍加重(图1B)。笔者进一步检测了大鼠脑组织含水量和伊文思蓝渗出率,结果显示与SAH组相比,OA给药能明显降低脑组织含水量和伊文思蓝渗出率(均P<0.01);与OA组相比,Sirtinol能增加脑组织含水量和伊文思蓝渗出率(均P<0.01)(图1C、1D),提示OA具有改善SAH后脑血管屏障的作用,而抑制SIRT1则可加重血管屏障损伤。

图1 SAH后24 h OA对大鼠SAH评分、Garcia评分、脑组织含水量和依文思蓝渗出的影响
2.2 OA对HMGB1表达与分布的影响
HMGB1的核质转移和释放介导炎症反应的发生发展,因此笔者进一步检测了大鼠脑组织中HMGB1的表达与分布。蛋白质印迹和实时荧光定量PCR结果显示,SAH后HMGB1蛋白和mRNA水平均明显升高(P<0.001,P<0.01),而OA能明显抑制HMGB1蛋白和mRNA水平(P<0.01,P<0.05)(图2)。免疫荧光染色结果发现Sham组中HMGB1蛋白主要表达于细胞核中;与Sham组相比,SAH术后HMGB1蛋白由细胞核转移至细胞质,而OA给药后可抑制HMGB1蛋白的核质转移(图3)。上述结果提示,OA能降低HMGB1的表达并抑制其核质转移,从而减少HMGB1向细胞外释放。
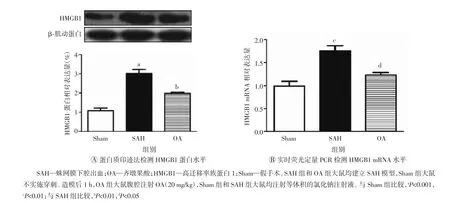
图2 SAH后24 h OA对大鼠脑组织中HMGB1蛋白和mRNA水平的影响
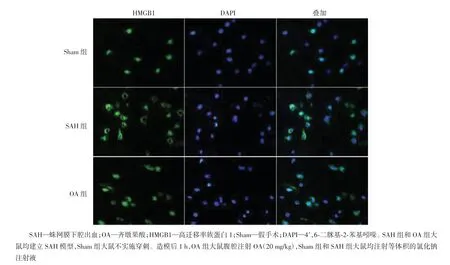
图3 荧光显微镜观察SAH后24 h OA对大鼠脑组织中HMGB1蛋白分布的影响(免疫荧光染色,×400)
2.3 OA对SIRT1介导的HMGB1去乙酰化的影响
乙酰化对HMGB1核质转移和细胞外分泌具有至关重要的作用。SIRT1可通过保持HMGB1处于去乙酰化(非活性)状态来抑制HMGB1的转移和细胞外分泌,从而抑制炎症反应。因此,笔者接着检测了大鼠脑组织中SIRT1和乙酰化HMGB1蛋白的表达。蛋白质印迹结果显示,与SAH组相比,OA组SIRT1蛋白表达明显升高(P<0.001),乙酰化HMGB1蛋白表达降低(P<0.01);而与OA组相比,Sirtinol组SIRT1蛋白表达降低(P<0.01),乙酰化HMGB1蛋白表达升高(P<0.001)(图4)。该结果提示,OA能通过上调SIRT1抑制乙酰化HMGB1蛋白的表达从而减轻炎症反应。

图4 蛋白质印迹法检测SAH后24 h OA对大鼠脑组织中SIRT1和乙酰化HMGB1蛋白表达的影响
2.4 OA对神经元调亡的影响
TUNEL和NeuN双染结果如图5所示,Sham组仅见少量TUNEL阳性细胞;SAH组TUNEL阳性细胞数量明显高于Sham组,而OA给药后能有效减少TUNEL阳性细胞数量;与OA组相比,SIRT1抑制剂Sirtinol可明显增加TUNEL阳性细胞数量。上述结果提示,OA具有抑制神经元调亡的作用。
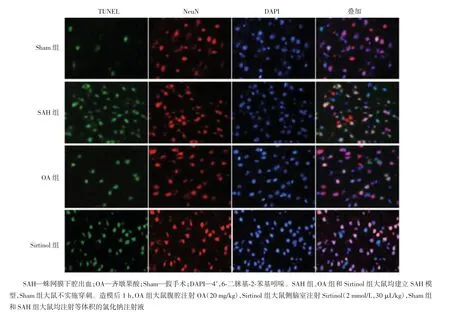
图5 荧光显微镜观察SAH后24 h OA对大鼠脑组织中神经元凋亡的影响(TUNEL和NeuN双染,×400)
3 讨论与结论
虽然SAH的发病率仅占卒中的5%,但其病死率高(40%)、发病年龄较早(45~55岁),给患者家庭和社会带来了巨大负担[10]。HMGB1被认为是炎症反应的重要成分[2,11]。HMGB1的移位和分泌是其诱导炎症的重要步骤[12]。HMGB1可被转录后修饰,主要通过两个核定位位点的赖氨酸乙酰化来影响其在细胞中的定位[13]。免疫细胞被刺激后,高乙酰化介导的HMGB1核质转移和HMGB1的主动释放发生[14]。主动释放的HMGB1能反过来刺激宿主细胞本身和邻近细胞,发挥自分泌和旁分泌作用,从而导致炎症的放大和炎症损伤的发生[15]。释放细胞外的HMGB1通过MyD88途径和非MyD88依赖途径激活多种细胞表面受体,包括晚期糖基化终产物、Toll样受体和趋化因子受体4[16]。随后这些通路直接通过核因子κB途径或间接通过磷脂酰肌醇-3-激酶或丝裂原活化蛋白激酶途径触发信号级联。HMGB1转位和释放被认为在SAH中起着关键作用[3,17]。
在本研究中,笔者发现在SAH后给予OA治疗明显降低了HMGB1在细胞质中的表达并限制其于细胞核中,表明OA抑制了HMGB1的细胞核-细胞质转移。此外,笔者还发现,SAH后HMGB1从细胞核向细胞质的转运主要发生于神经元细胞中。而Murakami等[18]报道,SAH兔模型脑组织中超过90%的小胶质细胞表达HMGB1。显然,这与本研究的研究结果不同,这种差异可能是由于笔者选取的研究时间点为SAH后的24 h,而Murakami等[18]的分析时间点分别为SAH后的第2天和第5天。这表明HMGB1在SAH后的早期脑损伤和迟发性脑损伤中起着不同作用:在早期脑损伤中,HMGB1主要表达于神经元细胞,并与细胞凋亡有关;在迟发性脑损伤中,HMGB1主要表达于小胶质细胞,与免疫激活有关。这是一个有趣且有价值的问题,值得进一步研究。
SIRT是一个高度保守的脱乙酰酶家族,需要NAD+作为脱乙酰基反应的辅助因子[19]。文献报道,SIRT1能调控乙酰化HMGB1的表达[20],且SIRT1活化对SAH后的脑损伤具有保护作用[5]。与其他促炎细胞因子不同,HMGB1为一种晚期反应性炎症介质,在SAH后约20 h达到分泌高峰[21]。因此,本研究观察了SAH后24 h OA对大鼠SIRT1的表达及HMGB1乙酰化和易位的影响。研究结果显示,OA明显增加了SIRT1蛋白的表达,表明OA在SAH大鼠模型中作为SIRT1的激活剂减少了HMGB1从细胞核向细胞质的释放,从而减轻了SAH后的早期脑损伤。
本研究结果表明,OA对SAH后的早期脑损伤具有显著的保护作用。OA可通过抑制HMGB1从细胞核向细胞质的转移,从而抑制HMGB1向细胞外分泌。这种保护作用主要是由于OA激活了SIRT1进而增加了HMGB1的乙酰化。天然化合物OA有望作为SIRT1激活剂用于SAH后早期脑损伤的治疗。
利益冲突所有作者均声明不存在利益冲突

