RhoA/ROCK/ERK-MAPK通路在高磷环境调节内皮细胞凋亡的机制
黄大祥,李梦媛,秦岭,彭艾
高血磷是慢性肾脏病(chronic kidney diseases,CKD)患者常见的电解质紊乱,50%以上的透析患者合并血磷升高,被称为沉默杀手[1]。无论是对于CKD 3~4期的患者、透析患者或肾功能正常者,血磷均与血管钙化和心血管疾病(cardiovascular diseases,CVD)死亡率呈正相关[2-4]。因此,高血磷是CKD患者CVD高发病率和高死亡率的高危因素。
内皮细胞功能障碍和凋亡是CVD的早期事件和始动环节。临床研究表明,正常人即使短期摄入高磷饮食,也能损害内皮细胞功能,影响血管舒张[5];高血压人群即使血磷在正常水平,血磷浓度依然和内皮细胞功能障碍呈正相关[6]。但高血磷造成内皮细胞凋亡和功能障碍的具体分子机制尚未明确。前期的研究中,代谢组学被用来揭示不同磷浓度下内皮细胞氨基酸谱的差异表达[7]。研究发现高磷能在体外诱导内皮细胞凋亡,并推测其可能的机制是通过调节MAPK通路诱导内皮细胞凋亡[8]。然而,其上下游调控蛋白尚不清楚。本研究用体外高磷培养液刺激人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),检测Ras同源物基因家族成员A(Ras homolog gene family,member A,RhoA)/Rho相关卷曲螺旋形成蛋白激酶1/2(Rhoassociated coiled coil forming protein kinase 1/2,ROCK1/2)/丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路相关蛋白的表达,评估ARG的活性和细胞的凋亡情况,并进一步通过RhoA抑制剂SV抑制RhoA/ROCK通路,明确RhoA/ROCK/MAPK通路在高磷诱导内皮细胞凋亡中的作用。本研究为进一步阐明高磷环境内皮细胞凋亡的分子机制提供了理论基础和实验证据。
1 材料与方法
1.1 试剂与仪器兔抗人细胞外信号调控激酶(extracellular signal-regulated kinase,ERK),磷酸化细胞外信号调控激酶(phosphorylated-extracellular signal-regulated kinase,p-ERK),p38,磷酸化p38(phosphorylated p38,p-p38),精氨酸酶1(arginase1,ARG1),一氧化氮合成酶(nitric oxide synthase,NOS)抗体,鼠抗人β-肌动蛋白(β-actin)抗体,辣根过氧化物酶标记山羊抗小鼠IgG,辣根过氧化物酶标记山羊抗兔IgG(美国Cell Signaling Technology公司);内皮细胞培养液(美国Lonza Walkersville公司),RhoA抑制剂辛伐他汀(simvastatin,SV)标准品(美国Sigma公司);BCA蛋白浓度检测试剂盒(上海碧云天公司);奥德赛凝胶成像系统(美国LI-COR公司)。电泳仪,电泳槽,比色仪,细胞凋亡检测试剂盒及流式细胞仪均购自美国BD公司。
1.2 细胞培养及处理HUVEC(中国科学院细胞库)在标准条件下用培养液传代,细胞按处理条件分为正常磷组(1.0 mmol/L),高磷组(3.0 mmol/L),正常磷+SV(1.0 mmol/L+SV),高磷+SV(3.0 mmol/L+SV)培养24 h,SV在培养液中的浓度为100 μg/mL。
1.3 实验方法
1.3.1 Western印迹法收取各组HUVEC,提取总蛋白,检测蛋白浓度(BCA法),SDS PAGE电泳,转膜,5%牛血清白蛋白37℃封闭,2 h后分别加入一抗ERK(1:1 000)、p-ERK(1:800)、p38MAPK(1:1 000)、p-p38MAPK(1:800)、ARG1(1:500)、NOS(1:800)、β-actin(1:2 000)4℃孵育过夜;5%牛血清白蛋白稀释二抗(兔抗1:3 000,鼠抗1:3 000),室温孵育,1 h后洗膜。扫描采用奥德赛凝胶成像系统,βactin为内参,灰度分析使用Image J软件。
1.3.2 ARG活性测定通过比色测定法测定HUVEC的ARG活性。将75 μL,10 mM MnCl2(pH7.5)添加到细胞匀浆中,加热至56℃、10 min,加入50 μL L-精氨酸(pH 9.7),37℃孵育60 min,终止液结束反应。加入25 μLα-异亚硝基苯乙酮,100℃孵育60 min。然后将混合物加载到离心过滤器上,并在室温下以5 000×g离心5 min,分光光度计中540 nm下测定滤液中尿素的浓度,根据尿素生成速度表示ARG活性。
1.3.3 AnnexinV-FITC/PI染色法检测细胞凋亡收集各组HUVEC,室温下离心(1 000 r/min离心5 min),4℃PBS洗涤细胞2次,将5 μL AnnexinVFITC暗处混匀,室温孵育15 min,流式细胞仪检测。
1.4 统计学处理采用GraphPad Prism7.0软件统计和绘图。计量资料以均数±标准差(±s)表示;组间均数差异比较采用t检验,多组间均数差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Western评估蛋白表达情况高磷RhoA和ROCK1/2的表达较正常磷增加,图1。
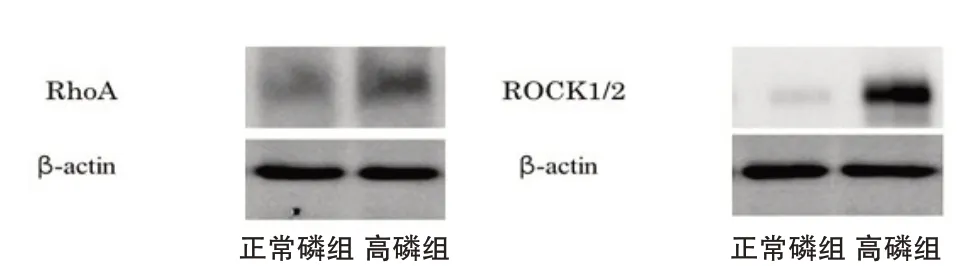
图1 不同磷浓度组的RhoA和ROCK1/2的表达情况
高磷能激活ERK MAPK的表达(正常磷组比高磷组t=20.78,P<0.0001),SV抑制高磷组ERK MAPK的磷酸化(高磷组比高磷+SV组,t=7.746,P=0.0015),图2A;高磷能抑制p38 MAPK的表达(正常 磷 组比 高磷 组,t=20.7,P<0.0001),而对p38 MAPK的 磷 酸 化 无 影 响P>0.05,图2B;高 磷 组ARG1的表达高于正常磷组(正常磷组比高磷组,t=10.78,P=0.0004),图2C;NOS的表达低于正常磷组(正常磷组比高磷组,t=28.32,P<0.0001),图2D;SV能抑制ARG1和增强NOS的表达(高磷组比高磷+SV组,t=7.071,P=0.0021,图2C;高磷组比高磷+SV组,t=7.762,P=0.0002,图2D)。
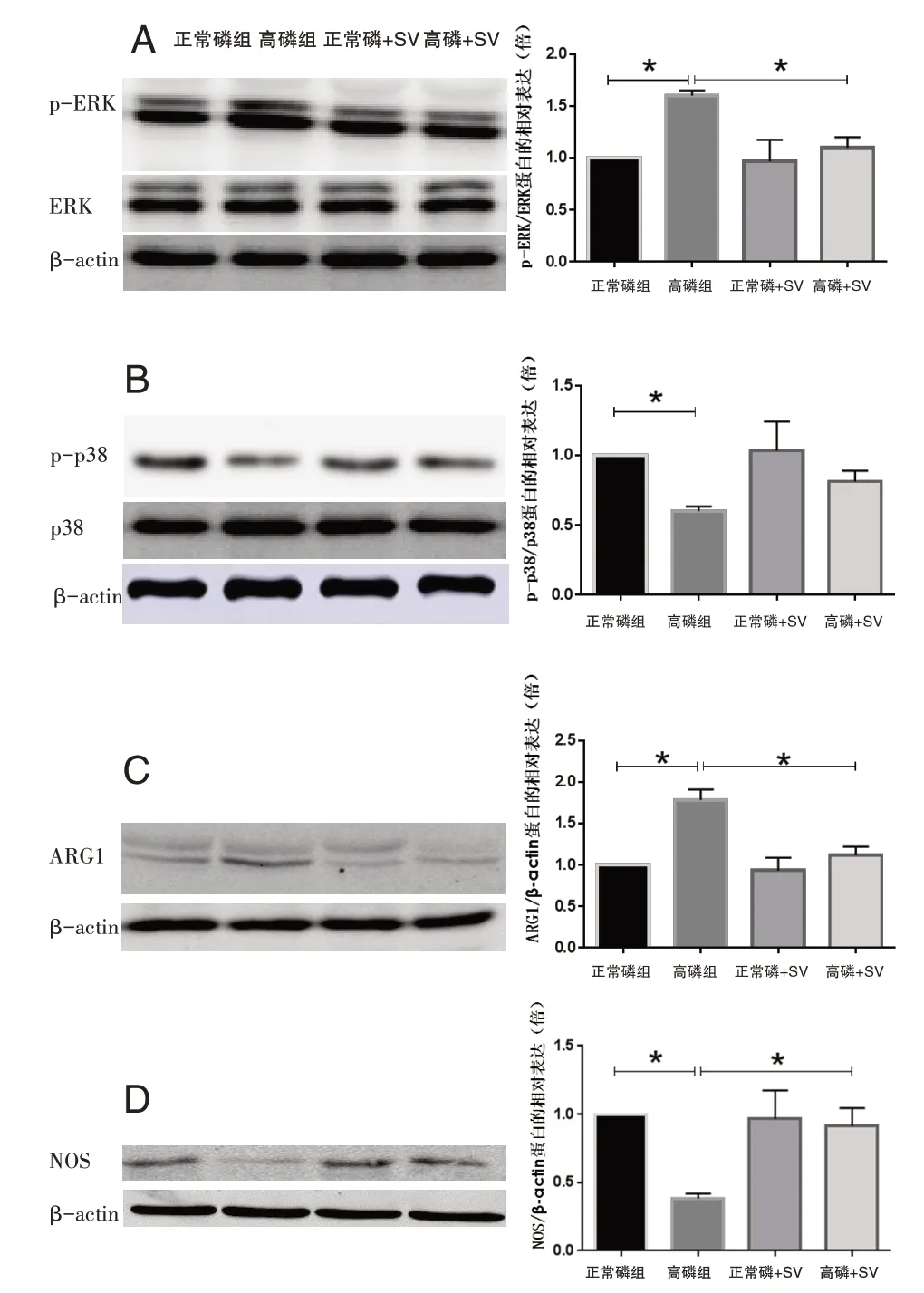
图2 A各组细胞ERK MAPK、p38 MAPK、ARG1及NOS蛋白表达情况
2.2 ARG活性评估和正常磷组ARG活性比较,高磷组ARG活性明显升高(正常磷组比高磷组,t=10.58,P=0.0005),而SV可以抑制高磷组ARG活性(高磷组比高磷+SV组,t=6.501,P=0.0029),图3。
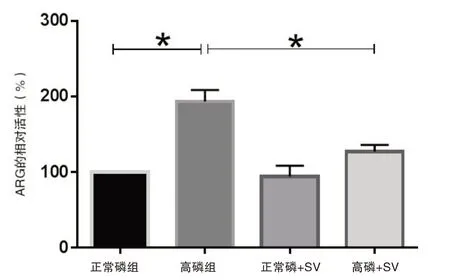
图3 各组HUVEC的ARG活性比较
2.3 细胞凋亡评估高磷组HUVEC的细胞凋亡明显高于正常磷组(正常磷组比高磷组0.8%比9.0%,P<0.001);SV降低高磷HUVEC的凋亡(高磷组比高磷+SV组9.0%比3.8%,P=0.015),图4。

图4 AnnexinV-FITC/PI双染法评估各组HUVEC凋亡情况
3 讨论
高血磷是CKD常见的代谢异常,也是CKD患者发生CVD的独立危险因素[1]。内皮细胞功能障碍和凋亡是CVD的早期事件和始动环节;但高磷如何导致内皮细胞功能障碍和凋亡的机制尚不明确。有研究提出:高磷促进内皮细胞氧化应激水平,增加ROS产生,阻断线粒体膜电位,活化caspase诱导细胞凋亡[9]。前期的研究证实:高磷可能通过激活MAPK通路调节HUVEC凋亡,但其具体调控通路并未进一步深入研究。
ARG能将精氨酸水解成鸟氨酸和尿素,参与鸟氨酸循环。ARG和NOS同时以精氨酸为底物,ARG活性增加可能竞争性抑制NOS合成,减少NO的生成,导致内皮细胞功能障碍和凋亡;抑制ARG活性可促进内皮细胞产生NO,改善内皮细胞功能,减少细胞凋亡[10]。目前,ARG已经成为治疗多种心血管疾病的新靶点[11]。本研究小组曾经报道高磷环境下内皮细胞鸟氨酸,瓜氨酸的表达增加而精氨酸表达减少。本研究推测高磷可能通过提高ARG的活性增加精氨酸的降解,降低精氨酸含量。本研究也发现:高磷环境下内皮细胞的ARG活性以及ARG1的蛋白表达均增加,证实了上述推测。
RhoA/ROCK途径可以调节ARG活性,调节内皮细胞功能[12]。在血管平滑肌细胞,高磷能激活ROCK通路,促进平滑肌细胞的钙化和凋亡[13];RhoA作为p-38 MAPK,ERK-MAPK的调控蛋白,可以调节平滑肌细胞的分化[14];然而,在高磷环境内皮细胞RhoA/ROCK/MAPK信号的激活情况尚无报道。本研究发现,高磷环境下HUVECs的RhoA、ROCK1/2蛋白及下游p-ERK的表达增加,RhoA抑制剂SV可抑制p-ERK蛋白的表达;尽管高磷组pp38的表达低于正常磷,但RhoA抑制剂SV并未改变其表达。因此,本研究认为,虽然都是通过MAPK通路进行调控,但和平滑肌细胞的调控通路不同,高磷环境下RhoA/ROCK是通过调节ERK MAPK通路来调节内皮细胞功能的。另外,本研究中高磷组ARG1的表达升高,ARG活性增加,eNOS的表达减少,提示:高磷条件下HUVEC可通过RhoA/ROCK途径激活p-ERK MAPK的表达,调节ARG活性,抑制NOS活性,引起内皮细胞凋亡和功能障碍。曾有研究报道:血管紧张素II可以通过RhoA/ROCK/p-38 MAPK途径提高ARG活性,从而导致NO合成减少和内皮细胞功能障碍[15]。此外高盐也可以激活ROCK,通过调节不对称二甲基精氨酸导致内皮功能障碍[16]。这些研究结果和本研究结果一致,都证实了RhoA/ROCK/MAPK通路参与调节内皮细胞的功能障碍。
SV是临床上广泛应用的调脂药物。有研究证实:SV可以改善高糖和氧化应激诱导的内皮细胞功能障碍[17-18]。本研究发现:SV作为RhoA的抑制剂,可能会通过抑制RhoA/ROCK/MAPK通路而改善高磷诱导的内皮细胞功能障碍,这一发现提示SV用于合并高血磷的CKD患者,可能有独立于调脂作用的临床获益。当然,需要前瞻性的临床研究来进一步明确上述可能性。
综上所述,本研究验证了高磷诱导内皮细胞凋亡的重要代谢途径。首次发现高磷条件下,HUVEC的RhoA/ROCK/ERK MAPK通路能通过调节ARG活性抑制NOS活性,引起内皮细胞凋亡;SV可以通过抑制RhoA/ROCK/ERK-MAPK通路,改善内皮细胞凋亡。这项研究将为阐明高磷诱导内皮细胞凋亡的分子机制奠定坚实的理论和实验基础,为研究和开发干预CKD患者高磷相关心血管疾病的新药提供新的潜在靶点。

