miR-138-5p通过调控Survivin表达对食管鳞癌细胞活性的影响
哈斯也提·艾力,妮拉·马哈德,帕力达·帕拉哈提,崔晓宾
食管鳞癌是消化道类恶性疾病,其发生率男性高于女性[1],食管鳞癌发病因素主要有长期进食热烫食物、烟酒、烟熏、腌制食物、遗传、基因突变等[2]。食管鳞癌的早期病变多限于黏膜,表现为黏膜充血、糜烂,呈斑块儿和乳头状,少见肿块。中晚期肿块逐渐累积增加并凸入腔内穿透食管进入中隔癌细胞[3]。食管鳞癌具有强侵袭、易复发、预后差等特点。相关研究表明,基因分子对食管鳞癌的治疗具有一定的效果。生存素(Survivin)是凋亡抑制因子的一种,且抑制凋亡能力较强,在正常机体中水平较低,在癌症中水平升高,其水平的高低与肿瘤产生及发展联系密切[4]。微小RNA在多种肿瘤的产生及发展中发挥着重要作用,可通过与其靶基因结合进而调控基因的表达,与细胞的增殖、凋亡等联系密切,miR-138-5p是微小RNA之一,已有研究证实[5]miR-138-5p在肺癌中具有一定的作用,过表达的miR-138-5p可抑制肺癌细胞的增殖、并促进肺癌细胞的凋亡。尚未有关报道明确证实其对食管鳞癌细胞具体的作用,因此本文研究miR-138-5p通过调控Survivin的表达对食管鳞癌细胞活性的影响。
1 材料和方法
1.1 一般资料食管鳞癌细胞系EC8733、EC8501、EC109、EC9706细胞来自上海冠导生物公司。收集喀什地区第二人民医院2018年1月至2020年1月食管鳞癌组织及其癌旁组织标本24例;男性14例、女性10例、年龄(55.65±5.18)岁、肿瘤长度<5 cm、病理分期:T1-T2期9例、T3期15例。所有食管癌患者术前均未接受过放、化疗。清洁级SD大鼠20只,购自长沙天勤生物技术有限公司,鼠龄9~11周,体质量200~300 g,动物许可证号:SCXK(湘)20190018,无菌环境常温饲养,自由饮食饮水,1周后进行实验。本研究经医学伦理委员会获得批准(批号:Y2018-024-05),所有患者及家属均签署知情同意书。
1.2 实验试剂胰蛋白酶(山西利德生物制品有限公司);Primer 5.0软件(北京中科瑞泰生物科技公司);CCK-8试剂(武汉卡诺斯科技有限公司);酶标仪(山东恒美电子科技有限公司);结晶紫染色液(上海如吉生物科技发挥有限公司);流式细胞仪(江苏新力科技实业有限公司);miR-138-5p引物、lipofectamine TM 2000脂质体(百奥迈科生物技术有限公司)。
1.3 细胞培养与分组取食管鳞癌细胞系EC8733、EC8501、EC109、EC9706细胞,运用RPMI 1640培养液培养,36 h后更换培养基。常规条件下培养,取对数期细胞进行试验。
miR-138-5p的转染:将细胞接种于6孔板中培养。直至细胞长到45%~55%时,按说明书操作,用lipofectamine TM 2000转染50 nmol/L相应的miR-138-5p mimics、miR-138-5p-NC,转染培养9 h后,更换新鲜培养液继续培养3 d后即可进行实验。实验分为W组(无转染组)、C组(食管鳞癌细胞转染NC组)、Z组(转染miR-138-5p组)。
1.4 动物实验取20只大鼠,分为食管癌组(注射食管鳞癌细胞)、miR-138-5p组(注射转染miR-138-5p食管鳞癌细胞),每组各10只。各组于右侧前肢腋下注射相应0.5 mL细胞悬液建立移植瘤模型,4 d后肿瘤体积约为100 mm,表示建模成功。
1.5 检测指标
1.5.1 RT-PCR检测Survivin、miR-138-5p水平取W组、C组、Z组食管癌细胞及食管鳞癌组织、癌旁组织标本运用胰蛋白酶消化后提取细胞悬液,冲洗,放于无菌试管中。TRIzol法提取总RNA,Primer5.0软件设计合成引物。将逆转后所得的cDNA进行荧光反应实验。所有反应严格按照反应的条件进行扩增,PCR反应条件:94℃、4 min;94℃、30 s;58℃、30 s;2℃、30 s。取PCR产物(5 μL)进行电泳分析(琼脂糖凝胶1.5%),以GAPDH为内参,共40个循环,取得到的平均值后得到Ct值,计算方法用2-△△Ct法进行分析,引物序列,表1。

表1 引物序列
1.5.2 Western blot检测取W组、C组、Z组细胞,裂解液裂解并提取蛋白,并对蛋白的浓度进行测量,分装后,保存在-20℃的环境中。将提取出的蛋白溶液和缓冲溶液进行混均,然后将其煮沸、变性。把电泳后的50 μm蛋白移至PVDF膜上,脱脂奶粉封闭1 h。加入1抗后PBS漂洗3次,每次间隔10 min,最后加入2抗对溶液稀释,常温封闭1 h。取出PVDF膜,上述方法漂洗,DAB显色后照相。
1.5.3 Transwell小室测迁移能力取W组、C组、Z组细胞,用DMEM培养液重悬后将细胞悬液(6×104/孔)加入Transwell小室的上室,下室加入1 mL含10%FBS的高糖DMEM培养液。培养72 h后取出小室,PBS漂洗2次,4%的多聚甲醛溶液固定15 min,用棉签擦去上层细胞,加入0.1%结晶紫染色液染色15 min。自来水冲洗3次,显微镜拍照。实验重复3次。
1.5.4 CCK-8检测食管鳞癌细胞增殖情况取W组、C组、Z组细胞,离心5 min,1250 r/min,制成细胞悬液,接种于96孔板中(4×103个细胞)。分别于细胞贴壁后24、48、72 h加入CCK-8试剂,避光孵育3 h。酶标仪检测450 nm处OD值。
1.5.5 流式细胞仪检测食管鳞癌细胞凋亡情况
取W组、C组、Z组细胞接种于6孔板中,胰酶消化,完全培养基终止;PBS清洗,进行细胞计数,离心5 min、1250 r/min,弃上清,混入500 μLBinding Buffer(结合缓冲液)重悬。加入5 μLAnnexinV-FITC混匀、10 μL PI混匀,常规孵育15 min后,流式细胞仪检测。
1.5.6 双荧光素酶报告基因检测实验将2×105个/孔细胞接种于6孔板中,待细胞生长融合至80%时,参照LipofectamineTM2000转染试剂说明书将构建好的Survivin′-UTR-WT和Survivin′-UTR-MUT质粒转染miR-NC(NC组),miR-138-5p mimics(miR-138-5p组)共转染至细胞,按照双试剂盒操作步骤检测各组细胞荧光素酶活性。
1.5.7 观察各组大鼠移植瘤生长情况建模成功4周后处死大鼠,测量肿瘤病灶的长径以及与其垂直的短径,计算瘤体积;同时称瘤质量,计算抑瘤率。
1.6 统计学处理采用SPSS 18.0统计软件进行分析,W组、C组、Z组3组食管鳞癌细胞增殖、迁移、Survivin水平等影响的比较采用单因素方差分析,两组间比较采用t检验,计量资料以均数±标准差(±s),P<0.05为差异有统计学意义。
2 结果
2.1 miR-138-5p、Survivin水平检测结果miR-138-5p在食管癌组织中的表达水平低于癌旁组织(P<0.05);Survivin在食管癌组织中的表达水平高于癌旁组织(P<0.05),图1。
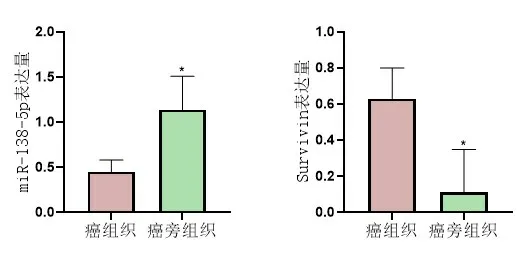
图1 癌组织组与癌旁组织组miR-138-5p、Survivin水平比较*表示与癌组织组比较(P<0.05),实验重复3次
miR-138-5p在食管鳞癌细胞系EC9706细胞中表达最低(P<0.05),且Survivin在食管鳞癌细胞系EC9706细胞中表达最高(P<0.05),因此选择EC9706细胞进行本次实验,图2。
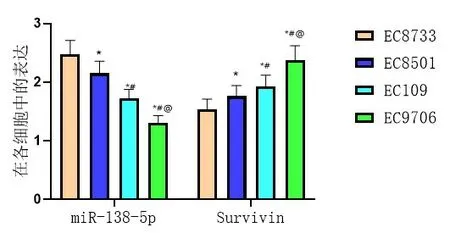
图2 各细胞中miR-138-5p、Survivin水平表达
miR-138-5p、Survivin在W组与C组中的水平较为接近,组间比较差异无意义(P>0.05);在Z组中miR-138-5p的水平有所上升、Survivin水平有所下降,组间比较差异有统计学意义(P<0.05),由此可看出,miR-138-5p转染成功,图3。
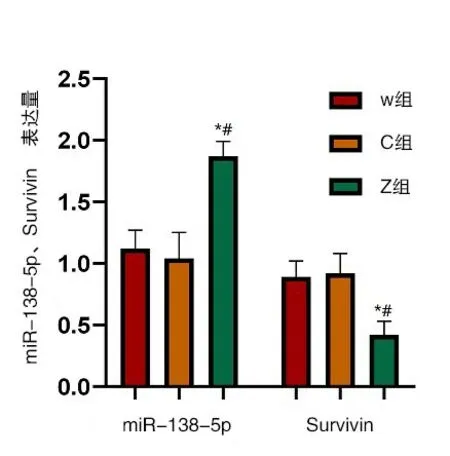
图3 miR-138-5p、Survivin在W组、C组、Z组细胞中的水平与W组比较,P*<0.05、与C组比较,P#<0.05,实验重复3次
2.2 Notch1、HIF-1α、MMP-9水平的检测结果W组与C组中Notch1、HIF-1α、MMP-9水平较为接近,组间比较差异无意义(P>0.05);与W组、C组比较,Z组中Notch1水平有所升高、HIF-1α、MMP-9水平有所下降,组间比较差异有意义(P<0.05),见图4。
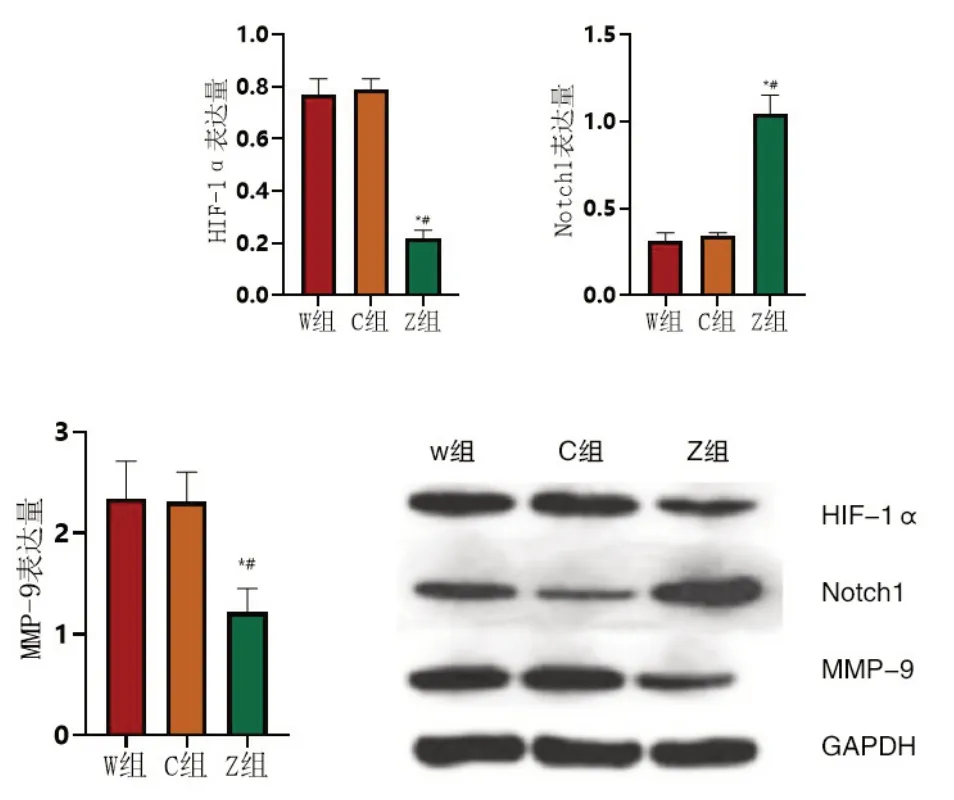
图4 三组Notch1、HIF-1α、MMP-9水平比较
2.3 食管鳞癌细胞迁移能力W组食管鳞癌细胞迁移数量(282.67±27.65)与C组细胞迁移数量(279.31±28.22)相差较小,组间比较差异无统计学意义(P>0.05);与W组、C组比较,Z组中的迁移数量(76.57±6.71)有所降低,组间比较差异有意义(P<0.05),图5。
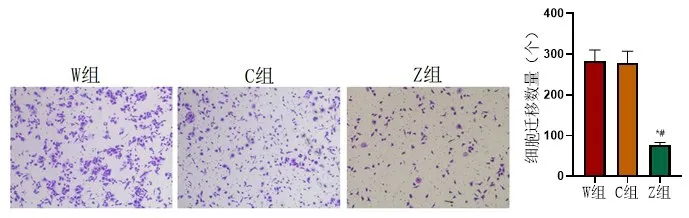
图5 W组、C组、Z组食管鳞癌细胞迁移情况比较与W组比较,P*<0.05、与C组比较,P#<0.05,实验重复3次
2.4 食管鳞癌细胞增殖情况W组与C组在24、48、72 h的OD值较为接近,组间比较差异无统计学意义(P>0.05);Z组在各时间点的OD值均较W组与C组低,组间比较差异有统计学意义(P<0.05),表2、图6。
表2 三组不同时间点OD值的比较(±s)
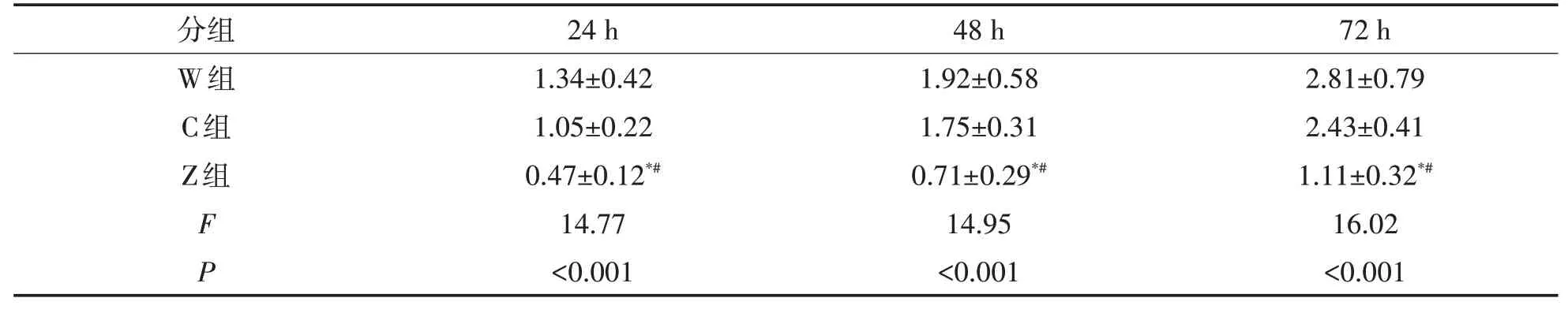
表2 三组不同时间点OD值的比较(±s)
?
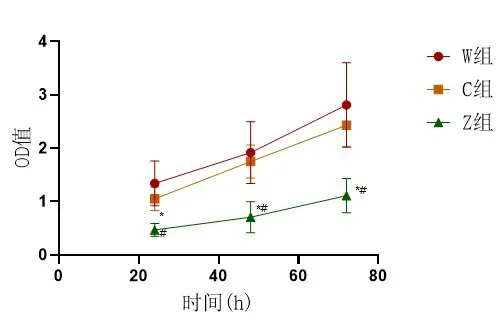
图6 三组食管鳞癌细胞不同时间点OD值比较与W组比较(P*<0.05)、与C组比较(P#<0.05),实验重复3次
2.5 食管鳞癌细胞凋亡情况W组食管鳞癌细胞凋亡率(2.47±0.11)%与C组食管鳞癌细胞凋亡率(2.45±0.13)%较为接近,组间比较差异无意义(P>0.05);Z组食管鳞癌细胞凋亡率(13.32±1.23)%高于W组与C组,组间比较差异有意义(P<0.05),见图7。
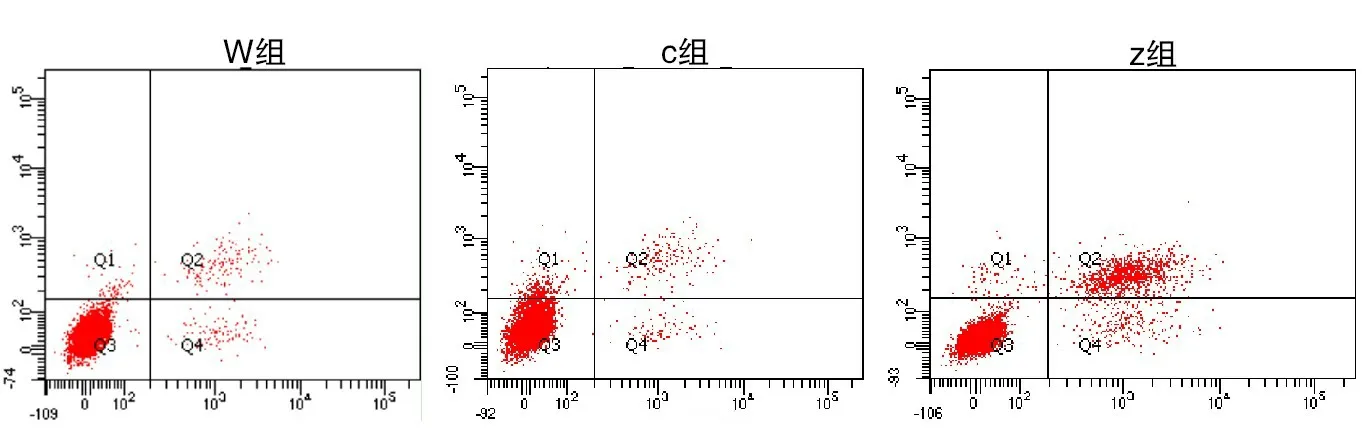
图7 三组食管鳞癌细胞凋亡情况比较,实验重复3次
2.6 双荧光素酶检测报告结果结果显示Survivin′-UTR-WT在miR-NC组表达水平为(0.79±0.09)、miR-138-5p组表达水平为(0.59±0.07),组间比较差异有统计学意义(P<0.001);Survivin′-UTRMUT在miR-NC组(0.91±0.11)及miR-138-5p组(1.02±0.12)表达无统计学差异(P>0.05),说明Survivin是miR-138-5p的直接靶点,图8。
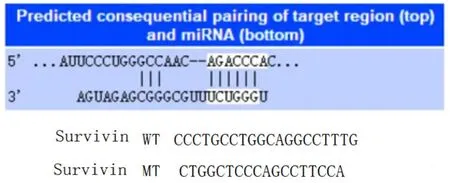
图8 荧光素酶报告图
2.7 各组移植瘤生长情况与食管癌组比较,miR-138-5p组大鼠移植瘤的瘤体积、瘤质量降低,抑瘤率升高(P<0.05),见表3。
表3 各组大鼠移植瘤生长情况(±s)

表3 各组大鼠移植瘤生长情况(±s)
?
3 讨论
目前,中国是食管鳞癌的高发地区,发病率位列恶性肿瘤的第四位,且有逐年增长的趋势[6]。威胁患者的生命健康安全,寻求新的食管癌分子靶向治疗方法迫在眉睫,因此本文运用miR-138-5p调控Survivin对食管鳞癌进行治疗,具体分析如下。
在肿瘤的产生与发展过程中,微小RNA通过调节基因的表达,从而调控细胞的生物活性,间接发挥促癌或抑癌的作用,已有研究证实[7]微小RNA在多种肿瘤中参与癌细胞的增殖、迁移等,miR-138-5p是miRNA的 一 种。miR-138-5p可通过 靶 向调控其下游基因进行调控细胞的生物活性,Survivin是miR-138-5p的下游基因之一,可直接作用其上下游分子,对细胞凋亡途径具有抑制作用,在正常机体中水平较低,在癌症中水平升高,其水平的高低与肿瘤的产生与发展密切相关,是抑制细胞凋亡的重要基因之一[8-9]。经本文研究发现在经过转染miR-138-5p模拟物后,miR-138-5p水平有所增加,Survivin水平有所下降。YangR等[10]研究提示,miR-138-5p与Survivin为负相关,miR-138-5p直接识别并结合Survivin mRNA转录,从而抑制Survivin在膀胱癌细胞中的作用,降低癌细胞的增殖与侵袭能力。张志明等[11]对前列腺癌的实验研究中提出,基因敲除SIRT1靶向结合miR-138-5p具有促进癌细胞凋亡的作用。本文研究与上述研究结果相似。且本文荧光酶报告结果、以及动物实验结果表明转染miR-138-5p具有一定的抑瘤作用。
Notch信号通路可调控细胞的分化,根据近年来的研究发现[12-13],Notchl信号还与肿瘤的产生密切相关,其表达水平的变化还起着抑癌或促癌的作用;有关研究指出[14-15],当小鼠体内的Notchl被敲除时,小鼠的皮肤发生增殖、基地细胞样癌形成,其原因与Notchl信号通路被激活引起与细胞凋亡相关途径发生改变有关。HIF-1α是一种调控细胞增殖和血管进化相关基因转录的重要因子,在多种肿瘤中均呈现高表达[16]。miRNA具有转录后调控因子水平的作用,多项研究已证实miR-138-5p与HIF-1α具有一定的相关性[17]。肿瘤细胞或周围间质细胞可分泌出MMP,可降解细胞外基质以及细胞间的黏附、促进新生血管生成从而增加癌细胞的活性,MMP-9是金属机制蛋白酶之一,且其与肿瘤的发生发展密切相关[18-19]。miR-138-5p定位于chr16染色体,在多种肿瘤中均为低表达,发挥抑癌作用,对肿瘤细胞的增殖、迁移具有一定的抑制作用[20]。经本文研究表明,经过转染miR-138-5p模拟物后,Notch1水平升高,HIF-1α、MMP-9水平降低。史永亮[21]提示Notch1、Survivin在甲状腺乳头状癌中呈负相关关系,与癌细胞的转移和侵袭联系密切。在王丽萍[22]等对试食管鳞癌的实验中提出,Notch1与食管鳞癌的产生、发展和转移联系密切,可评估食管鳞癌病情的严重程度。赵军华等[23]研究提示,HIF-1α是miR-138-5p的靶基因,在肾癌细胞中miR-138-5p通过靶向调控的表达HIF-1α削弱了癌细胞的增殖、侵袭并抑制了其凋亡。在刘正端等[24]对食管鳞癌细胞研究的实验中发现,MMP-9水平升高,食管鳞癌细胞的侵袭与转移加剧。尚双艳[25]提示Survivin与MMP-9在胃癌中具有正相关关系。本文研究与上述研究结果相似,均认为提高Notch1的表达,降低HIF-1α、MMP-9水平可抑制肿瘤发展,因此本文推测,miR-138-5p通过靶向调控Survivin及HIF-1α的表达间接提高Notch1的水平,抑制了MMP-9表达,从而抑制了食管鳞癌的发展。且CCK8测增殖、Transwell小室测细胞迁移以及流式细胞仪测凋亡结果均可证实上述结论。
综上所述,miR-138-5p可通过降低Survivin的表达,抑制食管鳞癌细胞的增殖及迁移,并促进其凋亡,其作用机制可能与HIF-1α、Notch1及MMP-9表达有关。

