宫颈小细胞癌新辅助化疗临床价值的Meta分析
王光艳, 贾雪梅
宫颈小细胞癌(small cell carcinoma of the cervix,SCCC) 是一种罕见的神经内分泌肿瘤(neuroendocrine carcinoma,NEC),包括小细胞神经内分泌肿瘤、小细胞未分化癌、嗜银细胞癌等。其发病率占宫颈恶性肿瘤3%,人群发病率低于0.06 /10万[1]。不同于宫颈鳞状上皮恶性肿瘤,SCCC侵袭性强,早期易合并脉管癌栓和淋巴结转移,出现疾病复发、转移,常见的转移部位包括骨、肺、肝、脑等,总体预后差[2]。由于本病缺乏统一规范的治疗方案,各家单位报道的生存情况存在较大差异,5年生存率4%~51%[3-4],尚需积累更多资料综合分析,寻求更合理的治疗方案。
术前纳入新辅助化疗(neoadjuvant chemotherapy, NACT)具有消除微转移灶,耐受性好,提高手术切除率等优势。但SCCC中运用术前NACT的价值,目前仍存在一定争议。本文进行了Meta分析,研究NACT和生存预后的关系,探讨新辅助化疗应用于宫颈小细胞治疗的临床价值。
1 资料和方法
1.1 文献纳入和排除标准 因宫颈小细胞癌研究数量少、纳入患者数量均较少,因此在纳入标准上适当放宽,以求囊括更多研究,如存在异质性,则进行亚组分析。研究纳入标准为:①对照临床研究和队列研究,英文或中文撰写;②研究对象为经病理确诊的SCCC患者,无年龄或种族限制;③研究比较了新辅助化疗+手术治疗与手术治疗,术后联合辅助治疗也纳入分析(即研究组和对照组的差别仅在于是否增加新辅助化疗);④研究提供了如下生存结果:总生存(overall survival, OS),无进展生存(progress-free survival, PFS)、风险比(hazard ratio, HR)及其95%的置信区间 (confidence interval, CI)。如果文献没有提供HR,但提供了生存率或Kaplan-Meier生存曲线或原始数据,则可用于计算或估计HR、95%CI[6]。排除标准:①病例报告、述评及综述;②非SCCC或混杂其他病理组织学类型宫颈癌;③单臂研究;④未提供充分信息的文献或无法获得全文;⑤无法获取生存结果数据。
1.2 文献检索 在Pubmed、Web of Science、EMBASE、Cochrane、万方数据库、CNKI数据库中进行检索,检索时间:2000年1月1日 至2019年6月1日。手动检索了相关综述的参考文献,并将相似文献也纳入进行筛选。使用的检索词包括 “Small cell carcinoma of the cervix”、“Small cell neuroendocrine carcinoma of the cervix” 、“Neuroendocrine carcinomas of the uterine cervix”、“Neoadjuvant chemotherapy”、“Neoadjuvant treatment”、“Induction chemotherapy”、“宫颈小细胞癌”、“宫颈神经内分泌癌”、“新辅助化疗”、“诱导化疗”等。
1.3 数据提取 提取研究中出版年份、第一作者姓名、作者单位、种族、研究组和对照组人数、中位年龄、中位生存时间、中位随访时间、研究组和对照组的治疗方案和临床结果,并进行复核。
1.4 文献筛选和质量评估 两名研究者通过纽卡斯尔渥太华量表(Newcastle-Ottawa Scale, NOS)来评估所有队列研究[5]。NOS提供了基于3个方面的队列研究的标准质量评估,即评估暴露和未暴露队列的选择、两个队列之间的可比性以及结果的评估。对于选择和结果类别中的每个编号项目,研究最多可获得1颗星。为便于比较,最多每项可给出2颗星。如果所有标准都满足,将得到9颗星。6星表示高质量。通过小组讨论解决了分歧。
1.5 统计学方法 使用R语言软件v5.6.2计算HR的自然对数ln(HR)及方差v[ln(HR)],并利用“Meta”、“Metagen”等程序包进行Meta分析。异质性分析采用Q检验和I2进行评估,但根据具体内容的差异,采用不同模型。如果Q检验的P>0.10,I2<50%,则研究的异质性被视为相对较小,采用固定效应模型进行分析;如果Q检验的P<0.10,I2>50%,则研究的异质性被视为相对较大,采用随机效应模型进行分析。通过程序包中的“Forest”函数进行森林图绘制,“Plot”函数进行漏斗图绘制,以评价发表偏移,并对研究进行敏感性分析。最后将上述图表汇总导出。
2 结果
2.1 纳入研究情况 共纳入8项回顾性研究[6-13],纳入患者的流程见图1,质量评价见表1。

表1 纳入文献的质量评估

图1 筛选研究流程图
临床基本特征见表2。总计270例SCCC患者纳入最终分析,年龄28~87岁,7项中位随访时间为14~44个月(1项研究未记录随访时间),其中4项研究中位随访时间≥2年。新辅助化疗方案包括基于铂类和非铂类方案,主要有EP,TP,VPB等方案[博来霉素(B)、顺铂(P)、依托泊苷(E)、5-氟尿嘧啶(F)、紫杉醇(T)或长春碱(V)]。纳入研究的质量评价见表2。
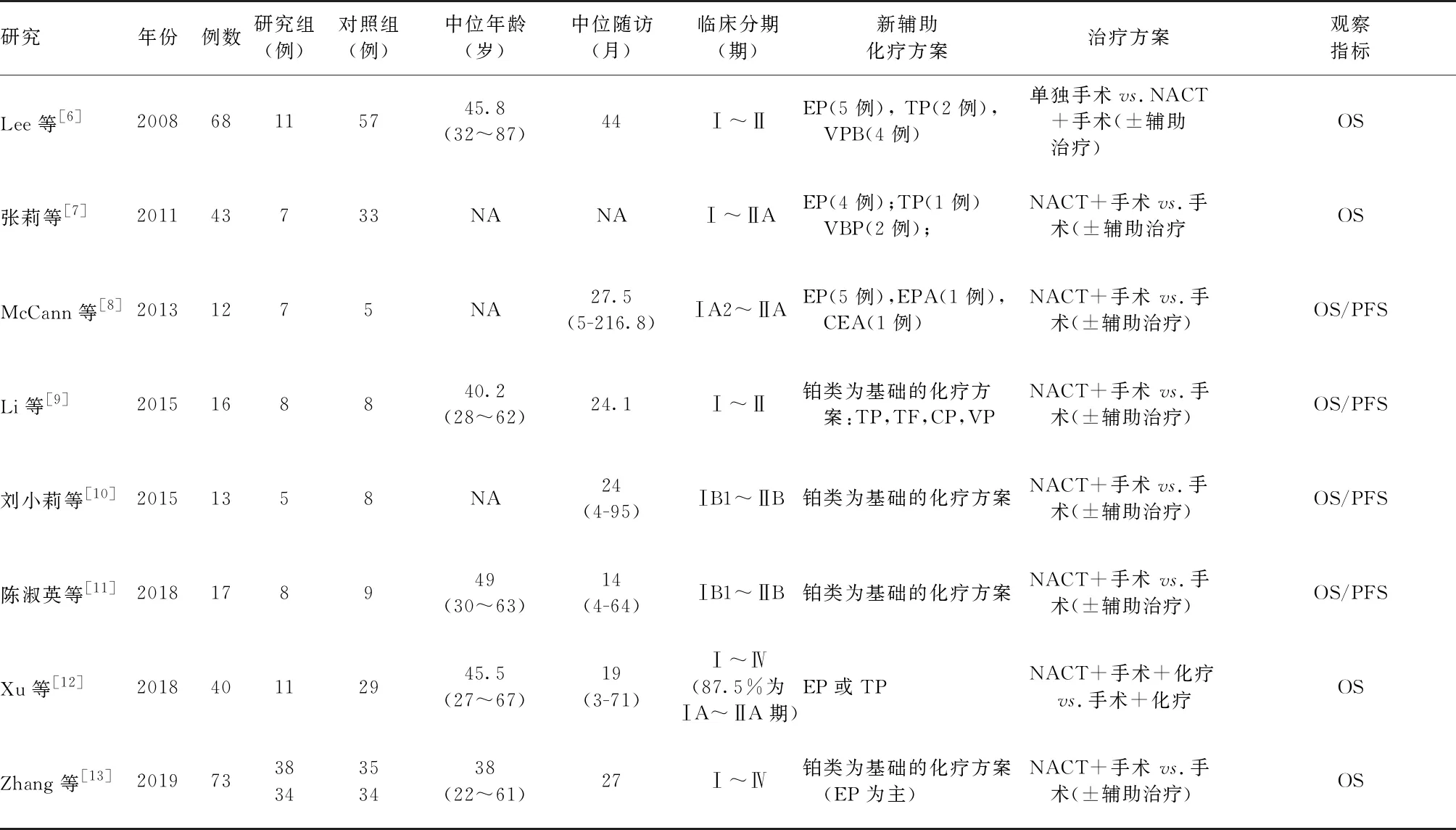
表2 实施新辅助化疗的SCCC患者的一般临床资料×
2.2 新辅助化疗对宫颈小细胞癌预后的影响 森林图结果如图2。汇总的效应值HR在“1”的左边代表对于SCCC患者加用新辅助化疗可以延长患者生存,而在“1”的右边代表没有使用新辅助化疗的观察组的生存更长,如果汇总HR的图形覆盖分界值,则代表新辅助化疗组和实验组直接的生存没有统计学差异。可以看出,对于SCCC患者,新辅助化疗(NACT)并未改善患者无进展生存(HR 1.61, 95% CI:0.68~3.78,P=0.26)和总生存(HR 1.84, 95% CI:1.24~2.74,P<0.05)。异质性检验提示各研究之间异质性小,结果具有较好的一致性(OS:P=0.75,I2= 0;PFS:P=0.61,I2=0)。
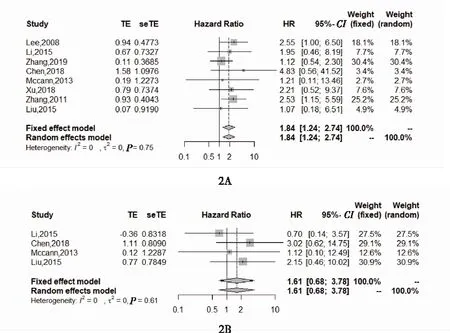
图2 新辅助化疗对宫颈小细胞癌总生存(2A)、无进展生存(2B)影响的森林图
对Ⅰ~Ⅱ期进行亚组分析后结果与总体人群相一致,及早期SCCC患者进行新辅助化疗,观察到患者并没有生存获益(HR 1.84, 95% CI:1.21~2.81,P<0.05)(图3)。
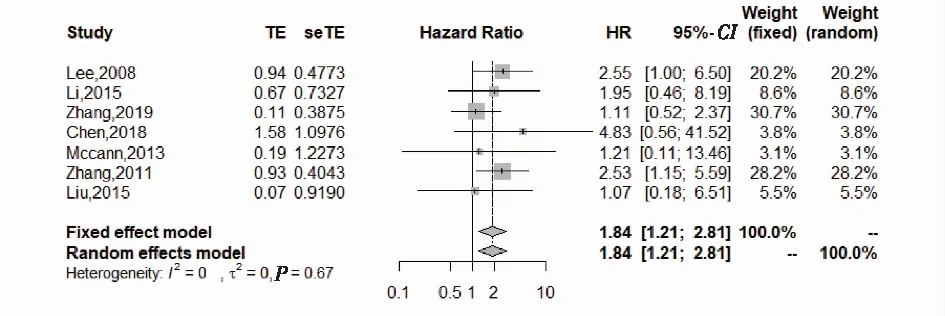
图3 早期宫颈小细胞癌亚组生存分析森林图
漏斗图提示OS的发表较为平均,偏倚较小,但PFS的发表在效应值的两端分布不均匀,存在发表偏倚可能(图4)。由于本研究异质性很小(I2=0),因此未进行敏感性分析。
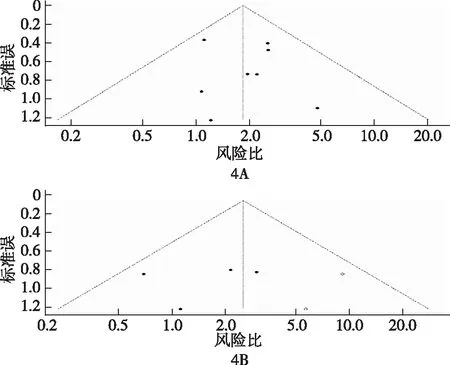
图4 发表研究总生存(4A)、无进展生存(4B)的偏倚漏斗图
3 讨论
宫颈小细胞癌由于发病率相对较低,发表的研究多为个案报道,缺乏高质量证据,因此还未形成高级别的循证医学证据。SCCC在镜下的形态酷似小细胞肺癌,治疗上多借鉴小细胞肺癌的经验,或借鉴传统宫颈癌,地区和医院之间的治疗存在较大差异,目前尚未形成统一公认的治疗方案,临床上多采用根治性手术联合放化疗等的综合治疗[14]。SCCC呈弥漫浸润性生长,恶性程度高、易发生远处转移,有研究表明,远处转移是SCCC的主要复发模式。因此作为全身治疗的重要手段,化疗在SCCC综合治疗模式中占有重要地位。
在宫颈鳞癌中,一项近期的荟萃分析显示,对于局部晚期宫颈癌(FIGO分期为ⅠB2~ⅡB)患者,术前NACT是一种公认的有效治疗方法,可以延长患者的OS。然而,NACT是否延长DFS和PFS尚不明确。目前,在根治性手术前是否使用NACT取决于外科医生的经验和临床判断[16]。国内一项研究对比了多西他赛(DTX) + 顺铂(DDP) 、紫杉醇(TAX) + DDP 新辅助化疗方案对局部晚期宫颈癌的临床治疗价值[16],在近期疗效上两者无统计学差异,但是DTX联合DDP具有较低的毒性。
在小细胞肺癌中,新辅助化疗的使用存在争议。大部分研究认为新辅助化疗在Ⅰ~Ⅱ期小细胞肺癌患者中存在获益,对Ⅲ期患者存在争议。Fujimori等[17]及Hara等[18]认为特别是对于存在淋巴结转移的患者先行新辅助化疗更有利于病灶控制、手术切除以及后续的生存。Wada等[19]则认为而Ⅲ期患者即使进行新辅助化疗也并不能提高可切除率、增加手术的获益。同时有研究认为,对于临床Ⅰ期的患者直接手术相比新辅助化疗的生存率更高[20]。Granetzny等[21]对于Ⅰ~Ⅱ期的患者可行手术联合放化疗,而Ⅲ期可先行新辅助化疗,若纵膈淋巴结转阴(即化疗后降期降级)的患者则进行手术。Veronesi的观点与Granetzny则相互辅证[22],该研究认为,化疗的反应率可以提示预后,新辅助化疗后SCCC患者重新分期为0或者Ⅰ期的患者手术治疗可以获益,而对化疗反应差的患者则不推荐手术治疗。这些研究虽未得到统一答案,但是对SCCC的研究有所提示。
SCCC主要采用铂类为基础的化疗方案,但目前最佳联合模式尚存在一定争议[23]。NACT在临床上应用较为广泛,Gadducci等[24]推荐SCCC综合治疗,即对ⅠB2~ⅡA2期的SCCC患者,应于根治性手术前行3周期NACT。然而越来越多的研究显示,新辅助治疗不能提高患者的远期生存[6-13,25]。
本研究中,我们通过对最终符合条件的8项回顾性研究展开分析,发现SCCC患者,尤其是早期患者增加新辅助化疗,基于铂类的新辅助化疗不能提高患者的长期生存率,弊大于利。本研究纳入的8篇文献中7篇为亚洲研究,因此结论可能存在一定的地域特异性。虽然研究之间异质性较小,但SCCC属于较为罕见的癌种,本文纳入的8篇研究中无随机对照实验,且样本量少,多数研究没有进行配对分析,导致混杂因素较多,如分期治疗方案、分子分型、淋巴结转移情况等,因此影响了纳入研究的质量。此外,部分研究采纳了单因素分析中的效应量HR,进一步影响了研究结果的准确性;并且新辅助化疗介入的时机及化疗方案均可能影响SCCC患者的生存。我们在纳入的8篇文献中观察到新辅助化疗带来的近期临床获益及远处转移率会下降,未来还需要开展更多高质量的研究深度比较,希望将新辅助化疗短期疗效转化为生存获益。SCCC患者接受新辅助化疗后的缓解率可能也预示患者的预后,能指导后续的治疗,甄别对放化疗敏感的人群选择性进行放化疗。而与传统宫颈鳞癌中使用新辅助化疗的结果不同,可能原因有:①SCCC患者样本量过小,结果产生不可避免的选择偏倚;②SCCC呈弥漫浸润性生长,加之病理类型不同,新辅助化疗难以达到与鳞癌相似的周边微小转移灶的清除率和淋巴结控制率。
即便使用较为激进的综合治疗,SCCC 5年生存率仅约34%。寻找有效的治疗方式至关重要。近年进展较快的领域是靶向免疫治疗。FDA已批准抗血管内皮生长因子(VEGF)单克隆抗体贝伐珠单抗用于治疗复发转移性或持续性宫颈癌患者[26]。HPV相关肿瘤中EGFR多数呈现过表达,应用EGFR靶向治疗是可以选择的治疗方向。一项小样本Ⅱ期临床试验显示,使用厄洛替尼联合顺铂为基础的同步放化疗治疗36 例局部晚期宫颈癌,患者耐受良好,完全缓解者34 例,3 年OS及DFS分别为 80.0%和 73.8%[27]。除此之外免疫治疗也在宫颈癌的综合治疗中占有越来越重要的地位。目前2019 年NCCN指南推荐对于存在DNA错配修复缺陷 /微卫星高频不稳定性、或PD-L1 阳性的复发转移性晚期宫颈癌,帕博丽珠单抗可作为二线治疗选择[28]。已有1 例纳武单抗治疗复发转移性 SCCC的个案报道,显示患者获得了完全缓解[29],为未来进一步的临床实践提供了线索和希望。由于HPV感染与SCCC密切相关,应用HPV治疗性疫苗也是未来SCCC的治疗选择之一。
本研究通过对符合条件的研究进行Meta分析,观察到新辅助化疗并没有改善患者总生存。但新辅助化疗联合手术/辅助治疗的模式存在短期的临床获益,仍有研究空间。我们将对包括辅助化疗、放疗及免疫靶向治疗等在内的各类综合治疗模式进一步分析,以期为SCCC的临床治疗提供更多依据及借鉴。

