澳洲坚果青皮总酚的超声辅助提取及纯化
张明 马飞跃 杜丽清 李娅 黄浩伦 涂行浩 陈妹


摘 要:为高效利用澳洲坚果青皮资源,以及获得纯度较高的澳洲坚果青皮酚类物质,本研究优化了超声辅助提取澳洲坚果青皮总酚以及D101大孔树脂纯化工艺条件。结果表明,超声辅助提取澳洲坚果青皮总酚的最佳工艺条件为乙醇浓度30%、料液比1∶50 g/mL、超声温度70 ℃、超声时间24 min、超声功率250 W,在此条件下,总酚提取量为(1836.2132.51) mg/100 g;D101大孔树脂纯化工艺的吸附条件为上样液总酚浓度2 mg/mL、上样速度2 BV/h、上样体积11.50 BV,解吸条件为10%、20%、30%乙醇溶液以3 BV/h洗脱速度进行梯度洗脱6 BV,在此条件下,总解吸率可达81.41%,各组分总酚纯度分别为57.64%、72.97%、65.54%。研究结果为澳洲坚果青皮酚类物质进一步开发与利用奠定了基础。
关键词:澳洲坚果青皮;超声辅助;总酚;纯化
中图分类号:S664.9; O625.31 文献标识码:A
Ultrasonic Assisted Extraction and Purification of Total Phenols from Macadamia Green Peel
ZHANG Ming1, MA Feiyue1, DU Liqing1*, LI Ya1, HUANG Haolun2, TU Xinghao1, CHEN Mei1
1. South Subtropical Crops Research Institute, Chinese Academy of Tropical Agriculture Sciences / Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture & Rural Affairs, Zhanjiang, Guangdong 524091, China; 2. Institute of Scientific and Technical Information, Chinese Academy of Tropical Agriculture Sciences, Haikou, Hainan 571101, China
Abstract: The ultrasonic-assisted extraction of the total phenols from macadamia green peel and the purification with D101 macrospores resin were optimized to promote the utilization of macadamia green peel resources. The optimal extrac?tion parameters to obtain the highest total phenols were ethanol concentration of 30%, solid-liquid ratio of 1 : 50 g/mL, extraction temperature of 70 ℃, extraction time of 24 min, ultrasonic power of 250 W. And the yield of total phenols was (1836.2132.51)mg/100 g when conducted at the optimal conditions. The results of purification process presented that the adsorption process conditions were as follows: total phenols concentration of sample 2 mg/mL, sample solution flow velocity 2 BV/h, sample volume 11.50 BV, and the desorption process could be gradient eluted by 10%, 20%, 30% ethanol of 6 BV at 3 BV/h, which gave the desorption ratio of 81.41% and purity of 57.64%, 72.97%, 65.54%, respectively. This present study would provide a theoretical reference for the further application of macadamia green peel phenols.
Keywords: macadamia green peel; ultrasonic-assisted; total phenols; purification
DOI: 10.3969/j.issn.1000-2561.2021.07.031
澳洲堅果(Macadamia ternifolia)又称夏威夷果、澳洲核桃等,原产于澳大利亚的新南威尔士和昆士兰[1]。澳洲坚果果仁中富含维生素B6、膳食纤维和锰、铁、镁等矿物质营养素,且不饱和脂肪酸含量高,风味独特,经济价值高,被誉为“坚果之王”[2-3]。从1979年开始进行环境适应性试验发展至今,我国已成为世界上澳洲坚果种植面积最大的国家[4],且随丰产期的到来,产量将进一步增加[5]。当前,澳洲坚果加工产业不断发展壮大,但主要集中于澳洲坚果(壳果)等休闲小食品的加工,而青皮等副产物的综合利用度较低,因此,澳洲坚果青皮的开发与利用也将成为新课题。
前期研究表明,澳洲坚果青皮中含有丰富的酚类物质、总黄酮等生物活性物质,且具有较强的DPPH自由基、ABTS自由基清除能力和总抗氧化还原能力[6-7]。而酚类物质的利用会受制于其提取过程,由于传统浸提法存在提取效率低等问题,广大科研工作者致力于其替代方法的研究[8]。近年来,超临界流体萃取、酶法提取、微波辅助提取和超声辅助提取等新型提取技术已开始用于酚类物质提取。其中,超声辅助提取以设备简单、环保等优点而广受关注,其原理是利用空化作用破坏植物组织并增加传质,缩短提取时间,从而提高提取效率[9-10]。因此,为充分利用澳洲坚果青皮资源,本研究以乙醇浓度、料液比、超声温度、超声时间和超声功率5个因素进行单因素和正交实验,对超声辅助提取澳洲坚果青皮总酚工艺条件进行优化,并对D101大孔树脂的静态吸附与解吸、动态吸附与解吸条件进行优化,以期获得纯度较高的澳洲坚果青皮酚类物质,为后续成分鉴定及改性研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 澳洲坚果青皮(水分含量65.36%):‘南亚1号澳洲坚果青皮经清洗、沥水、粉碎后,置于4 ℃冰箱保存备用。
1.1.2 主要试剂 没食子酸,国药集团化学试剂有限公司;碳酸钠,天津福晨化学试剂厂;福林酚试剂,上海源叶生物科技有限公司;无水乙醇,广东光华科技股份有限公司;D101大孔吸附树脂,陕西乐博生化科技有限公司。以上所用试剂均为分析纯。
1.1.3 仪器与设备 ME 104/02 电子分析天平,托利多仪器(上海)有限公司;Precision MLG3 旋转蒸发仪,德国Heidolph公司;SK8210HP超声波清洗器,上海科导超声仪器有限公司;Multifuge X1R台式高速冷冻离心机,美国Thermo公司;YB-250A高速多功能粉碎机,永康市速锋工贸有限公司;FreeZone 4.5L真空冷冻干燥机,美国Labconco公司;Spark 10M酶联免疫分析仪,瑞士Tecan公司。
1.2 方法
1.2.1 澳洲坚果青皮总酚提取方法 准确称取一定量澳洲坚果青皮样品于100 mL离心管,按实验设计的料液比加入乙醇水溶液,并在一定超声温度、超声时间和超声功率条件下超声辅助提取总酚。提取结束后,在6000 r/min转速下离心10 min,取上清液保存于4 ℃冰箱,测定总酚提取量。
1.2.2 澳洲坚果青皮总酚提取量的测定 澳洲坚果青皮提取液经稀释后取0.2 mL于10 mL离心管,然后依次加入2.8 mL蒸馏水、1 mL 10%福林酚试剂和1 mL 10% Na2CO3溶液,摇匀后避光反应45 min,于765 nm处测吸光值,进行3次重复。以没食子酸为标准物质,制作标准曲线:Y= 0.055X+0.012,R2=0.998。其中,Y为吸光值;X为没食子酸浓度,mg/L。然后通过吸光值和标准曲线计算总酚提取量。
1.2.3 单因素实验设计 (1)乙醇浓度对澳洲坚果青皮总酚提取量的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,在料液比为1∶40 g/mL、超声温度为30 ℃、超声功率为300 W的条件下,乙醇浓度分别为10%、20%、30%、40%、50%进行超声辅助提取12 min,提取结束后操作同1.2.1。
(2)料液比对澳洲坚果青皮总酚提取量的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,在乙醇浓度为30%、超声温度为30 ℃、超声功率为300 W的条件下,料液比分别为1∶40、1∶50、1∶60、1∶70、1∶80 g/mL进行超声辅助提取12 min,提取结束后操作同1.2.1。
(3)超声温度对澳洲坚果青皮总酚提取量的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,在乙醇浓度为30%、料液比为1∶60 g/mL、超声功率为300 W条件下,超声温度分别为15、30、45、60、75 ℃进行超声辅助提取12 min,提取结束后操作同1.2.1。
(4)超声时间对澳洲坚果青皮总酚提取量的影响。准确称取1.00 g澳洲堅果青皮样品于100 mL离心管,在乙醇浓度为30%、料液比为1∶60 g/mL、超声功率为300 W、超声温度为60 ℃条件下,分别超声辅助提取6、12、18、24、30 min,提取结束后操作同1.2.1。
(5)超声功率对澳洲坚果青皮总酚提取量的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,在乙醇浓度为30%,料液比为1∶60 g/mL,超声温度为60 ℃,超声功率分别为250、300、350、400、450 W条件下超声辅助提取18 min,提取结束后操作同1.2.1。
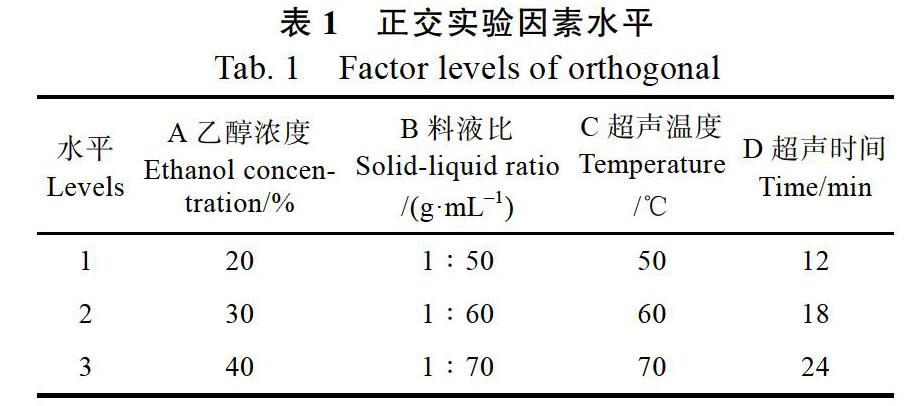
1.2.4 正交实验设计 在1.2.3单因素实验基础上进行L9(34)正交实验,因素水平见表1。
1.2.5 澳洲坚果青皮总酚上样液的制备 按1.2.4优化所得条件对澳洲坚果青皮总酚进行提取,提取液经抽滤后进行负压浓缩、离心,得澳洲坚果青皮总酚上样液,保存于4 ℃冰箱备用。
1.2.6 D101大孔树脂纯化澳洲坚果青皮总酚方法 (1)D101大孔树脂的预处理。将D101大孔树脂用无水乙醇浸泡24 h,并用无水乙醇洗涤树脂至加入蒸馏水无浑浊出现,再用蒸馏水将D101大孔树脂洗至无醇味,保存备用。
(2)静态吸附与解吸实验设计。静态吸附动力学实验:准确称取预处理后的D101大孔树脂3.00 g于100 mL锥形瓶,并加入30 mL澳洲坚果青皮总酚上样液,然后置于温度为30 ℃的摇床中,在转速为200 r/min条件下吸附6 h,每隔0.5 h取样,测定总酚含量,按照公式计算吸附率,并绘制静态吸附动力学曲线。
吸附率=[(M0?M1)/M0]×100%
式中,M0为吸附前澳洲坚果青皮上样液所含总酚质量,mg;M1为吸附后澳洲坚果青皮上样液所含总酚质量,mg。
静态解吸实验:分别准确称取10份3.00 g预处理后的D101大孔树脂于100 mL锥形瓶,加入30 mL澳洲坚果青皮总酚上样液,静态吸附3.2 h。吸附结束后抽滤,然后用10 mL蒸馏水对大孔树脂进行淋洗,并再次抽滤。随后將抽滤后的大孔树脂置于100 mL锥形瓶,分别加入40 mL浓度为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的乙醇水溶液,于温度为30 ℃、转速为200 r/min的摇床中解吸3.2 h,测定解吸液总酚浓度,计算解吸率。
解吸率=[(M0?M1)/M0]100%
式中,M0为大孔树脂吸附的澳洲坚果青皮总酚质量,mg;M1为解吸液中澳洲坚果青皮总酚质量,mg。
(3)动态吸附与解吸实验设计。①动态吸附实验。上样液总酚浓度对澳洲坚果青皮总酚动态吸附的影响:准确称取15.00 g预处理后的D101大孔树脂,湿法装入Ф 20 mm × 35 mm的层析柱中(柱床体积BV为12 mL)。将1.2.4制备的澳洲坚果青皮总酚上样液分别稀释至总酚浓度为1、2、3、4 mg/mL,以2 BV/h的上样速度进行上样,以3 mL为1个单位收集流出液,测定流出液总酚浓度,确定达到泄漏点(流出液中总酚浓度为上样液总酚浓度的1/10)时的上样液体积。
上样速度对澳洲坚果青皮总酚动态吸附的影响:准确称取15.00 g预处理后的D101大孔树脂,湿法装入Ф 20 mm × 35 mm的层析柱中。总酚浓度为2 mg/mL的澳洲坚果青皮总酚上样液,分别以2、3、4 BV/h的上样速度进行上样,10 mL收集一管,测定流出液总酚浓度,确定达到泄漏点(流出液中总酚浓度为上样液总酚浓度的1/10)时的上样液体积。
②动态解吸实验。准确称取15.00 g预处理后的D101大孔树脂,湿法装入Ф 20 mm×35 mm的层析柱中。总酚浓度为2 mg/mL的澳洲坚果青皮上样液,以2 BV/h的上样速度上样11.5 BV,然后用蒸馏水冲至流出液基本无颜色变化。再依次用6 BV浓度为10%、20%、30%、40%的乙醇溶液以3 BV/h的洗脱速度进行梯度洗脱,以3 mL为1个单位分别收集各浓度乙醇溶液洗脱液,测定总酚浓度,计算解吸率。
解吸率=[M2/(M0-M1)]100%
式中,M0为澳洲坚果青皮总酚上样液所含总酚质量,mg;M1为蒸馏水冲洗时流出液中总酚质量,mg;M2为一定浓度乙醇溶液解吸时流出液中总酚质量,mg。
1.2.7 纯化后澳洲坚果青皮总酚纯度的测定 按1.2.4优化所得条件对澳洲坚果青皮总酚进行纯化,分别收集各流出液组分,负压浓缩后进行冷冻干燥,得到澳洲坚果青皮总酚纯化样品,测定其总酚含量,计算纯度。
1.3 数据分析
采用SPSS 17.0软件进行数据处理与分析,采用Origin 8软件作图。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 乙醇浓度对总酚提取量的影响 由图1可知,超声辅助提取澳洲坚果青皮总酚的提取量随乙醇浓度的增加呈先增加后降低的趋势。其中,当乙醇浓度为10%~30%时,总酚提取量随乙醇浓度增加而增加;当乙醇浓度高于30%时,总酚提取量随乙醇浓度增加而降低;当乙醇浓度为30%时,总酚提取量最高,为1106.90 mg/100 g。当乙醇浓度较低时,随乙醇浓度增加,提取溶剂极性趋近于澳洲坚果青皮总酚极性,故提取效率提高。当乙醇浓度过高时,一方面增加了醇溶性杂质的扩散,其可与酚类物质竞争与乙醇-水的结合,导致提取效率降低[11];另一方面可促使蛋白质变性,进而影响与蛋白相结合的酚类物质的溶出,从而提取效率偏低[12]。综合考虑,乙醇浓度宜为30%。
2.1.2 料液比对总酚提取量的影响 由图2可知,料液比对超声辅助提取澳洲坚果青皮总酚的影响趋势与乙醇浓度相同,当料液比为1∶70 g/mL时,总酚提取量最高,为1410.06 mg/100 g。当料液比较小时,总酚提取量较少,这可能是因为提取溶剂与物料之间的浓度差较小,导致目标物质向提取溶剂扩散的传质推动力较小,因而目标物质溶出较少[13]。当料液比较大时,可能因为多糖等杂质的溶出,在一定程度上影响了对目标物质的溶解,故目标物质溶出反而减少[14]。该结果与Rehebati等[15]的研究结果一致。由于增加料液比会增加溶剂的使用量,且当料液比为1∶60 g/mL时,总酚提取量与料液比为1∶70 g/mL时无显著差异,综合考虑,料液比宜为1∶60 g/mL。
2.1.3 超声温度对总酚提取量的影响 由图3可知,当超声温度在10~60 ℃范围时,澳洲坚果青皮总酚提取量随超声温度的升高而快速增加。这主要的原因是:(1)随温度升高,溶剂对目标物质的溶解度增加[16];(2)提取体系的粘度随温度升高而降低,传质增加,因而提取效率提高[17]。当超声温度高于60 ℃时,总酚提取量趋于平缓,并略有下降,一方面可能是由温度升高导致的提取体系不稳定所致[18],另一方面可能是温度升高对总酚氧化起到了促进作用。本文研究结果与Zhou等[19]的研究结果一致。综合考虑,超声温度宜为60 ℃。
2.1.4 超声时间对总酚提取量的影响 由图4可知,澳洲坚果青皮总酚提取量随超声时间的增加而增加,其中,总酚提取量在初始阶段快速增加,随时间的增加,总酚提取量增加缓慢。这可能是因为,超声时间延长,超声的空化作用促使物料细胞破裂,释放目标物质,同时也会增加溶剂与物料之间的传质,从而提取量增加[20]。此外,陈晨等[21]研究了超声辅助提取香蕉皮多酚,结果显示,超声时间超过40 min后多酚提取率下降,这可能是因为长时间超声对多酚物质产生了破坏。结合差异显著性分析结果,超声时间超过18 min后,总酚提取量无显著性增加,因此,超声时间宜为18 min。
2.1.5 超声功率对总酚提取量的影响 超声功率是影响超声辅助提取总酚的重要因素之一,其影响主要有2个方面[22-24]:一是随超声功率增大,空化作用增强,物料细胞破坏程度增加,促进目标物质释放及其与溶剂之间的传质,提取效率增加;二是随着超声功率增大,溶剂的流动性增加,因而降低了物料在超声场中的停留时间,同时温度升高可能会导致酚类物质被破坏,对酚类物质提取产生不利影响。由于设备条件所限,本研究中超声功率设定范围为250~450 W,且由图5可知,随超声功率的增大,总酚提取量缓慢增加,但无显著性差异。由于超声功率增大,能耗会随之增加,因此,超声功率宜为250 W。
2.2 超声辅助提取澳洲坚果青皮总酚正交实验结果与分析
由表2极差分析结果可知,超声辅助提取澳洲坚果青皮总酚的影响顺序为:超声时间(D)>超声温度(C)>乙醇浓度(A)>料液比(B)。由表3方差分析结果可知,A对澳洲坚果青皮总酚提取量的影响显著(P<0.05),C、D对澳洲坚果青皮总酚提取量的影响极显著(P<0.01)。由表2可知,超声辅助提取澳洲坚果青皮总酚最优工艺条件为A2B2C3D3,但由于B对总酚提取量的影响不显著,故调整工艺条件为A2B1C3D3,即乙醇浓度30%、料液比1∶50 g/mL、超声温度70 ℃、超声时间24 min。在A2B1C3D3条件下进行验证实验,总酚提取量为(1836.2132.51)mg/100 g。因此,综合考虑,超声辅助提取澳洲坚果青皮总酚的最优工艺条件为A2B1C3D3。
2.3 D101大孔树脂纯化澳洲坚果青皮总酚
2.3.1 D101大孔树脂对澳洲坚果青皮总酚的静态吸附与解吸 (1)D101大孔树脂静态吸附动力学曲线。由图6可知,在0.5~6 h范围内,D101大孔树脂对澳洲坚果青皮总酚的吸附率随时间增加而增加,且在吸附起始阶段,吸附率增加较快;当吸附时间超过4 h后,吸附率趋于平缓,D101大孔树脂吸附基本饱和。同时,通过对D101大孔树脂静态吸附动力学曲线拟合,当吸附率达到80%时,吸附时间为3.2 h。因此,综合考虑,静态吸附时间宜为3.2 h。
(2)乙醇浓度对静态解吸的影响。由图7可知,当乙醇浓度从10%增加到40%,解吸率从36.99%提高到89.85%;当乙醇浓度大于40%时,解吸率基本无变化。这主要是由乙醇浓度改变影响天然酚类化合物芳香核与树脂芳香中心之间的相互作用所致[25]。此外,还有可能与上样液是由30%乙醇溶液提取、浓缩所得,根据相似相容原理,其更易溶解于30%~40%乙醇溶液。但当乙醇浓度大于40%时,一方面会增加乙醇用量,另一方面会增加色素等杂质的解吸,综合考虑,静态解吸时乙醇浓度宜为40%。
2.3.2 D101大孔树脂对澳洲坚果青皮总酚的动态吸附与解吸 (1)上样液总酚浓度对D101大孔树脂动态吸附的影响。由图8可知,分别用总酚浓度为1、2、3、4 mg/mL的澳洲坚果青皮总酚上样液进行上样,当总酚开始泄露时,上样体积分别为2.25、1.75、1.25、1.25 BV;当达到泄漏点时,上样体积分别为12.75、11.50、9.25、7.25 BV,上样总酚质量分别为153、276、333、348 mg。上样液浓度过大,会导致杂质与大孔树脂的竞争性吸附增加;而上样液总酚浓度过低时,会增加上样体积和上样时间。因此,综合考虑,上样液总酚浓度宜为2 mg/mL。
(2)上样速度对D101大孔树脂动态吸附的影响。由图9可知,总酚浓度为2 mg/mL的澳洲坚果青皮总酚上样液,分别以2、3、4 BV/h上样,当总酚开始泄漏时,上样体积分别为1.75、1.75、1.5 BV;当达到泄漏点时,上样体积分别为11.5、8、7.5 BV,此时总酚上样质量分别为276、192、180 mg。从数据分析可知,上样速度越快,达到泄漏点时上样体积越小,总酚上样质量也随之越小,不利于大孔树脂吸附,从而降低了大孔树脂吸附效能。这可能是因为,上样速度过快,大孔树脂吸附酚类物质不完全所致。因此,综合考虑,上样速度宜为2 BV/h。
(3)乙醇浓度对D101大孔树脂动态解吸的影响。由图10可知,依次用10%、20%、30%、40%的乙醇溶液进行梯度洗脱时,收集的各管流出液中的总酚浓度类似正态分布,且存在拖尾现象,即在此浓度下,大孔树脂吸附的总酚基本洗脱完全。根据结果计算,用10%、20%、30%、40%乙醇溶液进行梯度洗脱时,各流出液中总酚质量分别为56.37、79.16、48.97、14.82 mg,而测得的蒸馏水冲洗时流出液中的总酚质量为31.78 mg,故解吸率分别为24.87%、34.93%、21.61%、6.54%。经纯度测定,各组分纯度依次为57.64%、72.97%、65.54%、36.14%,且与澳洲坚果青皮总酚样品相比,纯度分别提高了3.27、4.41、3.85、1.68倍。综合分析,动态解吸时,可依次用10%、20%、30%乙醇溶液进行梯度洗脱,总解吸率为81.41%,且各组分纯度较高,可为后续进一步分离单体奠定基础。
3 讨论
澳洲坚果青皮是澳洲坚果加工过程中的副产物,前期研究结果表明澳洲坚果青皮中含有丰富的总酚、总黄酮等生物活性物质,且具有较强的DPPH自由基、ABTS自由基清除能力以及总抗氧化还原能力。为高效利用与开发澳洲坚果青皮资源,本研究采用L9(34)正交实验对超声辅助提取澳洲坚果青皮总酚工艺进行优化,并采用D101大孔树脂对其进行初步纯化。
由正交实验极差分析和方差分析的结果可知,超声辅助提取澳洲坚果青皮总酚的影响依次為超声时间(D)>超声温度(C)>乙醇浓度(A)>料液比(B)。其中,素A对澳洲坚果青皮总酚提取量的影响显著(P<0.05),C、D对澳洲坚果青皮总酚提取量的影响极显著(P<0.01)。结合极差分析和方差分析结果,得到澳洲坚果青皮提取最优工艺条件为A2B1C3D3,即乙醇浓度为30%、料液比为1∶50 g/mL、超声温度为70 ℃、超声时间为24 min,在此条件下,总酚提取量为(1836.2132.51)mg/100 g。
通過D101大孔树脂静态及动态吸附、解吸实验,优化澳洲坚果青皮总酚纯化工艺。静态吸附动力学实验结果表明,静态吸附3.2 h时,吸附率可达80%;同时,静态解吸实验结果表明,宜用40%乙醇溶液进行解吸,解吸率可达89.85%。动态吸附、解吸实验结果表明:(1)动态吸附时,上样液总酚浓度宜为2 mg/mL,上样速度宜为2 BV/h,此时,上样体积为11.50 BV,总酚上样质量为279 mg;(2)动态解吸时,依次用6 BV的10%、20%、30%乙醇溶液以3 BV/h洗脱速度进行梯度洗脱,总解吸率可达81.41%,且各组分纯度分别为57.64%、72.97%、65.54%。纯化所得各组分纯度较高,为后续研究奠定了基础。
本研究不仅为澳洲坚果青皮的高值化、资源化综合利用提拱了数据支撑,还为澳洲坚果加工产业处理青皮等加工副产物提供了借鉴,同时也为芒果、香蕉、菠萝等热带水果加工副产物的综合利用提供了一种思路。此外,对澳洲坚果青皮总酚进行纯化,为多酚组成的鉴定奠定了基础,为开展抗衰老、抗肿瘤等动物学实验以及体内抗氧化实验等提供了材料。此外,有研究[26]表明植物的总酚提取物可与Ag+等络合制备纳米材料,且与提取物相比,抗氧化能力和抑菌能力显著加强,但提取物成分复杂,纯化和组分鉴定将为其增强机制研究奠定重要的基础。
参考文献
[1] Mast A R, Willis C L, Jones E H, et al. A smaller Macadamia from a more vagile tribe: inference of phylogenetic relationships, divergence times, and diaspore evolution in Macadamia and relatives (tribe Macadamieae; Proteaceae)[J]. American Journal of Botany, 2008, 95(7): 843-870.
[2] Lara D, Vilcacundo E, Carrillo C, et al. Obtention of protein concentrate and polyphenols from macadamia (Macadamia integrifolia) with aqueous extraction method[J]. Asian Journal of Pharmaceutical and Clinical Research, 2017, 10(2): 138-42.
[3] 贺熙勇, 陶 亮, 柳 觐, 等. 国内外澳洲坚果产业发展概况及趋势[J]. 中国热带农业, 2017(1): 4-11, 18.
[4] 贺熙勇, 陶 亮, 柳 觐, 等. 我国澳洲坚果产业概况及发展趋势[J]. 热带农业科技, 2015, 38(3): 12-16, 19.
[5] 艾静汶, 刘功德, 黄欣欣, 等. 澳洲坚果产业发展现状与趋势[J]. 食品工业, 2018, 39(11): 282-285.
[6] 张 明, 杜丽清, 马飞跃, 等. 超声辅助提取澳洲坚果青皮总黄酮工艺优化及抗氧化性能研究[J]. 热带作物学报, 2020, 41(5): 1022-1029.
[7] 张 明, 帅希祥, 杜丽清, 等. 澳洲坚果青皮多酚提取工艺优化及其抗氧化活性[J]. 食品工业科技, 2017, 38(22): 195-199.
[8] Deng J L, Xu Z, Xiang C R, et al. Comparative evaluation of maceration and ultrasonic-assisted extraction of phenolic compounds from fresh olives[J]. Ultrasonics Sonochemistry, 2017, 37: 328-334.
[9] Huang W, Xue A, Niu H, et al. Optimised ultrasonic-assisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity in multi-test systems in vitro[J]. Food Chemistry, 2009,114(3): 1147-1154.
[10] Chemat F, Khan M K. Applications of ultrasound in food technology: processing, preservation and extraction[J]. Ultrasonic Sonochemistry, 2011, 18: 813-835.
[11] 耿中华, 秦卫东, 马利华, 等. 梨皮多酚的提取工艺优化的研究[J]. 食品工业科技, 2009, 30(12): 233-234, 238.
[12] Yang L, Jiang J G, Li W F, et al. Optimum extraction process of polyphenols from the bark of Phyllanthus emblica L. based on the response surface methodology[J]. Journal of Separation Science, 2009, 32: 1437-1444.
[13] 贺银菊, 张旋俊, 杨再波, 等. 响应面优化艾叶多酚提取工艺及抗氧化活性研究[J]. 食品科技, 2020, 45(6): 278-284.
[14] Tian S Y, Hao C C, Xu G K, et al. Optimization conditions for extracting polysaccharide from Angelica sinensis and its antioxidant activities[J]. Journal of Food and Drug Analysis, 2017, 25(4): 766-775.
[15] Rehebati N, Aytursun A, Paiheerding M, et al. Optimization of ultrasonic-assisted extraction, characterization and biological activities of polysaccharides from Orchis chusua D. Don (Salep)[J]. International Journal of Biological Macromolecules, 2019, 141: 431-443.
[16] Guo L, Zhu W C, Liu Y T, et al. Response surface optimized extraction of flavonoids from mimenghua and its antioxidant activities in vitro[J]. Food Science and Biotechnolofy, 2013, 22(5): 1-8.
[17] Dai Y T, Spronsen J V, Witkamp G J, et al. Natural deep eutectic solvents as new potential media for green techno?-logy[J]. Analytica Chimica Acta, 2013, 766: 61-68.
[18] Dai Y T, Verpoorte R, Choi Y H. Natural deep eutectic sol-vents providing enhanced stability of natural colorants from safflower (Carthamus tinctorius)[J]. Food Chemistry, 2014, 159: 116-121.
[19] Zhou P F, Wang X P, Liu P Z, et al. Enhanced phenolic compounds extraction from Morus alba L. leaves by deep eutectic solvents combined with ultrasonic-assisted extrac-tion[J]. Industrial Crops and Products, 2018, 120: 147-154.
[20] Sharmila, G, Nikitha, V S, Ilaiyarasi S, et al. Ultrasound assisted extraction of total phenolics from cassia auriculata leaves and evaluation of its antioxidant activities[J]. Indust?-rial Crops and Products, 2016, 84: 13-21.
[21] 陳 晨, 胡文忠, 田沛源, 等. 超声辅助提取香蕉皮多酚
工艺优化及其抗氧化活性的分析[J]. 食品科学, 2014, 35(2): 12-17.
[22] Komal V M, Virendra K R. Ultrasonic assisted aqueous extraction of catechin and gallic acid from Syzygium cumini seed kernel and evaluation of total phenolic, flavonoid contents and antioxidant activity[J]. Chemical Engineering and Processing - Process Intensification, 2020, 149: 107841.
[23] 伍 璇, 张 媛, 刘玉德, 等. 各因素对超声辅助提取茶多酚的影响综述[J]. 食品工业科技, 2013, 34(24): 401-403.
[24] 林 硕. 超声-微波协同逆流提取的工艺及设备研究[D]. 合肥: 安徽农业大学, 2009.
[25] Balarabe B I, Hauwa L Y, Pu Y F, et al. Ultrasound-assisted adsorption/desorption for the enrichment and purification of flavonoids from baobab (Adansonia digitata) fruit pulp[J]. Ultrasonics Sonochemistry, 2020, 65: 104980.
[26] Kolia T, Ramesh P S, Geetha D. Biosynthesis of AgNPs using Carica papaya peel extract and evaluation of its antioxidant and antimicrobial activities[J]. Ecotoxicology and Environmental Safety, 2016,134: 467-473.
责任编辑:崔丽虹

