原发性IgA肾病合并高尿酸血症的临床病理特点及与不良肾脏结局的相关分析
詹元英,梁辑,郑颖来
(海口市第三人民医院肾内科,海南 海口 571100)
原发性IgA肾病占我国原发性肾小球疾病的30%~45%,由IgA为主的免疫复合物沉积于肾小球系膜区所致,其中30%~40%患者在确诊10~20年内进展为慢性肾衰竭期[1-2]。高尿酸血症是原发性IgA肾病的常见合并症,与血尿酸水平正常的患者相比,合并高尿酸血症患者的临床及病理特点可能存在一定差异。同时,临床研究发现,控制尿酸水平治疗有助于保护肾功能,减轻病理损伤。有报道[3-4]指出,血尿酸水平与原发性IgA肾病疾病进展有着密切联系,高尿酸血症与患者不良肾脏结局的关系也因此成为研究热点。本研究旨在探讨原发性IgA肾病合并高尿酸血症的临床病理特点,分析其与不良肾脏结局的相关性。
1 资料与方法
1.1 一般资料
选取2017年2月至2019年9月海口市第三人民医院诊治的110例原发性IgA肾病患者为研究对象,根据血尿酸(SUA)水平不同分为研究组(合并高尿酸血症,n=42)和对照组(SUA水平正常,n=68)。入选标准:(1)入院时经肾活检病理确诊,且估算肾小球滤过率(eGFR)>15 mL·min-1·(1.73 m2)-1;(2)临床及肾脏病理资料完整;(3)获得随访≥12个月。排除标准:(1)相关资料欠缺;(2)继发性IgA肾病,或合并其他类型肾小球疾病;(3)合并严重感染、创伤、系统性红斑狼疮等疾病。
1.2 方法
1.2.1 资料收集 (1)临床资料:包括患者的性别、年龄、体质指数(BMI)、血尿阳性(+)、eGFR、尿素氮、24 h尿蛋白、高血压、血肌酐(Scr)、胱抑素C(Cys-C)、三酰甘油(TG)、总胆固醇(TC)。(2)肾脏病理资料:均由资深肾内科医师在B超引导下完成穿刺活检术,肾脏病理标本按照牛津病理分型标准[5]描述:系膜细胞增生(M1>0.5分,M0≤0.5分);节段性肾小球硬化 (S1有,S0无);毛细血管内增生(E1有,E0无);肾小管萎缩或间质纤维化比例(T0≤25%、T1 26%~50%、T2>50%)。
1.2.2 高尿酸血症诊断标准及不良肾脏结局的判定 高尿酸血症诊断标准:男性SUA>420 μmol/L,女性SUA>360 μmol/L。以肾脏穿刺活检术当天为随访起点,1次/ 3个月门诊随访,随访时间≥12个月。若Scr较基线值倍增,或eGFR较基线值下降≥50%,或进展至终末期肾脏病(ESRD),判定为不良肾脏结局。
1.3 观察指标
(1)患者临床资料;(2)患者肾脏病理特征;(3)患者病理特征与不良肾脏结局的相关性。
1.4 统计学分析
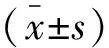
2 结果
2.1 两组患者临床资料比较
两组患者年龄、BMI、血尿(+)、TC水平比较,差异无统计学意义(P>0.05);研究组男性占比、高血压发病率、尿素氮、24 h尿蛋白、Scr、Cys-C、TG水平高于对照组(P<0.05),eGFR低于对照组(P<0.05)。见表1。
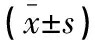
表1 两组患者临床资料比较
2.2 两组患者肾脏病理特征比较
两组患者系膜细胞增生、节段性肾小球硬化及毛细血管内增生比较,差异无统计学意义(P>0.05);研究组肾小管萎缩或间质纤维化的病变程度高于对照组(P<0.05)。见表2。
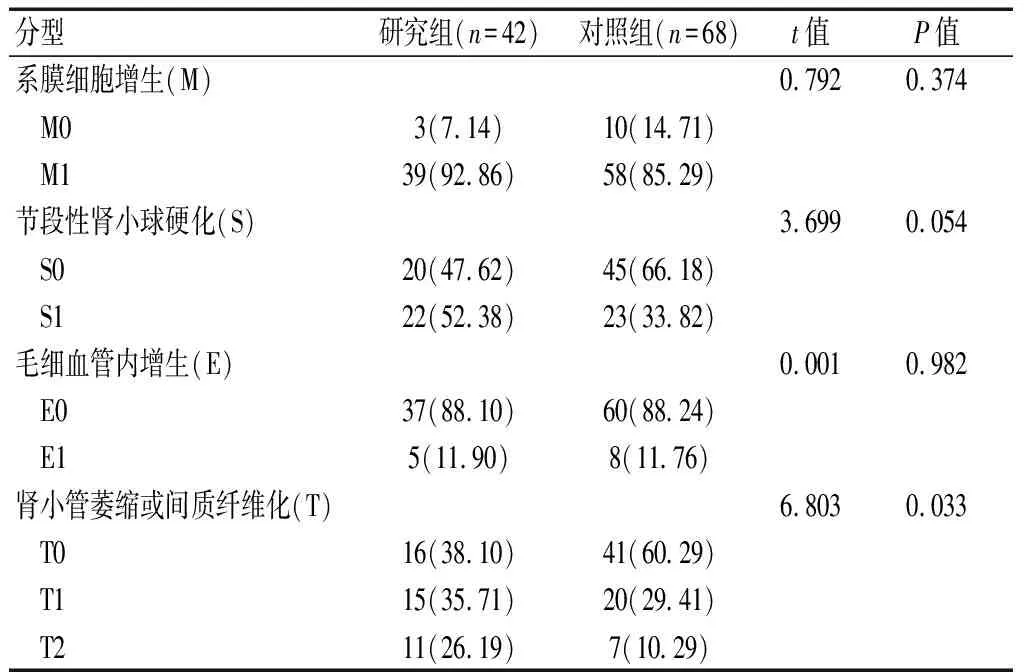
表2 两组肾脏病理特征比较[n(%)]
2.3 患者病理特征与不良肾脏结局的相关性
两组患者随访时间分别为12~19个月、12~21个月,中位随访时间均为15个月。研究组有10例出现不良肾脏结局,发生率23.81%,其中7例Scr倍增,3例ESRD;对照组有6例出现不良肾脏结局,发生率8.82%,其中5例Scr倍增,1例ESRD。研究组不良肾脏结局发生率高于对照组,差异有统计学意义(χ2=4.691,P<0.05)。将“高尿酸血症”作为分类自变量纳入Cox回归方程,赋值:高尿酸血症=1,血尿酸正常=0,校正性别、年龄、BMI、高血压、尿素氮、24 h尿蛋白、肾脏病理分型等因素后,多因素Cox分析显示,高尿酸血症是原发性IgA肾病患者不良肾脏结局的独立危险因素(R=2.750,P<0.05)。见表3。

表3 患者病理特征与不良肾脏结局的相关性
3 讨论
原发性IgA肾病是ESRD的主要病因,早诊断、准确评估病情和早治疗,对延缓IgA肾病进展、减少不良肾脏结局发生尤为重要。原发性IgA肾病进展至ESRD的影响因素报道较多,其中性别、大量蛋白尿、诊断时肾功能不全、合并高血压、脂质代谢紊乱、肾脏病理分型等危险因素已得到医学广泛认可[6]。近些年,高尿酸血症作为原发性IgA肾病疾病进展的新型危险因素引起学者关注,临床发现原发性IgA肾病患者的高尿酸血症发生率明显高于自然人群。相关报道[7]发现,SUA水平与原发性IgA肾病患者24 h尿蛋白、Scr、Cys-C、血压有紧密相关性,与SUA水平正常的IgA肾病患者比较,合并高尿酸血症的IgA肾病患者发生不良肾脏结局的风险增加2~3倍。种种迹象表明,高尿酸血症在原发性IgA肾病疾病进展中扮演了重要角色,临床上对合并高尿酸血症的原发性IgA肾病患者需引起高度重视,故本文对此展开临床病理特点和不良肾脏结局分析。
本研究显示,研究组男性占比高于对照组(P<0.05),表明原发性IgA肾病合并高尿酸血症的现象在男性群体更为突出,原因可能与男性雄激素诱导肾脏尿酸吸收转运、提高SUA浓度有关[8]。研究组高血压发生率高于对照组(P<0.05),目前认为SUA可激活肾素-血管紧张素系统(RAS),进行性引起肾小球肥厚改变和血管损害,肾脏自我调节功能下降,血压升高。此外,SUA通过诱导肾远端上皮性钠通道,干扰损害肾脏排钠功能,导致钠水潴留,心脏收缩加强,心输出量增加,导致血压升高。研究组尿素氮、24 h尿蛋白、Scr、Cys-C、TG水平均高于对照组(P<0.05),eGFR低于对照组(P<0.05),表明原发性IgA肾病合并高尿酸血症患者的肾功能受损和血脂异常程度更加严重,原因是SUA水平升高与患者肾功能减退有直接关联,eGFR下降是其主要表现,SUA水平升高会降低酶活性,上调人肝细胞内的果糖激酶,刺激肝细胞内TG堆积。
病理特征分析发现,研究组以MM1S1E0T0多见,对照组以M1S0E0T0多见,研究组节段性肾小管萎缩或间质纤维化的病变程度高于对照组(P<0.05),表明合并高尿酸血症患者的肾脏病理损伤更严重,原因可能是随着SUA水平升高,会刺激血管平滑肌细胞增加,血管内皮功能发生障碍,同时通过激活RAS、促进氧自由基和炎症介质释放等途径,引起肾小球小动脉变粗、硬化,肾小球缺血缺氧,肾小管间质损伤,最终诱发肾小管萎缩,或肾间质炎症细胞浸润和纤维化。有报道[9]指出,SUA水平可作为肾小管间质损伤的评估指标。本研究显示,研究组不良肾脏结局发生率高于对照组(P<0.05),多因素Cox分析发现,高尿酸血症是原发性IgA肾病患者发生不良肾脏结局的独立危险因素(P<0.05),印证了高尿酸血症与原发性IgA肾病预后的紧密关系。有报道[10]还发现,原发性IgA肾病合并高尿酸血症患者接受降尿酸治疗5年后eGFR无明显下降,而未接受降尿酸治疗者eGFR下降明显,表明积极控制SUA水平,有助于减少肾脏损伤和保护肾功能。
综上,原发性IgA肾病合并高尿酸血症患者的临床表现和肾脏病理损伤更为明显,需引起临床重视,高尿酸血症是不良肾脏结局发生的危险因素,临床治疗中应积极控制SUA水平,减缓疾病进展。本研究的不足在于为单中心回顾性队列研究,且样本量偏少,可能对研究造成一定干扰和偏倚。

