慢性阻塞性肺疾病急性加重患者血NLR、CRP、EOS水平与病情严重程度的相关性
罗立,熊沿,聂晓红
(成都医学院第二附属医院·核工业四一六医院呼吸与危重症科,四川 成都 610051)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一类呼吸系统常见慢性疾病,发病率较高,发病机制为气道与肺部对有毒气体及颗粒表现出异常的炎症反应,继发慢性气道阻塞[1]。与稳定期COPD患者相比,慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)患者支气黏膜炎症反应更严重,并伴有支气管黏膜增厚、分泌物增多等症状;再加上支气管病变导致的狭窄与痉挛,易造成机体通气功能迅速下降,发生二氧化碳潴留,导致缺氧,进一步诱发肺性脑病,导致患者死亡[2]。COPD作为一种肺部慢性炎症疾病,多项生物标志物水平均与AECOPD 发生发展密切相关。C反应蛋白(C-reactive protein,CRP)是机体炎症刺激下,肝脏合成分泌的急性时相蛋白,是炎症反应的标志物。中性粒细胞与淋巴细胞计数比值(neutrophil lymphocyte ratio,NLR)是血中性粒细胞与血淋巴细胞计数水平的比值,被广泛应用于心血管疾病、肺炎等疾病严重程度及预后评估。嗜酸性粒细胞(eosinophil,EOS)隶属于白细胞范畴,与其他免疫细胞共同调节免疫系统,是嗜酸性气道炎症敏感的生物学标志物[3]。本研究拟分析AECOPD患者血清NLR、CRP、EOS水平与病情严重程度的相关性,探讨其对患者病情评估及预后的应用价值,旨在为该病的早期治疗提供依据。
1 资料与方法
1.1 一般资料
选取成都医学院第二附属医院2017年9月至2018年11月130例AECOPD患者作为研究组对象。其中,男性69例,女性61例;年龄46~79岁,平均(63.97±6.83)岁;COPD病程3~9年,平均(8.43±2.04)年。130例AECOPD患者,依照是否发生呼吸衰竭分为呼吸衰竭组(n=41)与未呼吸衰竭组(n=89);并参照《慢性阻塞性肺疾病诊治指南》分级标准,将患者疾病分为A级(n=25)、B级(n=33)、C级(n=32)、D级(n=40)。纳入标准:(1)符合慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识中AECOPD诊断标准[4];(2)临床表现为气促加重,伴喘息、胸闷、咳嗽加剧、呼吸困难、痰量增多且颜色和粘度异常;(3)患者意识清晰,无沟通障碍;(4)经医院伦理委员会批准,患者及家属知情同意。排除标准:(1)合并肿瘤疾病;(2)合并COPD之外的急慢性呼吸系统疾病,如:支气管哮喘、胸腔积液、肺间质纤维化等;(3)合并严重心、脑、肝、肾、血液系统疾病;(4)入组前两周内使用过激素类药物或自行口服抗生素等治疗;(5)合并自身免疫性疾病;(6)临床资料不全。
1.2 疾病严重程度分级
根据患者是否发生呼吸衰竭分为呼吸衰竭组与未呼吸衰竭组,呼吸衰竭诊断标准[5]:呼吸空气(海平面大气压、静息状态),动脉血气分析结果显示动脉血氧分压(partial pressure of oxygen,PaO2)水平低于60 mmHg,可伴或不伴有动脉二氧化碳分压(partial pressure of carbon dioxygen,PaCO2)高于50 mmHg。依据中华医学会《慢性阻塞性肺疾病诊治指南》综合评估分级标准[6]将AECOPD患者疾病严重程度分为四级:A级:风险低,临床症状少,肺功能GOLD 1或 GOLD 2和(或)每年0~1次急性加重,同时改良呼吸困难(modified medical research council,mMRC)评分为0~1级或COPD评估测试(COPD assessment test,CAT)分值<10;B级:风险低,症状较多,肺功能GOLD 1或 GOLD 2和(或)每年0~1次急性加重,同时mMRC≥2级或 CAT≥10;C级:风险高,症状较少,肺功能GOLD 3或 GOLD 4和(或)每年≥2次急性加重表现,同时mMRC为0~1级或CAT<10;D级:风险高,临床症状多,肺功能GOLD 3或 GOLD 4和(或)每年≥2次急性加重表现,同时mMRC≥2级或CAT≥10。
1.3 标本采集及检测
采集5 mL空腹肘静脉血,其中2 mL采用迈瑞 BC-5390CRP全自动血液细胞分析仪检测EOS%及中性粒细胞计数、淋巴细胞计数水平,计算NLR;另外3 mL在3 500 rpm下离心10 min,取血清,通过酶联免疫吸附法测定CRP水平。
1.4 统计学分析
2 结果
2.1 呼吸衰竭与未呼吸衰竭组外周血NLR、CRP、EOS水平比较
呼吸衰竭组外周血NLR、CRP水平高于未呼吸衰竭组,EOS水平低于未呼吸衰竭组(P<0.05)。见表1。
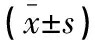
表1 呼吸衰竭与未呼吸衰竭组外周血NLR、CRP、EOS水平比较
2.2 外周血NLR、CRP、EOS水平评估AECOPD患者呼吸衰竭效能分析
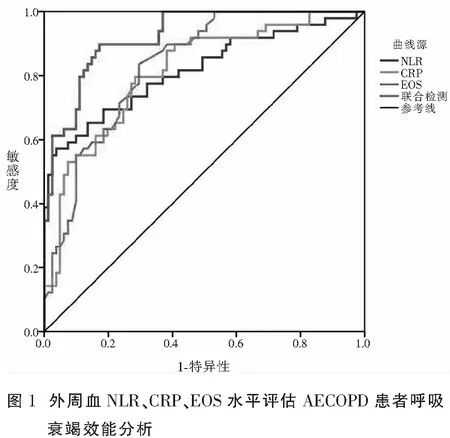
外周血NLR、CRP、EOS联合检测评估AECOPD患者呼吸衰竭情况ROC曲线下面积(area under cure,AUC)为0.923,高于单独NLR、CRP、EOS检测时的0.816、0.812、0.833(P<0.05)。见表2及图1。
表2 外周血NLR、CRP、EOS水平评估AECOPD患者呼吸衰竭效能分析
2.3 不同疾病分级患者外周血NLR、CRP、EOS水平比较
外周血NLR、CRP水平:A级
表3 不同疾病分级患者外周血NLR、CRP、EOS水平比较
2.4 外周血NLR、CRP、EOS水平与患者疾病分级的相关性分析
外周血NLR、CRP水平与患者疾病分级均呈正相关(r=0.703、0.755,P<0.05);外周血EOS水平与患者疾病分级呈现负相关(r=-0.707,P<0.05)。见表4及图2。
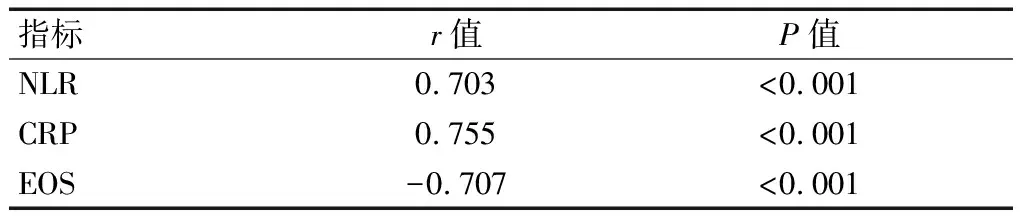
表4 外周血NLR、CRP、EOS水平与患者疾病分级的相关性分析
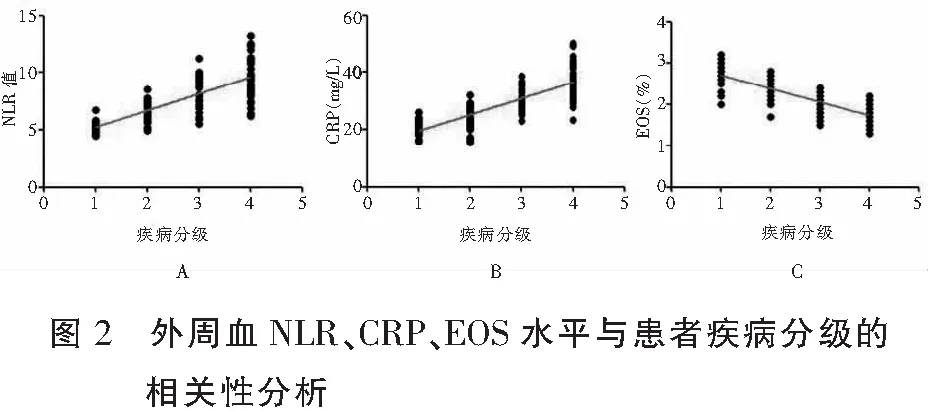
3 讨论
在我国40岁以上群体中,COPD患病率超过8.2%,且由于COPD而死亡的病例超过100万[7]。随着患者病情进一步发展,COPD导致的一系列并发症使得疾病不仅仅影响机体肺部,还使部分肺外器官受累。AECOPD是导致患者疾病进展加快和死亡的重要原因,因此临床上要求医务工作者及时、准确对患者病情程度和再发加重风险进行评估,从而合理指导临床治疗[8]。
一直以来,肺功能是COPD疾病诊断的“金标准”,对疾病诊断、病情评估、预后均有重要价值,然而在GOLD 2011指南[9]提出,单纯肺功能无法全面反映疾病严重程度。CRP 是机体炎症反应发生时,体液中快速生成的一种急性时相反应蛋白,具耐热和抗蛋白酶降解能力,通常情况下,在健康人血液中浓度较低,但当机体存在炎症或损伤时,CRP水平升高,同时不受免疫抑制剂、抗炎药物、激素等的影响,和白细胞、血沉检查相比,敏感性更高,病变消退时可迅速降低至正常水平。COPD患者表现为全身系统性炎症以及呼吸道炎症,CRP水平对反映下呼吸道感染程度具有重要价值。本研究中表明,外周血CRP水平与患者疾病分级呈正相关,与杜瑱男等[10]研究结果一致。当细胞因子呈现出较高水平时,使得气道黏液分泌过多,对气道产生阻塞,导致患者机体肺功能进一步降低,病情进一步加重。
NLR 是外周血中性粒细胞与淋巴细胞计数水平之间的比值,水平上升已成为炎症性疾病的重要标志,相对于单纯中性粒细胞升高在感染程度方面的敏感性更高[11]。Zuo等[12]研究表明,NLR水平不仅与COPD急性加重有关,还与疾病严重程度相关,具体表现为AECOPD患者NLR明显高于稳定期,且患者肺气肿程度以及mMRC评分均与NLR水平呈现正相关。本研究中,AECOPD患者外周血NLR水平与患者疾病分级呈正相关,且合并呼吸衰竭患者外周血NLR水平高于未合并呼吸衰竭患者,外周血NLR水平可作为AECOPD患者疾病严重程度的评估指标。AECOPD患者呼吸道T淋巴细胞过度凋亡,局部免疫防御下降可导致疾病进一步加重。
EOS存在于机体血液、组织液、分泌液中,与哮喘、过敏反应、寄生虫感染等密切相关,EOS参与Th2免疫应答,在细胞因子作用下,骨髓和血液中的 EOS募集到炎症部位,产生多种促炎因子和免疫调节因子[13]。GOLD指南[9]提出,血液EOS计数可作为 AECOPD疾病预测的生物标志物,指导 COPD患者稳定期糖皮质激素个体化治疗。Macdonald等[14]研究表明痰EOS浓度与COPD患者气道炎症有关,可用来预测患者病情,本研究鉴于COPD患者痰EOS检测方法中支气管肺泡灌洗为侵入性操作,诱导痰操作复杂,且有痰细胞容易退化而导致无法辨别,选择外周血EOS水平来评估其与COPD病情的关系,结果显示外周血EOS水平与患者疾病严重程度呈现负相关,与上述研究结果一致。AECOPD是由炎症细胞及炎症介质参与的反应,炎症细胞和炎性因子作用下可引起肺损伤,当肺损伤较为严重时,机体肾上腺分泌皮质激素的释放增多,骨髓EOS释放被抑制,外周血EOS水平降低。毛彦华等[15]研究显示外周血EOS水平≤2%组的患者炎症反应较重,合并呼吸衰竭的概率也更高,本研究分析EOS在合并与未合并呼吸衰竭AECOPD患者中的评估价值,结果显示其ROC曲线下面积为0.833,具有较高的评估效能。
综上所述,AECOPD患者血NLR、CRP水平随病情加重有逐渐增高的趋势,EOS水平随病情加重呈现降低趋势,与患者疾病严重程度相关,三项指标联合对于AECOPD呼吸衰竭情况的判断具有较高的鉴别效能。

