右美托咪定复合丙泊酚对颅脑动脉瘤介入手术患者术后神经损伤标志物的影响
李媛,郭悦平,周期,高振忠
(海南医学院第一附属医院,1.麻醉科;2.神经外科,海南 海口 570100)
颅脑动脉瘤以颅内动脉异常膨出或扩张为主要表现,不可自愈,是引发蛛网膜下腔出血的首位原因。随显微外科技术和栓塞材料的发展,血管内介入治疗因可极大的降低并发症、相关病死等发生风险,已成为临床首选治疗方案[1],但动脉瘤引起的蛛网膜下腔出血、颅内压升高、脑组织缺氧及水肿等不可避免的造成相关脑组织和神经损伤,术中麻醉、气管插管等操作也可刺激患者增加脑损害[2];另外,患者在术中的机体代偿能力下降,血流动力学受到抑制[3]。而患者术后神经功能恢复状况与预后直接相关,故在保证手术疗效的基础上尽可能减轻神经损伤十分必要[4]。右美托咪定是一种相对选择性α2-肾上腺素受体激动剂,临床常用作麻醉辅助药物,不仅具有良好的镇静镇痛效果,还因其镇静效果可逆,患者易被唤醒,利于医师对患者意识状态的评估[5]。另外,右美托咪定用于颅内肿瘤手术中对患者具一定脑保护作用[6]。基于此,本研究拟探究右美托咪定复合丙泊酚对颅脑动脉瘤介入手术患者术后神经损伤标志物的影响,为临床研究提供一定的参考。
1 资料与方法
1.1 一般资料
本研究符合《赫尔辛基宣言》。选取2018年1月至2020年6月于海南医学院第一附属医院行颅脑动脉瘤介入手术的患者为研究对象。研究获得医学伦理审核通过。纳入标准:(1)因动脉瘤破裂行颅脑动脉瘤介入术者;(2)年龄18~65岁;(3)美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级为Ⅱ~Ⅲ级;(4)Hunt-Hess分级为Ⅰ~Ⅲ级;(5)知情同意参与研究。排除标准:(1)对研究药物过敏或有神经阻滞禁忌症者;(2)合并精神疾病、糖尿病、恶性肿瘤者。共入组138例,按照干预因素不同分为对照组和观察组,每组各69例。两组一般资料比较,差异无统计学意义(P>0.05)。见表1。
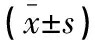
表1 两组一般资料比较
1.2 麻醉方法
两组患者术前均行常规禁饮禁食。入室后吸氧,检测血压(blood pressure,BP)、心率(heart rate,HR)、心电图(electrocardiogram,ECG)、脉搏血氧饱和度(oxygen saturation,SpO2)及脑电双频指数(bispectral index,BIS)等,建立静脉通路,输注聚明胶肽注射液(500 mL,3.2 g,武汉龙华生物制药有限公司)10 mL/kg。麻醉诱导前20 min:观察组静脉泵注盐酸右美托咪定注射液(2mL,0.2 mg,扬子江药业集团有限责任公司)1 μg/kg(20 mL生理盐水稀释);对照组予以等量生理盐水,泵注时间均为20 min。麻醉诱导:依次静脉注射丙泊酚注射液(20 mL,200 mg,费森尤斯卡比医药有限公司)1.5~2.5 mg/kg、枸橼酸舒芬太尼注射液(1 mL,50 μg,宜昌人福药业有限责任公司)0.5 μg/kg、罗库溴铵注射液(5.0 mL 50 mg,浙江仙居制药股份有限公司)0.9 mg/kg。行气管插管,机械通气,调节潮气量(Vt)为8~10 mL/kg,呼吸比(I:E)为1∶2,通气频率为10~14次/min,维持呼气末二氧化碳分压(partial pressure of carbon dioxide in end expiration,PETCO2)为35~40 mmHg。麻醉维持:静脉输注丙泊酚注射液4~12 mg·kg-1·h-1)。术中对两组麻醉深度进行调整,使BP、HR波动幅度低于基础水平的20%,BIS值稳定在40~50,可酌情加用罗库溴铵、舒芬太尼、阿托品、去甲肾上腺素等。术毕终止麻醉药物输注,观察患者意识、呼吸等情况,适时拔除气管导管,入神经科重症监护室(neonatal intensive care unit,NICU)。
1.3 观察指标
记录两组围术期一般情况(手术时长、麻醉苏醒时间、气管插管拔除时间)及麻醉诱导前20 min(T0)、麻醉诱导结束即刻(T1)、手术结束即刻(T2)、术后2 h(T3)、术后6 h(T4)、术后1 d(T5)、术后3 d(T6)时的血流动力学[HR、平均动脉压(mean arterial pressure,MAP)]、血清神经损伤标志物[神经元特异性烯醇化酶(neuron-specific enolase,NSE)、S-100β蛋白、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)]水平。
1.4 统计学分析
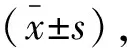
2 结果
2.1 两组手术一般情况比较
两组手术时长比较,差异无统计学意义(P>0.05)。观察组麻醉苏醒时间、气管插管拔除时间均较对照组更短(P<0.05)。见表2。
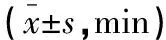
表2 两组手术一般情况比较
2.2 血流动力学
T0时刻,两组MAP、HR间比较,差异无统计学意义(P>0.05)。与对照组相比,观察组在T1~T5时刻HR更低,在T1~T4时刻MAP更低,差异有统计学意义(P<0.05)。见表3。
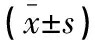
表3 两组不同时刻血流动力学比较
2.3 神经损伤标志物
T0、T1时刻,两组血清NSE、S100β、iNOS水平比较,差异无统计学意义(P>0.05)。对两组不同时刻血清神经损伤标志物水平进行重复测量方差分析,两组T2~T3时刻血清NSE、S100β、iNOS水平均呈明显上升趋势(P<0.05),T4~T5时刻血清NSE、S100β、iNOS水平则呈明显下降趋势(P<0.05),且观察组在T2~T6时刻血清神经损伤标志物水平均较对照组更低(P<0.05)。见表4。
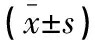
表4 两组不同时刻血清神经损伤标志物水平比较
3 讨论
血管内介入治疗是临床治疗颅脑动脉瘤的常用手段,可通过放置栓塞材料填充动脉瘤囊来消除动脉瘤囊中的血流,避免动脉瘤再破裂出血。其作为微创手术,虽可有效提高手术成功率、降低手术并发症,但术中操作如牵拉、止血、压迫等仍可能造成脑动脉痉挛、血管破裂,导致程度、范围不一的脑组织损伤。针对颅脑手术患者而言,麻醉药物的使用不仅要使患者失去知觉,达到无痛治疗的效果,还需通过麻醉调控、维持患者术中机体内环境稳态,从而为手术顺利展开创造良好生理条件。
丙泊酚是一种短效静脉麻醉药,起效快、复苏快,临床应用较广泛。但丙泊酚单独使用的镇痛作用明显不足,存在心血管抑制等缺陷[7];部分动物实验[8]证实,高浓度丙泊酚可破坏海马神经元的结构,诱导其凋亡,从而损伤神经功能。右美托咪定为选择性α2-肾上腺素受体激动剂,兼具镇静、镇痛、催眠效果,可抗交感神经兴奋性,临床常被用作辅助麻醉药物,主要在皮层下发挥作用,对γ-氨基丁酸(γ-aminobutyric acid,GABA)系统无影响,因而对认知功能无损害[9],而其“清醒镇静”作用与自然睡眠中非快速眼动期新行为相似,在无外界刺激状态下患者处于睡眠状态,若有言语等刺激则易被唤醒,刺激消失又可迅速恢复睡眠状态,利于医师对患者状态变化的判断[10],还可明显减少其他药物用量,降低术后呕吐、呼吸抑制、谵妄等症状的发生率[11]。本研究显示,观察组麻醉苏醒时间、气管插管拔除时间均短于对照组,表明右美托咪定复合丙泊酚有助于缩短患者复苏和拔除气管插管的时间,对患者术后早期恢复有利。
血流动力学异常可在一定程度上加重患者脑水肿、颅压升高,损伤神经系统,不利于预后。右美托咪定的镇静效果主要作用于蓝斑核上的受体,可通过抑制蛋白激酶A(protein kinase A,PKA)的生成来抑制单磷酸腺苷蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)活性、阻断TLR4/NF-κB通路中炎性小体NLRP3炎性小体的活化等多种途径下调炎性因子表达,减轻炎症,缓解脑部水肿[12];而右美托咪定的抗交感神经兴奋作用还可在术中减弱机体对插管等有害刺激的反应,提高患者心血管的稳定性,减少循环波动,降低脑部血流从而避免颅内压升高,改善麻醉恢复质量[13];还可通过调节儿茶酚胺的释放来调控术中血压水平[14]。本研究发现,观察组在T1~T5时刻HR、T1~T4时刻MAP均较对照组低,表明增加使用右美托咪定有助于稳定患者血流动力学,与姜锋等[15]研究结果相一致。
在颅内动脉瘤介入术中,相关区域脑组织因缺血缺氧性损伤、水肿、血肿等损伤将导致多种蛋白质、酶的表达异常。NSE为神经损伤标志酶,S100β是神经系统特异性蛋白,临床常将二者联合检测用作对脑中神经胶质细胞损伤、神经元损伤的反映;iNOS则是一氧化氮合酶的一种亚性,在神经元系统损伤后被大量表达,降低其水平可有效保护神经功能[16]。本研究发现,观察组在T2~T6时刻血清NSE、S100β、iNOS水平均较对照组低,表明右美托咪定复合丙泊酚可有效降低患者机体血清神经损伤标志物水平,具有一定神经保护作用。分析其原因可能是:右美托咪定抑制儿茶酚胺的释放、外周和中枢中的去甲肾上腺素水平升高,从而降低脑组织细胞代谢活动,减少缺血组织灌流量,有助于维持脑血管神经平衡,减轻神经损伤[17];右美托咪定还可刺激细胞外信号调节激酶(extracellular regulated protein kinases,ERK),促进星型胶质细胞释放脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和胶质细胞源性神经营养因子(glialcellline-derived neurotrophic factor,GDNF),从而营养神经,还可通过调节抗凋亡蛋白和促凋亡蛋白的相对表达来抑制神经元凋亡[18];另外,右美托咪定的抗氧化作用、神经炎症反应抑制作用等也可发挥一定的神经保护作用[19]。
综上所述,在颅脑动脉瘤介入手术麻醉中复合使用右美托咪定和丙泊酚可明显缩短患者麻醉苏醒时间和气管插管拔除时间,有利于血流动力学稳定的维持,减少脑神经损伤。

