高蛋白日粮对雏鹅生长性能、血清炎症因子及XDH表达的影响
王 志,胡仲皓,桂雪儿,冯士彬,李 玉,王希春,李锦春,吴金节
(安徽农业大学 动物科技学院,安徽 合肥 230036)
鹅是食草水禽,食性广,耐粗饲。近年来,我国部分养鹅户为使鹅快速生长,选用粗蛋白含量相对较高的鸡鸭饲料饲喂鹅,导致鹅机体蛋白质代谢异常,引起高尿酸血症及痛风的发生,尤其是雏鹅的发病率相对较高[1]。鹅肝脏中蛋白质的代谢因缺少精氨酸酶而只能通过嘌呤核苷酸循环生成嘌呤,之后其在黄嘌呤脱氢酶(XDH)和黄嘌呤氧化酶(XOD)的作用下以尿酸作为代谢终产物排出体外[2]。XDH经过翻译后修饰可转化为XOD[3],XDH和XOD统称为黄嘌呤氧化还原酶(XOR),其中XOR是动物体内嘌呤代谢的限速酶[4];XDH是尿酸生成的关键酶,是调控尿酸生成量的决定因素[5]。XDH活性升高,则嘌呤在体内分解代谢增强,尿酸的生成增加,导致血尿酸水平升高[6],这是血尿酸升高及痛风发病的重要机理之一。
研究证实高尿酸血症会导致痛风、肾功能异常等疾病,进而对机体健康造成极大的危害[7],所以抑制XDH活性是治疗痛风和降低体内尿酸水平的重要手段。目前有研究证实,抑制XDH活性是治疗人及其他哺乳动物痛风和高尿酸血症的新方法,但对禽类的此类研究鲜有报道。
本试验研究了高蛋白饲粮对雏鹅生长性能、血清炎症因子、XOD活性及XDH基因及其蛋白表达的影响,以期为动物高尿酸血症的防治提供试验资料。
1 材料与方法
1.1 主要试剂与仪器
XOD活性及肿瘤坏死因子α(TNF-α)、白细胞介素1β(1L-1β)、白细胞介素6(IL-6)、尿酸(UA)含量检测试剂盒,上海源叶生物科技有限公司生产;XDH抗体,Affinity公司生产;RIPA细胞裂解液和BCA蛋白质浓度测定试剂盒,Biosharp公司生产;蛋白磷酸酶抑制剂,Solarbio公司生产;β-Actin Mouse Monoclonal Antibody和彩色预染蛋白质分子量标准,Beyotime公司生产;辣根酶标记山羊抗小鼠IgG和DAB显色剂,北京中山金桥生物技术公司生产;2×SYBR Green qPCR Mix, SparkJade公司生产。
主要仪器有电泳仪(EPS300,Tanon,中国)、Rrefrigerated Centrifuge(TGL-18R,Hema,中国)、ChemiDoc成像系统(Bio-Rad,美国)、光学显微镜(Olympus CX31,日本)、透射电镜(JEM-1230,日本)、Multiskan Mk3微孔板(Thermo Scientific,美国)、RNA浓度分析仪(NanoVue plus,Thermo,美国)、实时荧光定量PCR仪(Thermo,美国)、MK3型半自动酶联免疫分析仪(Thermo,美国)。
1.2 试验设计
试验选用体质量相近((112±1.09) g/只)的1日龄雁鹅72只,随机分成对照组(CP)、高蛋白组1(HP1)、高蛋白组2(HP2),每组3个重复,每个重复8只鹅。对照组饲喂基础日粮,HP1组饲喂粗蛋白含量为230.00 g/kg的饲粮,HP2组饲喂粗蛋白含量为280.00 g/kg的饲粮,3种饲粮的能量水平一致。基础饲粮参照鹅的营养需要制备,其中粗蛋白含量为180.00 g/kg。3组饲粮的配方及养分含量见表1。试验为期14 d。雏鹅自由采食、饮水,按正常免疫程序进行免疫接种。

表1 鹅饲粮配方及养分含量(风干基础)Table 1 Formula and nutrient contents in diets for goslings (air-dry basis)
1.3 生长性能指标的测定
试验期间每周测定各组雏鹅采食量、体质量,计算平均体质量(ABW)、平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.4 样品的采集
于7和14日龄,每组随机选取10只鹅,空腹12 h后颈静脉采血12 mL,于室温下倾斜静置30 min,3 000 r/min离心15 min后分离血清,-20 ℃保存。采集14日龄鹅的肝脏、肾脏、十二指肠、空肠,一部分存于冻存管中,另一部分固定于体积分数10%的福尔马林溶液中。
1.5 血液指标的测定
使用MK3型半自动酶联免疫分析仪测定7和14日龄鹅血清中XOD活性及TNF-α、1L-1β、IL-6、UA含量。
1.6 组织中XDH基因及其蛋白表达水平的测定
1.6.1XDHmRNA表达水平的实时荧光定量PCR(RT-qPCR)测定 取冻存的肝脏、肾脏、十二指肠、空肠组织各100 mg,液氮研磨后先加入1 mL Trizol试剂,之后加入200 μL氯仿摇匀20次,12 000g离心15 min,取500 μL上清液,加入500 μL异丙醇,12 000g离心10 min;弃去上清液,沉淀中加入500 μL体积分数 75%乙醇,7 500g离心5 min,弃去上清液,向沉淀中加入60 μL无RNA酶的水,用枪反复吹打几次,使其完全溶解,将获得的RNA溶液保存于-80 ℃待用。每个样本取500 ng RNA反转录为cDNA,备用。
选用β-actin为内参基因。用Primer Premier 5.0软件设计XDH和β-actin的PCR引物,引物由合肥摩尔生物科技有限公司合成。XDH基因的上游引物序列为5′-TTTACTCTACGGCGATGTTG-3′,下游引物序列为5′-TTCCAGCGATTCTGTTTGT-3′;β-actin基因的上游引物序列为5′-GACAGGATGCAGAAGGAGATTACT-3′,下游引物序列为5′-TGATCCACATCTGCTGGAAGGT-3′。用GoTaq qPCR Master Mix System(Promega)检测XDHmRNA表达水平。实时荧光定量PCR(RT-qPCR)反应体系为25 μL:每个反应包含互补DNA模板 2 μL,10 μmol/L上游引物0.5 μL,10 μmol/L下游引物0.5 μL,2×SYBR Green qPCR Mix 12.5 μL,ddH2O 9.5 μL。RT-qPCR反应程序为:94 ℃ 2 min;94 ℃ 15 s,60 ℃ 20 s,72 ℃ 20 s,40个循环。然后将PCR产物在60 ℃下孵育反应30 s,以0.2 ℃/s的速率将温度从60 ℃升高至94 ℃进行熔解曲线分析。用2-ΔΔCt法计算XDHmRNA相对表达水平。
1.6.2 XDH蛋白水平的免疫组化法检测 取体积分数10%福尔马林溶液中固定的肝脏、肾脏、空肠和十二指肠组织,常规方法制备石蜡切片(片厚4 μm),脱水后,用PBS冲洗4次,滴加体积分数3%过氧化氢作用25 min,以阻断内源性过氧化物酶活性。用PBS漂洗4次后用10 mmol/L柠檬酸钠缓冲溶液(pH 6.0)微波修复抗原,然后冷却至室温,PBS漂洗4次。将切片用50 g/L BSA室温封闭25 min,然后用稀释的XDH抗体(1∶300,) 4 ℃孵育过夜,用PBS代替XDH抗体作为阴性对照(NC)。将孵育后的切片置于37 ℃培养箱中培养45 min,PBS清洗3次后滴加辣根酶标记山羊抗小鼠Ig G,37 ℃孵育30 min后用PBS漂洗4次。DAB显色2 min后流水漂洗,苏木精复染、封片后于光学显微镜下观察。用imageproplus 6.0进行免疫染色阳性面积和积分光密度(IOD)测量,从每只鹅的3个切片中随机抽取9张图像进行积分光密度分析,蛋白水平用平均光密度表示,平均分光密度=IOD/免疫染色阳性面积。
1.6.3 XDH蛋白水平的Western-blotting法检测 从每只鹅的肝脏、肾脏、十二指肠、空肠样本中分别取300 mg组织,用RIPA细胞裂解缓冲液和蛋白磷酸酶抑制剂提取总蛋白,使用BCA蛋白质浓度测定试剂盒测定蛋白质浓度。将提取的蛋白质样品煮沸5 min,在SDS-PAGE凝胶中电泳,然后转移到PVDF膜,用牛血清白蛋白(BSA)在室温下封闭膜4 h后,用XDH抗体在4 ℃孵育过夜,将膜洗涤3次,用辣根酶标记山羊抗小鼠IgG在室温下水平振荡孵育45 min,洗膜后放入凝胶成像系统(Bio-Rad)中成像。通过Image J软件对蛋白质印迹的灰度值进行分析,用灰度值表示蛋白水平。
1.7 数据统计与分析
数据用“平均值±标准差”表示。用SPSS 20.0软件进行单因素方差分析,Duncan’s法进行多重比较,P<0.05具有统计学意义;用GraphPad Prism 8绘制柱状图进行比较分析。
2 结果与分析
2.1 高蛋白日粮对雏鹅生长性能的影响
高蛋白日粮对雏鹅生长性能的影响如表2所示。
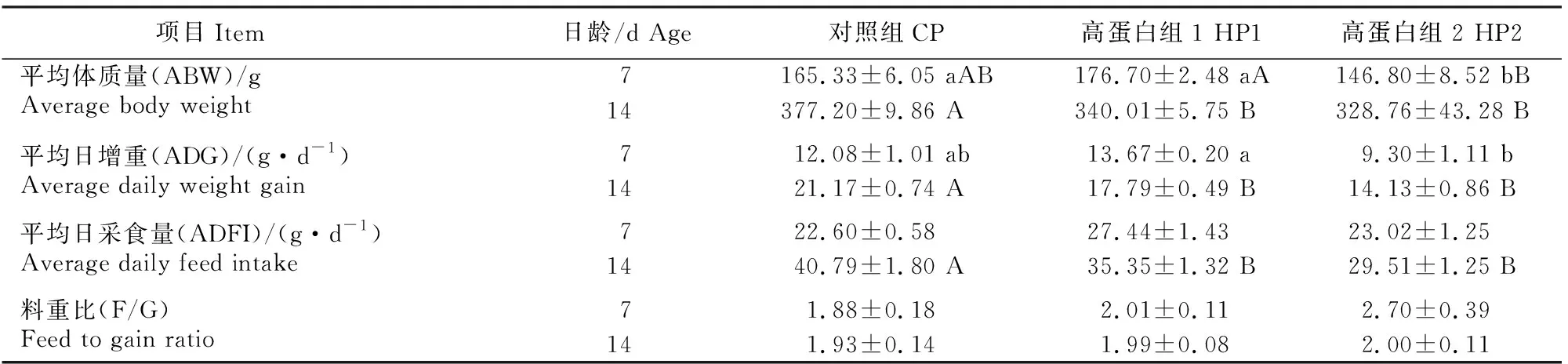
表2 高蛋白日粮对雏鹅生长性能的影响Table 2 Effects of high protein diets on growth performance of goslings
由表2可知,7日龄时,HP2组雏鹅的平均体质量显著小于CP组(P<0.05),极显著小于HP1组(P<0.01),HP1组雏鹅的平均日增重显著大于HP2组(P<0.05);14日龄时,CP组雏鹅的平均体质量、平均日增重、平均日采食量均极显著高于HP1和HP2组(P<0.01)。
2.2 高蛋白日粮对雏鹅血清中炎症因子及尿酸水平的影响
高蛋白日粮对雏鹅血清中炎症因子含量及黄嘌呤氧化酶活性的影响如表3所示。由表3可知,7日龄时,HP2组雏鹅血清中的1L-1β、TNF-α、UA含量及XOD活性均极显著高于CP组(P<0.01),1L-1β、TNF-α、UA的含量显著高于HP1组(P<0.05);HP1组雏鹅血清中TNF-α的含量极显著高于CP组(P<0.01)。
由表3还可以看出,14日龄时,HP2组雏鹅血清中1L-1β、IL-6、TNF-α、UA含量及XOD活性均显著或极显著高于CP组和HP1组(P<0.05或P<0.01);HP1组雏鹅血清中的1L-1β、IL-6、TNF-α、UA含量及XOD活性极显著高于CP组(P<0.01)。
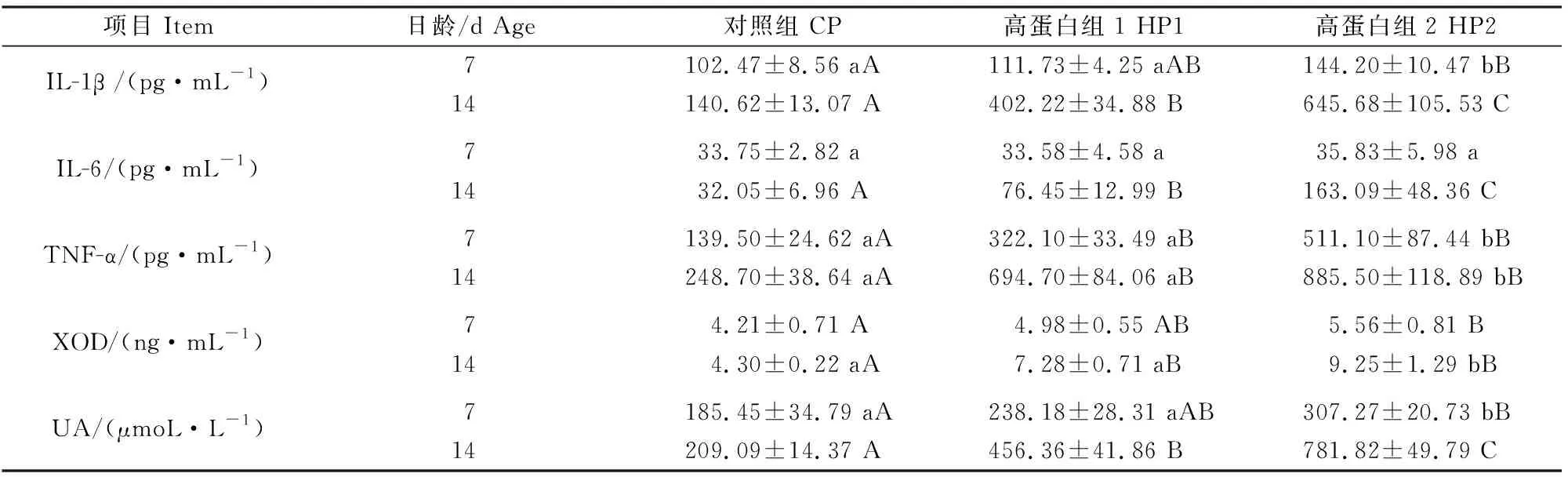
表3 高蛋白日粮对雏鹅血清中炎症因子含量及黄嘌呤氧化酶活性的影响Table 3 Effects of high protein diet on serum inflammatory cytokines levels and XOD activity of goslings
2.3 高蛋白日粮对雏鹅不同组织中XDH基因及其蛋白表达的影响
由图1~3可知,HP2组雏鹅肝脏、肾脏、十二指肠的XDH基因和蛋白的表达显著或极显著高于CP组,肝脏、肾脏XDH基因和蛋白的表达显著或极显著高于HP1组;HP1组雏鹅肝脏、十二指肠中XDH基因和蛋白的表达显著或极显著高于CP组;各组雏鹅空肠中XDH基因和蛋白的表达无显著差异(P>0.05)。
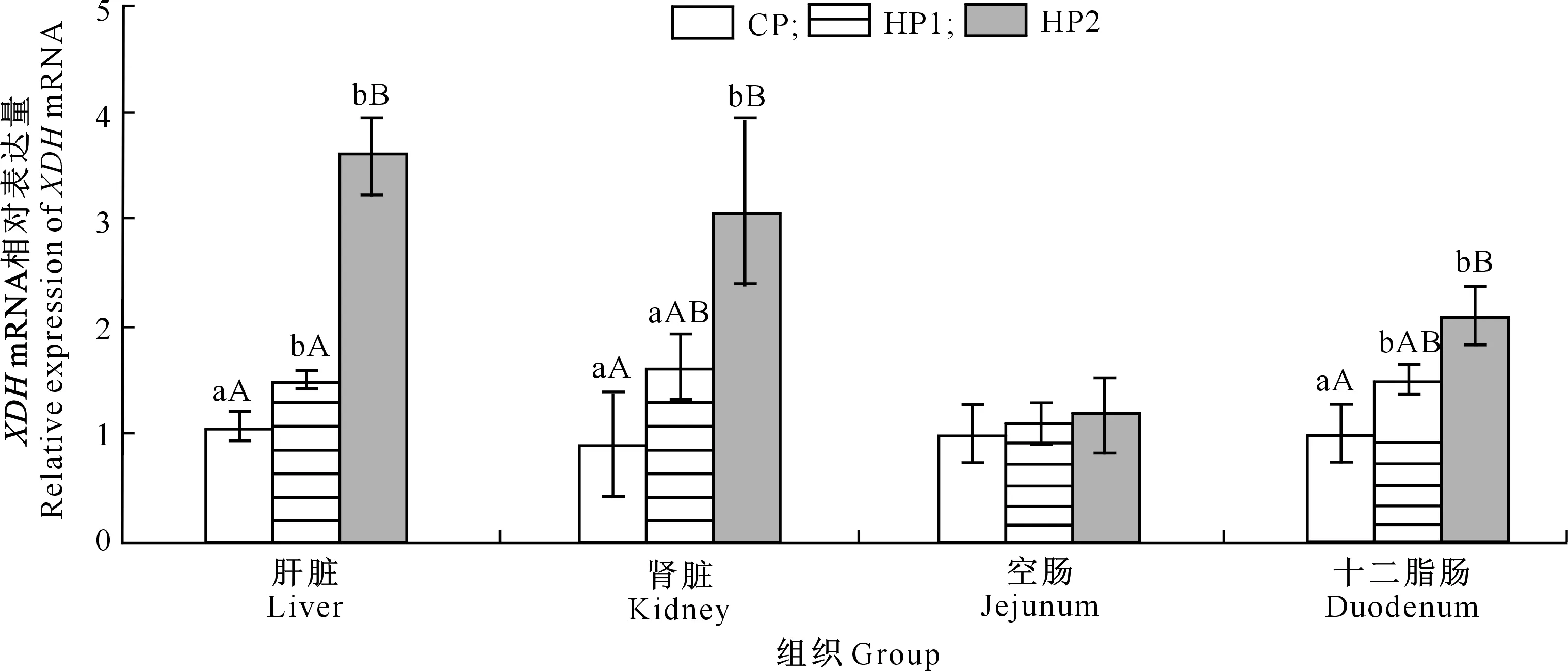
同一组织中图柱上标不同小写字母表示处理间差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)。下图同Different lowercase letters indicate significant difference for same organs among treatments (P<0.05),and different capital letters indicate extremely significant difference (P<0.01).The same below
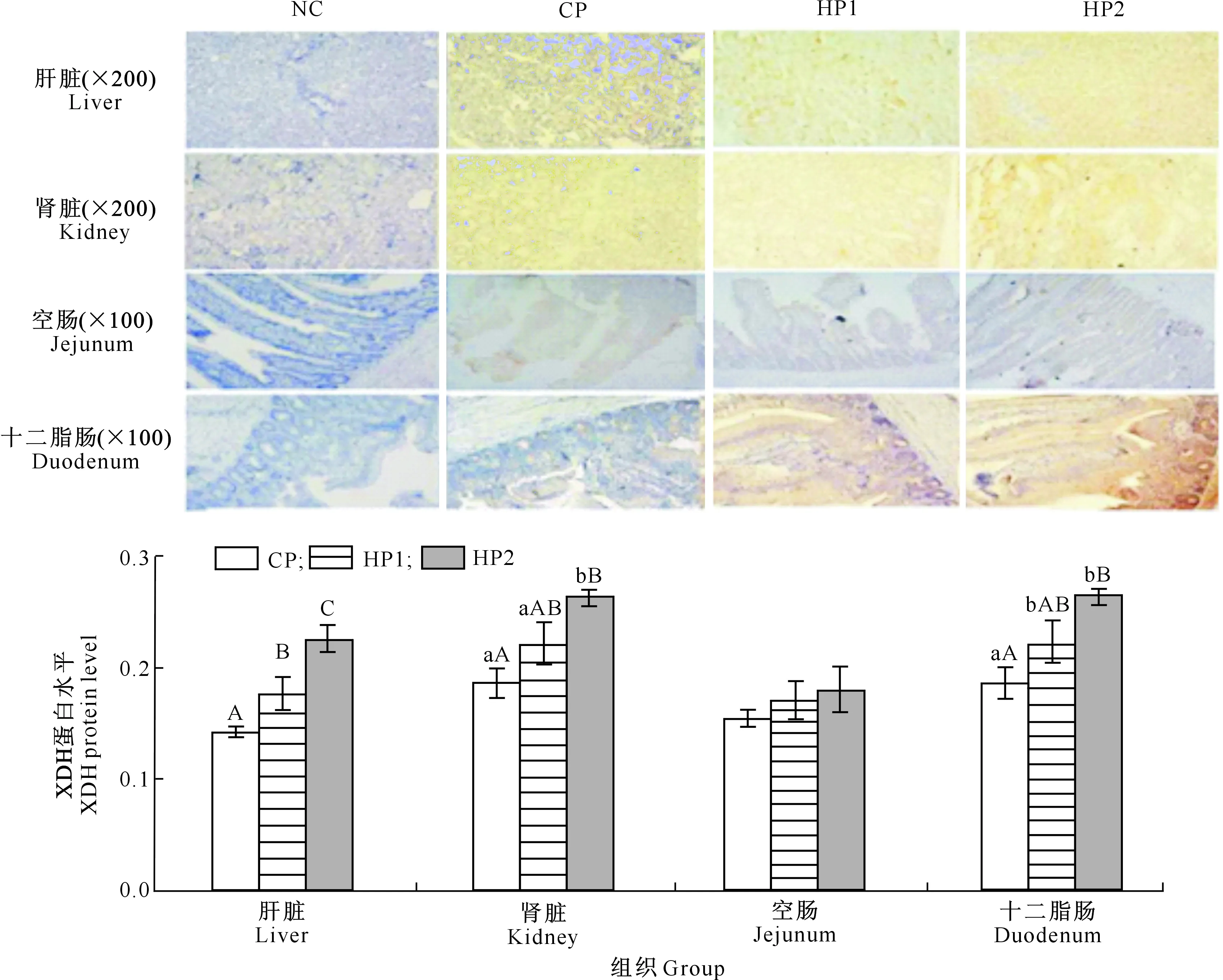
图2 高蛋白日粮对鹅肝脏、肾脏、十二指肠、空肠中XDH蛋白表达水平的影响(免疫组化的结果)Fig.2 Effect of high protein diet on XDH protein expression in liver,kidney,duodenum and jejunum of goslings(immunohistochemistry results)

图3 高蛋白日粮对雏鹅肝脏、肾脏、十二指肠、空肠中XDH蛋白表达量的影响(Westen-blotting结果)Fig.3 Effect of high protein diet on expression of XDH protein in liver,kidney,duodenum and jejunum of goslings(Western-blotting results)
3 讨 论
本试验连续7 d饲粗蛋白含量为230.00 g/kg日粮对雏鹅的生长性能无显著影响,但后期会造成雏鹅生长性能下降。试验期间,饲喂粗蛋白含量为280.00 g/kg日粮的雏鹅生长缓慢,生长性能下降程度大于饲喂粗蛋白含量为230.00 g/kg日粮的雏鹅,说明蛋白含量过高的日粮不利于雏鹅的生长,蛋白含量超出正常越多,越不利于鹅的生长,这点与李曼曼等[8]的结果相似。
UA在肝脏中合成,通过肾脏排出体外,使血液中的UA浓度维持恒定,但是当机体UA生成过多,超过肾脏的排泄能力,将不可避免地发生高尿酸血症。本试验结果证实,血清UA浓度与饲喂蛋白水平和饲喂时间呈正相关。在众多炎症因子中,IL-6、IL-1β、TNF-α被认为在高尿酸血症和痛风的发生发展中起重要作用[9-12]。本试验与Liang等[13]的研究结果相似,高蛋白日粮的摄入使雏鹅血清中IL-6、IL-1β、TNF-α质量浓度及XOD的活性均呈现上升趋势,随着蛋白水平和饲喂时间的增加,上升趋势越显著,提示鹅血清中的IL-6、IL-1β、TNF-α质量浓度和XOD活性与日粮蛋白水平呈正相关,与饲喂时间也呈正相关,表明饲喂高蛋白日粮可导致雏鹅体内发生持续的炎症反应。血清中XOD活性的升高可能是由于肝脏代谢活动增强,导致肝细胞膜通透性增加,细胞中XOD释放入血所致。
鹅体内尿酸氧化酶失活,非嘌呤类前体物质在体内经过一系列转化生成嘌呤类核苷酸,继续分解生成次黄嘌呤和黄嘌呤,最终经过XDH的连续氧化而生成UA[14-16]。因此,XDH直接调控着体内UA水平的高低[17]。XDH广泛存在于各种动物体内[18]。本试验研究表明,XDH在鹅的肝脏、肾脏、十二指肠、空肠中均有分布;通过14 d持续饲喂不同水平的高蛋白日粮发现,XDH在肝脏中的表达高于在肾脏及小肠中;随着日粮中粗蛋白含量的增加,XDH基因及其蛋白在肝脏、肾脏和十二指肠中的表达水平均呈上升趋势,表明饲喂高蛋白日粮可导致雏鹅体内XDH过表达,催化嘌呤类物质的分解代谢增加,UA生成增多,使得雏鹅体内UA水平不断升高[19],最终导致高尿酸血症,这可能是饲喂高蛋白日粮导致高尿酸血症[20-22]发生的主要机理之一。已有研究证实,XDH活力受细胞因子的调节,不同的细胞因子可以在转录、翻译或翻译后加工等不同水平上发挥各自的调节作用,如TNF-α、IL-6、IL-1β可诱导牛肾上皮细胞的XDH/XO活性[23];IL-6能提高牛肾小管上皮细胞中XDH转录水平并增加XDH蛋白合成量[24]。据此推测,高蛋白日粮的摄入促使雏鹅IL-1β、TNF-α、IL-6质量浓度增加,这些炎症因子促进XDH的表达,导致嘌呤类物质代谢增加,UA生成增多,最终引发高尿酸血症。
综上所述,摄入过高水平的蛋白会导致雏鹅生长性能降低,机体发生炎症反应,肝脏、肾脏、十二指肠中XDH基因和蛋白表达增加,机体生成UA增多,UA浓度超过肾脏的排泄能力,最终导致雏鹅发生高尿酸血症。

