臭椿酮对植物种子萌发及相关生理生化指标的影响
田岐震, 魏少鹏,2, 姬志勤*,,2
(1. 西北农林科技大学 植物保护学院,陕西 杨凌 712100;2. 陕西省植物源农药研究与开发重点实验室,陕西 杨凌 712100)
臭椿Ailanthus altissima是原产于东亚的苦木科臭椿属植物,其根皮和果实为传统中药[1]。迄今为止,已从臭椿中分离鉴定了数十个苦木苦味素类化合物,这些化合物表现出抗病毒、抗肿瘤、抗疟及抗菌等多种药理活性[2-4]。1959年,Mergen首次报道臭椿提取物具有除草活性[5];1995年,臭椿提取物中的除草活性成分被分离鉴定为臭椿酮[6]。2003年,De Feo等对臭椿根皮中的除草活性成分进行了系统分离,从中得到臭椿酮、ailanthinone、chaparrine和ailanthinol B 4个具有除草活性的苦木苦味素类化合物,其中臭椿酮的活性最强[7]。2011年,Pedersini等比较了臭椿茎皮不同溶剂提取物的除草活性,发现其活性与臭椿酮的浓度呈正相关[8]。Heisey等报道了臭椿提取物对17种杂草的田间防除效果,发现提取物对其中13种供试杂草具有很好的防效[9]。2019年,Demasi等研究了臭椿酮苗前土壤处理防治杂草的田间持效期,发现其在低有机质含量土壤中的持效期可达20~30 d,但在高有机质含量土壤中的降解较快[10]。近年来,国内外对臭椿酮 (或臭椿提取物)的除草活性进行了较多的研究,证明臭椿酮具有开发成植物源除草剂的潜在价值,然而有关臭椿酮除草作用机制的研究鲜有报道。本研究测定了臭椿酮对植物种子萌发及相关生理生化指标的影响,旨在为进一步研究臭椿酮的除草作用机制提供参考。
1 材料与方法
1.1 供试药剂及植物
臭椿酮 (ailanthone,纯度95%,CAS: 981-15-7),本课题组从臭椿根皮中分离得到[11]。
油菜Brassica napus、小麦Triticum aestivum、马齿苋Portulaca oleracea、苘麻Abutilon theophrasti、稗草Echinochloa crusgalli、反枝苋Amaranthus retroflexus、狗尾草Setaria viridis及马唐Digitaria sanguinalis,以上供试作物及杂草的种子均采自西北农林大学北校区农场。
1.2 种子萌发活性测定
采用平皿法测定臭椿酮对8种供试植物种子萌发的影响[7]。先用少量二甲基亚砜溶解臭椿酮,再用体积分数0.1%的Tween 80分别稀释成1.56、3.13、6.25、12.50、25.00和50.00 μg/mL 的供试溶液,二甲基亚砜在所有供试溶液中的最终体积分数不超过0.5%。先用体积分数1%的次氯酸钠溶液对种子进行表面消毒,再用去离子水冲洗3次。将50粒种子均匀地放在培养皿 (9 cm) 的滤纸上,每个培养皿中加入5.0 mL上述臭椿酮供试溶液。以含体积分数0.5%的二甲基亚砜和0.1% Tween 80的水溶液作为溶剂对照。种子在25 ℃、16 h/8 h (光/暗) 条件下培养4 d。分别于24、48、72和96 h记录萌发种子的数量 (以根长2 mm为萌发标准)。所有试验重复3次。
1.3 种子吸水量测定
参照文献方法进行[12]。在铺有双层滤纸的培养皿 (9 cm) 中分别加入5.0 mL质量浓度为1.56、3.13、6.25、12.50和25.00 μg/mL 的臭椿酮溶液,分别放入油菜 (1.0 g) 和小麦 (2.0 g) 种子,在25 ℃恒温条件下分别培养4、8、12和16 h。将种子从溶液中取出,吸干水分,称重,计算吸水量 (最终质量减去初始质量)。以含体积分数为0.5%的二甲基亚砜和0.1%的Tween 80的水溶液作为溶剂对照。每个处理重复3次,计算平均值。
1.4 幼苗生长的生理生化指标的测定
根据预试验确定臭椿酮抑制幼苗生长中浓度。将萌发的油菜和小麦种子分别置于0.50 μg/mL和2.00 μg/mL臭椿酮溶液中,在25 ℃的光照培养箱中培养 (光/暗 = 12 h/12 h)。以含体积分数为0.5%的二甲基亚砜和0.1%的Tween 80的水溶液作为溶剂对照。当对照组种子胚芽长到约1.0 cm时,分别收集胚芽和胚根 (各0.50 g),置于预冷的研钵中,加入0.05 mol/L预冷的磷酸盐缓冲液1.0 mL (pH 7.8),然后将胚芽和胚根在冰上磨成粉末,分别提取超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、过氧化物酶 (POD) 和总可溶性蛋白(TSP)[13]。当对照组种子胚芽长到约1.0 cm时,分别收集胚芽和胚根 (0.10 g),加入蒸馏水5~10 mL,煮沸30 min,提取两次,提取液过滤入25.00 mL容量瓶,用蒸馏水定容,提取总可溶性糖 (TSS)[14]。所有粗提液于4 ℃保存备用。
采用氮蓝四唑光还原法[14]测定SOD活性;采用愈创木酚法[14]测定POD活性;采用高锰酸钾滴定法[14]测定CAT活性;采用3,5-二硝基水杨酸法[14]、考马斯蓝G-250染色法[14]分别测定TSS和TSP含量。每处理重复3次。
1.5 对植物细胞有丝分裂的影响
参照文献方法进行[15]。将油菜种子置于含水滤纸上培养,待根长为1.0 cm时,挑选生长一致的幼苗移至质量浓度分别为0.01、0.05、0.10、0.50和1.00 μg/mL的臭椿酮溶液中继续培养24 h。取根尖0.5 cm部分,浸入卡诺氏固定液中固定6 h。取出根尖用去离子水冲洗至无醋酸气味,接着将根尖浸入1 mol/L的盐酸溶液,在60 ℃下孵育10 min。取出根尖用去离子水洗涤3次,置于载玻片上,用接种针将根尖捣碎,加入卡宝品红染色10 min。放上盖玻片,用铅笔轻轻敲击,使细胞均匀分布。光学显微镜下进行观察和计数。有丝分裂指数和畸形指数分别按公式 (1) 和 (2)计算。
式中:A,有丝分裂指数;C,分裂细胞数;D,顶端分生组织细胞总数;B,畸形指数;E,分裂异常数。
1.6 活性氧含量的测定
参考文献方法[16]并略作修改。将油菜种子置于含水滤纸上催芽,待根长为1.0 cm时,挑选长势相近的油菜幼苗,浸入0.10、1.00和10.00 μg/mL的臭椿酮溶液,于25 ℃黑暗培养12 h。以体积分数为0.1%的二甲基亚砜溶液作为溶剂对照。每个处理设3个重复。将幼苗分别转置于3,3-二氨基联苯胺 (DAB) 染色液和氯化硝基四氮唑蓝 (NBT)染色液中,于25 ℃黑暗培养箱中浸染2 h。取出幼苗观察拍照,用Image J软件进行量化处理。按公式(3)计算染色强度。
式中:R,染色强度;F,未染色根尖灰度值;H,染色根尖灰度值。
1.7 细胞死亡率测定
参考文献方法[15]并略作修改。将油菜种子置于含水滤纸上催芽,待根长为1.0 cm时,挑选长势相近的油菜幼苗,浸入0.10、1.00和10.00 μg/mL的臭椿酮溶液。以体积分数为0.1%二甲基亚砜溶液为对照,于28 ℃黑暗培养24、48和72 h,幼苗煮沸30 min作为死亡对照,将整株油菜浸入2.50 μg/mL的伊文思蓝水溶液中,于旋转摇床上25 ℃孵育30min,取出植株用去离子水洗涤,除去未结合的染料,并观察拍照。每处理重复3次。运用Image J对照片进行量化处理。按公式(4)计算细胞相对死亡率。
式中:X,细胞相对死亡率;M,0.1%二甲基亚砜组灰度值;L,处理组灰度值;K,CK组灰度值;Z,煮沸对照组灰度值。
1.8 数据处理
采用SPSS 23.0软件计算臭椿酮对种子萌发抑制IC50值,使用邓肯氏新复极差法 (P< 0.05) 进行差异显著性分析;使用Image J量化处理染色强度;使用Excel 2010完成图表绘制;使用Photoshop 6.0处理图片。
2 结果与讨论
2.1 臭椿酮对8种植物种子萌发的影响
从表1可以看出,臭椿酮对油菜、稗草、苘麻、狗尾草和马唐的种子萌发具有较强的抑制作用,其IC50值分别为3.74、9.86、9.71、3.87和3.76 μg/mL。臭椿酮对小麦和反枝苋种子萌发也有较强的抑制作用,其IC50值分别为24.70和32.60 μg/mL。在供试浓度下,臭椿酮对马齿苋种子萌发的抑制作用较弱。从结果可以看出,臭椿酮的除草活性在单子叶和双子叶植物间无选择性,但是个别杂草对臭椿酮的敏感性较低。臭椿酮对油菜和小麦的种子萌发有明显抑制作用,有文献也报道了臭椿提取物在采用茎叶喷雾法防治杂草时对番茄、白萝卜、黄豆、向日葵、玉米、燕麦和南瓜有严重的药害[9],因此不建议将其用于大田作物及蔬菜生产中,但在园艺作物中作为一种非选择性除草剂具有潜在的应用价值,相关应用技术值得进一步研究。
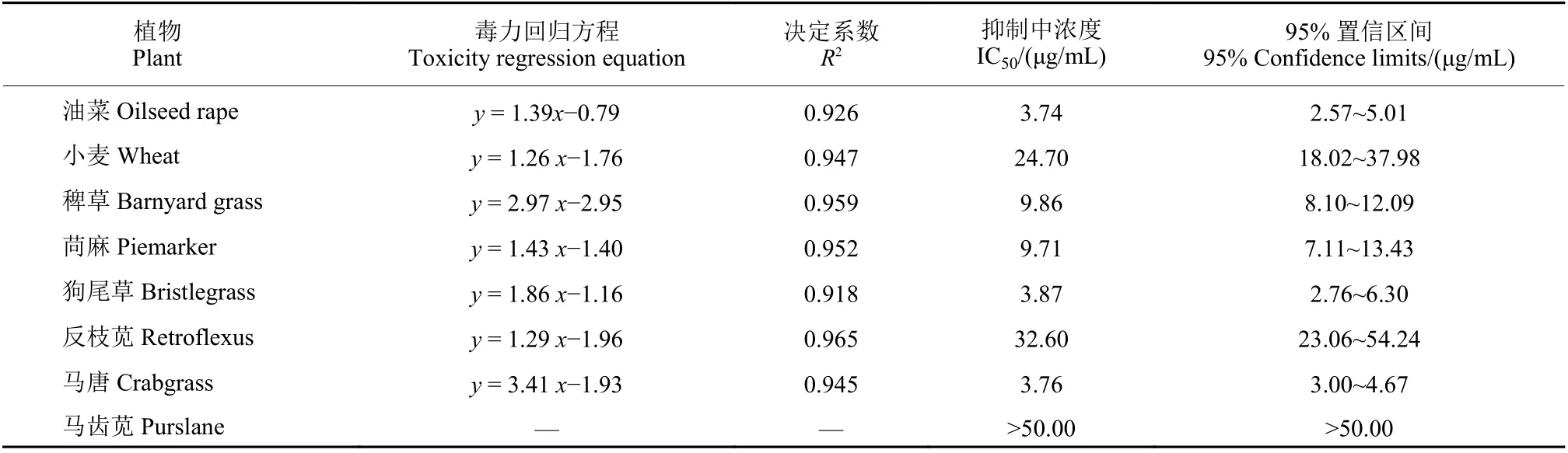
表1 臭椿酮对8种植物种子萌发的影响Table 1 Effects of ailanthone on seed germination of eight plants
2.2 臭椿酮对油菜和小麦种子吸水量的影响
萌发是种子从静止干燥状态到代谢活跃状态,然后生长成幼苗的过程[17]。这一过程始于干燥种子对水分的吸收,外源化合物可以抑制种子蛋白酶的活性,造成种子吸水能力下降,最终导致种子不能正常萌发[12,18]。臭椿酮处理后的油菜和小麦种子吸水量如图1所示。可以看出,不同浓度臭椿酮处理的种子在吸水能力上并无明显差异,与空白对照相比也没有显著差异,这说明臭椿酮并未影响种子的吸水能力,由此可以推测臭椿酮不影响种子蛋白酶的活性。
2.3 臭椿酮对幼苗生长的影响
SOD在保护细胞免受超氧化物自由基损伤方面发挥重要作用,它催化超氧化物自由基的降解生成过氧化氢[19]。细胞内过氧化氢水平受多种酶调控,CAT是多酶体系中的一种[20]。POD是植物中的抗氧化酶,通过将过氧化氢还原为水来催化多种底物的氧化[21]。SOD、CAT和POD活性的增加是植物组织提高抗氧化能力的表现。
对油菜和小麦胚芽和胚根中SOD、CAT和POD的酶活性测定结果 (图2) 表明:溶剂对照处理油菜胚根SOD活性为106.27 U/g, 臭椿酮处理后SOD活性增加至173.56 U/g。同样,用臭椿酮处理后,小麦胚芽中SOD活性从1 851.43 U/g增加到2 159.61 U/g,小麦胚根中SOD活性从167.50 U/g 增加到441.54 U/g。臭椿酮也导致了CAT活性的轻微增加,小麦胚芽和胚根的CAT活性值从1.79 mg/(g∙min)增加到2.20 mg/(g∙min),胚根的CAT活性值从0.41 mg/(g∙min)增加到0.56 mg/(g∙min);处理过的油菜和小麦幼苗POD活性也高于对照组。
与对照组相比,臭椿酮提高了油菜和小麦胚中TSS和TSP的含量,说明低剂量的臭椿酮能提高植物的整体代谢水平。
活性氧 (ROS) 的产生和消除是一个动态平衡,在植物体内活性氧的消除主要依赖于细胞的抗氧化酶系,当细胞内产生的活性氧增加时,为维持细胞的正常生长,植物会提高抗氧化酶活性消除活性氧[22]。上述生理指标试验证实臭椿酮的存在可以提高植物的抗氧化能力,但臭椿酮是否会诱导ROS的积累仍需通过活性氧染色试验进行探究。
2.4 臭椿酮对细胞有丝分裂的影响
通过对油菜根分生组织细胞的有丝分裂指数分析,评价了臭椿酮对油菜根分生组织细胞分裂的影响。暴露于臭椿酮 (0.01、0.05、0.10、0.50和1.00 μg/mL) 24 h后,较高浓度的臭椿酮 (0.50和1.00 μg/mL) 明显抑制了油菜根的生长 (图3 Ⅰ),其中1.00 μg/mL的臭椿酮抑制率为40.60%。处理组根尖分生区有丝分裂指数均低于对照组,且臭椿酮对油菜细胞分裂的抑制作用呈剂量依赖性 (图3 Ⅱ)。暴露于1.00 μg/mL的臭椿酮后,有丝分裂指数仅为0.48%,而对照组为5.85%。此外,臭椿酮还能导致畸形细胞的形成,其中0.10 μg/mL的臭椿酮处理后畸形指数最高,约为0.45% (图3 Ⅱ、Ⅲ)。
2.5 臭椿酮对植物组织中活性氧积累的影响
活性氧是植物进行代谢的副产物,在生长发育过程中可以作为信号分子参与调控,但是活性氧的过度积累会导致脂质过氧化反应,从而对植物的生长造成严重的损伤[23]。植物体内的活性氧主要包括超氧阴离子 (O2−)、过氧化氢 (H2O2) 和羟基自由基 (•OH) 等。
由图4可以看出,油菜根浸入臭椿酮后,不仅根长受到了抑制,根部的活性氧含量也大幅升高,且其含量随着臭椿酮质量浓度的增加而升高,在10.00 μg/mL臭椿酮剂量下,油菜根长几乎没有增长,但是过氧化氢和超氧阴离子含量分别是溶剂对照的2.53倍和2.08倍。由试验结果得知,臭椿酮的存在可以在短时间内诱导植物体内大量活性氧的累积。抗氧化酶活性测定结果表明,在臭椿酮的影响下,SOD、CAT和POD的活性都呈升高的趋势,这与臭椿酮可以在短时间内诱导大量活性氧积累相关,体内活性氧含量升高会损害细胞正常生命活性,机体便会调节抗氧化酶的活性来消除活性氧。
2.6 细胞死亡率测定
通过图5 (Ⅰ、Ⅱ、Ⅲ) 可以看出,染色较深的是根毛茂盛部位和根尖,对根尖区域的相对死亡率测定发现,在臭椿酮相同质量浓度下,根尖细胞的相对死亡率并没有随着时间的推移而产生较大变化。1.00 μg/mL臭椿酮处理24、48和72 h的细胞相对死亡率分别为8.56%、9.58%和10.23%,但是,在同一时间段,根尖细胞相对死亡率会随着臭椿酮质量浓度的增加而增大,0.10、1.00和10.00 μg/mL臭椿酮处理72 h时的细胞相对死亡率分别为6.01%、10.23%和21.36%。表明1.00 μg/mL臭椿酮在24 h内就已经造成细胞死亡,但是直至72 h细胞死亡的数量并没有显著增加,说明受到臭椿酮影响失去活力的细胞占根尖细胞的比例变化不大。细胞有丝分裂周期为G1、S、G2和M4个时期,在外部条件相同的情况下,处于一个时期的细胞数量几乎不变,例如,处于M期的细胞占细胞总数5%~10%[24]。结合根尖分生区有丝分裂现象观察,可以推测:臭椿酮的存在可以引起部分植物根尖分生区细胞死亡,使这一部分细胞无法进入M期,或进入M期后引起有丝分裂畸形,从而减少新生细胞数量,导致根无法正常生长。
3 结论
臭椿酮对多种植物的种子萌发和幼苗生长具有很强的抑制作用,且在单子叶和双子叶植物之间没有选择性。臭椿酮对植物种子吸水能力无明显影响。植物生长量的减少可能与臭椿酮抑制其细胞分裂有关。SOD、CAT和POD的酶活试验结果表明,臭椿酮提高了植物的抗氧化能力。DAB和NBT染色结果表明,臭椿酮诱导了植物组织中活性氧的积累,伊文思蓝染色说明臭椿酮可以引起一部分细胞死亡,但并未随着时间的推移而增长,推测臭椿酮的存在可以引起部分植物根尖分生区细胞死亡,并使这一部分细胞是无法进入细胞有丝分裂的M期,或进入M期后会引起有丝分裂畸形,从而减少新生细胞数量,导致植物根系无法正常生长。本研究结果表明,臭椿酮表现出较强抑制种子萌发和幼苗生长活性,究其原因可能为活性氧积累,或引起了部分植物根尖分生区细胞死亡使其无法正常有丝分裂。

