复方景川片对大鼠缺血性脑损伤的保护作用及对小胶质细胞/巨噬细胞极化的影响
刘伟伟,聂卫,崔晓雪,王宏,张婷,刘庆焕,王文彤
脑缺血可引起神经元坏死,释放炎症介质,进而诱导中枢小胶质细胞及巨噬细胞为主的外周免疫细胞在缺血区域聚集并激活,介导脑组织炎症瀑布效应[1]。研究表明,小胶质细胞/巨噬细胞极化在卒中引起的脑损伤中起关键作用,尤其是M2型小胶质细胞/巨噬细胞在促进脑修复过程中起重要作用[2-3]。复方景川片为在研的复方六类新药,选用红景天、川芎、延胡索、冰片为组方配伍,诸药合用,共奏益气活血、化瘀通络之效。本课题组前期研究已建立了稳定的复方景川片质量评价标准[4],并证实其可明显降低脑梗死的面积及神经元凋亡程度[5]。但其神经保护作用是否与小胶质细胞/巨噬细胞极化有关,目前尚不明确。本研究采用大鼠大脑中动脉闭塞模型,观察复方景川片在大鼠脑缺血损伤中的神经保护作用,并探讨其治疗作用与小胶质细胞/巨噬细胞极化的相互关系,旨在探究复方景川片治疗缺血性脑损伤的作用机制。
1 材料与方法
1.1 实验材料 SPF级雄性SD大鼠60只,体质量160~180 g,购自北京维通利华实验技术有限公司,动物合格证号SCXK(京)2016-0006,购入后自由饮水,饲养环境温度(25±2)℃。复方景川片由天津市医药科学研究所制剂中心提供,规格0.5 g/片,以红景天苷计为3.35 mg/g;尼莫地平片,规格30 mg/片(天津市中央药业有限公司,产品批号:171102);2432-A4线栓(北京西浓科技有限公司)。兔抗CD86 多克隆抗体、兔抗精氨酸酶1(Arg1)多克隆抗体(武汉三鹰生物技术有限公司),小鼠β-actin 单抗、链霉亲和素-生物素复合物(SABC)免疫组化染色试剂盒及DAB显色剂(武汉博士德生物工程有限公司),苏木素-伊红(HE)染液(北京索莱宝科技有限公司);其他试剂均为国产或进口分析纯。ASP200S 全自动组织脱水机、Leica EG1150H组织包埋机、Leica RM2255全自动切片机(德国徕卡);尼康Ci-L 图像采集显微镜、NIS-BRML图像分析系统(日本尼康)。
1.2 方法
1.2.1 动物分组和给药 60 只大鼠按随机数字表法分为空白对照组,模型组,尼莫地平组和复方景川片低、中、高剂量组,每组10 只。按成人等效剂量,尼莫地平给药剂量为0.012 g/kg;复方景川片低、中、高剂量组分别给予复方景川片0.78、1.56、3.12 g/kg。造模前7 d 开始各给药组灌胃给药,1 次/d,给药体积10 mL/kg,连续10 d。空白对照组和模型组灌胃等体积纯净水。
1.2.2 动物模型制备 采用Longa线栓法制备大鼠大脑中动脉闭塞模型[6-7]。空白对照组只分离血管,不结扎不插栓线。模型组、尼莫地平组和复方景川片中剂量组各有1只大鼠在实验过程中死亡,予以舍弃。
1.2.3 神经行为学评价 (1)神经功能评分:造模48 h 后采用Longa 评分法[8]对各组大鼠神经功能缺损情况进行评定,分值0~4分,得分越高,神经功能越差。(2)横木行走实验:取长1.2 m、宽和高均为2.5 cm的横木,水平放置于距地面0.6 m处,在末次给药1 h 后,进行横木行走实验[7],并对其脑缺血损伤后运动行为能力进行评定,横木行走实验满分为6分,得分越高表示运动能力越差。
1.2.4 脑组织处理 造模48 h后,10%水合氯醛(3.5 mL/kg)腹腔注射麻醉大鼠,迅速断头取脑组织,部分新鲜组织低温冻存,余固定于4%多聚甲醛。固定24 h后冠状面取材,切取包括大脑皮质和海马区在内的组织块,进行常规脱水、透明、浸蜡、包埋、切片,切片厚度为3 μm。
1.2.5 HE染色观察脑组织病理改变 切片依次经二甲苯脱蜡,梯度乙醇水化,放入苏木素染液4 min,盐酸乙醇分化,氨水返蓝,伊红染色1 min,梯度乙醇脱水,二甲苯透明,中性树脂封片。光学显微镜下观察脑组织病理改变。
1.2.6 免疫组化染色检测大脑皮质CD86和Arg1的定位及表达 常规石蜡切片脱蜡至水,滴加体积分数为3%的H2O2,室温孵育10 min 以阻断内源性过氧化物酶;微波加热修复抗原,用质量分数为50 g/L的牛血清白蛋白封闭20 min;滴加兔抗CD86多克隆抗体或兔抗Arg1多克隆抗体(1∶100),4 ℃过夜;磷酸盐缓冲液(PBS)冲洗后加入生物素化山羊抗兔IgG抗体,37 ℃孵育20 min;PBS 冲洗后加入SABC,37 ℃孵育20 min;PBS 冲洗后加入二氨基联苯胺显色;苏木素复染,乙醇脱水,二甲苯透明,中性树胶封片。每张切片于光学显微镜下随机读取3 个视野,采用NIS-BRML 图像分析系统采集图像并分析,记录灰度平均值。
1.2.7 Western blot 检测脑组织CD86 和Arg1 的蛋白表达水平 各组取3 只大鼠,将缺血皮质脑组织切成小块,加入RIPA 裂解液匀浆、裂解 30 min,4 ℃下 12 000 r/min 离心5 min,提取样品中总蛋白,并检测总蛋白含量。蛋白变性后在10%SDS-PAGE中进行电泳后采用半干法转移到PVDF膜上,封闭2 h,加入一抗CD86(1∶1 000),Arg1(1∶5 000),置于4 ℃条件下孵育过夜。加入HRP 标记二抗(1∶50 000),使PVDF 膜浸泡于二抗孵育液,室温摇床孵育2 h 后洗膜,除去游离二抗。添加ECL 工作液,待荧光带明显后,吸去多余的底物液,覆上保鲜膜,X线片压片后依次放入显影液显影、定影液定影,冲洗晾干后扫描胶片。用Imageproplus 软件分析胶片光密度值,以CD86、Arg1 与β-actin 的光密度比值反映其蛋白表达水平。
1.3 统计学方法 采用SPSS 17.0软件进行数据分析。符合正态分布的计量资料用均数±标准差()表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 神经行为学改变 与空白对照组比较,模型组大鼠神经功能评分、横木行走评分均显著增高(P<0.05),大鼠出现明显的神经功能损伤和行为能力下降。与模型组比较,各给药组神经功能评分、横木行走评分均显著降低(P<0.05);与低剂量组比较,高剂量组神经功能评分明显降低(P<0.05),见表1。
Tab.1 Comparison of scores of nerve function and crossbar walking test between the six groups表1 各组大鼠神经功能评分和横木行走实验评分比较(分,)

Tab.1 Comparison of scores of nerve function and crossbar walking test between the six groups表1 各组大鼠神经功能评分和横木行走实验评分比较(分,)
**P<0.01;a与空白对照组比较,b与模型组比较,c与复方景川片低剂量组比较,P<0.05
组别空白对照组模型组复方景川片低剂量组复方景川片中剂量组复方景川片高剂量组尼莫地平组F n 10 9 10 9 10 9神经功能评分0.00±0.00 3.22±0.67a 2.60±0.70ab 2.44±0.73ab 1.90±0.57abc 2.11±0.60ab 33.504**横木行走评分0.00±0.00 4.67±0.87a 3.30±0.82ab 2.89±0.78ab 2.60±0.97ab 3.00±0.87ab 36.571**
2.2 大脑皮质病理改变 HE 染色结果显示,空白对照组大脑皮质神经元、胶质细胞及毛细血管形态正常,结构完整,核仁清晰,胞浆无红染。模型组缺血侧大脑皮质神经元大片消失,锥体细胞明显减少,细胞间隙增宽,排列紊乱,胞体变小,尼氏小体消失,变性坏死后形成大量空泡,同时可见小胶质细胞/巨噬细胞增生较明显。各给药组缺血侧大脑皮质病变减轻,坏死神经元减少,正常锥体细胞数量增多,形态结构趋于正常,细胞核较规则,仍见小胶质细胞/巨噬细胞增生,水肿较轻,尤以高剂量组和尼莫地平组减轻较明显,其次为中剂量组和低剂量组,见图1。

Fig.1 Pathological changes on cerebral cortex of rats in six groups(HE staining,×200)图1 各组大鼠大脑皮质病理改变(HE染色,×200)
2.3 各组免疫组化染色结果
2.3.1 大脑皮质CD86表达及定位 CD86阳性表达为棕黄色或褐色,定位于细胞膜,阳性细胞为小胶质细胞/巨噬细胞。空白对照组大脑皮质可见CD86少量表达。与空白对照组比较,模型组及各给药组CD86 表达水平明显增加(P<0.05)。与模型组比较,各给药组CD86 表达水平降低,其中复方景川片高剂量组相比中、低剂量组降低较为明显(P<0.05),见图2、表2。

Fig.2 The expressions of CD86 on cerebral cortex in six groups of rats(immunohistochemical staining,×400)图2 各组大鼠大脑皮质CD86表达(免疫组织化学染色,×400)
2.3.2 大脑皮质Arg1 表达及定位 Arg1 阳性表达亦为棕黄色或褐色,定位于细胞浆,阳性细胞为小胶质细胞/巨噬细胞。空白对照组仅见极少量小胶质细胞/巨噬细胞表达Arg1。与空白对照组比较,模型组Arg1 表达水平明显升高(P<0.05)。各给药组与模型组比较,Arg1 表达均有所增加,其中尼莫地平组、复方景川片高剂量组Arg1 表达增加明显(P<0.05);复方景川片不同剂量组间比较发现高剂量组较中、低剂量组阳性表达明显增加(P<0.05),见图3、表2。

Fig.3 The expressions of Arg1 on cerebral cortex in six groups of rats(immunohistochemical staining,×400)图3 各组大鼠大脑皮质Arg1表达(免疫组织化学染色,×400)
Tab.2 Comparison of expression levels of CD86 and Arg1 between six groups of rats表2 各组大鼠CD86和Arg1表达水平比较(灰度值,)

Tab.2 Comparison of expression levels of CD86 and Arg1 between six groups of rats表2 各组大鼠CD86和Arg1表达水平比较(灰度值,)
**P<0.01;a与空白对照组比较,b与模型组组比较,c与复方景川片低剂量组比较,d与复方景川片中剂量组比较,P<0.05
组别空白对照组模型组复方景川片低剂量组复方景川片中剂量组复方景川片高剂量组尼莫地平组F n 10 9 10 9 10 9 CD86 132.98±8.40 97.75±6.14a 105.26±3.29a 118.59±10.38abc 117.42±5.66abc 112.58±9.60abc 24.639**Arg1 129.04±5.98 113.51±6.35a 110.24±8.18a 110.88±5.49a 100.42±7.01abcd 105.37±6.32ab 21.296**
2.4 各组脑组织CD86、Arg1表达水平比较 Western blot结果显示,与空白对照组比较,模型组及各给药组大鼠缺血皮质脑组织中CD86、Arg1的蛋白表达水平显著增高(P<0.05)。与模型组比较,尼莫地平组及复方景川片高、中剂量组CD86蛋白表达水平显著降低,各给药组Arg1 的蛋白表达水平均显著增高,差异有统计学意义(P<0.05)。复方景川片高、中剂量组CD86 蛋白表达水平低于低剂量组(P<0.05),高剂量组Arg1的蛋白表达水平较中、低剂量组明显增高(P<0.05),见图4、表3。

Fig.4 Protein expression levels of CD86 and Arg1 in ischemic cortex of rats图4 各组大鼠缺血皮质CD86、Arg1蛋白表达
Tab.3 Comparison of the protein expression levels of CD86 and Arg1 in ischemic cortex of rats表3 各组大鼠缺血皮质CD86、Arg1蛋白表达水平比较(n=3,)
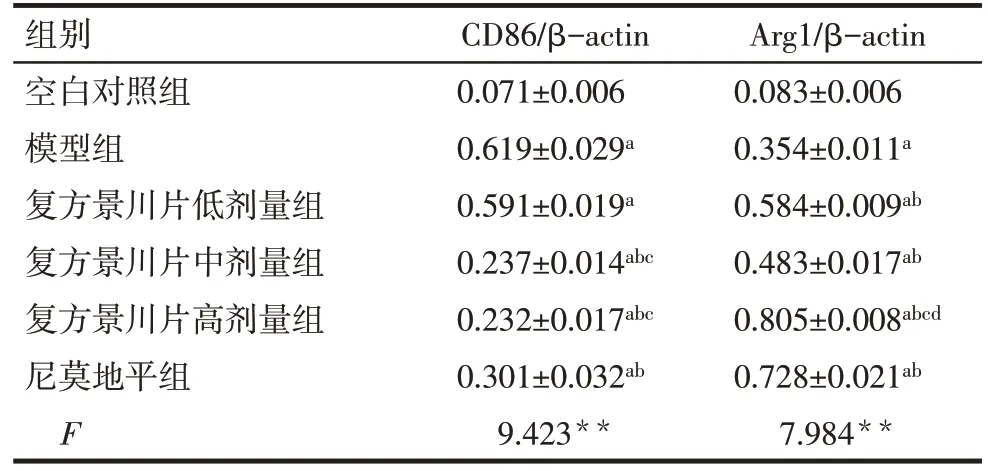
Tab.3 Comparison of the protein expression levels of CD86 and Arg1 in ischemic cortex of rats表3 各组大鼠缺血皮质CD86、Arg1蛋白表达水平比较(n=3,)
**P<0.01;a与空白对照组比较,b与模型组组比较,c与复方景川片低剂量组比较,d与复方景川片中剂量组比较,P<0.05
组别空白对照组模型组复方景川片低剂量组复方景川片中剂量组复方景川片高剂量组尼莫地平组F CD86/β-actin 0.071±0.006 0.619±0.029a 0.591±0.019a 0.237±0.014abc 0.232±0.017abc 0.301±0.032ab 9.423**Arg1/β-actin 0.083±0.006 0.354±0.011a 0.584±0.009ab 0.483±0.017ab 0.805±0.008abcd 0.728±0.021ab 7.984**
3 讨论
缺血性脑损伤属中医学“中风”范畴,多为气虚血滞、脉络瘀阻所致,其中缺血性脑卒中占85%左右,发病急,病死率高,给患者家庭带来沉重的负担。目前西医治疗缺血性脑损伤尚缺乏切实可行的方法,而中医药用于脑损伤的防治具有独特的优势[9]。复方景川片以“益气活血,化瘀通络”为原则,对缺血性脑损伤具有一定的治疗作用,可有效改善缺血性脑损伤大鼠的神经行为学功能,减少坏死神经元,且随着给药剂量的增加,疗效更加明显。
脑卒中后可导致继发性脑损伤和多器官功能障碍,而炎症介质失控性释放是这种改变的基础[10]。炎症反应在脑缺血病理生理过程中作用复杂,是一个动态变化过程。在炎症反应早期或急性期,诱导促炎基因表达,加重组织损伤;炎症反应晚期或亚急性和慢性期,可表现为损伤修复。从有害作用转变为有益作用的关键在于损伤程度和持续时间,这也成为决定药物治疗时间窗的核心[11]。炎症微环境会极大地影响小胶质细胞/巨噬细胞的表型变化,从而表现出不同的生物学功能。M1型小胶质细胞/巨噬细胞通过 TLR2-Sphk1、Janus 激酶 1/2(JAK1/JAK2)等信号通路,引起白细胞介素(IL)-1β、IL-17、IL-23和肿瘤坏死因子(TNF)-α 释放,加重脑组织损伤[12];而IL-4、IL-13等细胞因子可通过激活信号转导与转录激活因子(STAT)-6等信号通路促进M2型巨噬细胞表达[13]。M2 型巨噬细胞在大脑恢复过程中起促进作用,包括神经发生、轴突再生、血管生成、少突胶质细胞前体细胞生成和髓鞘再生等[14]。因此,小胶质细胞/巨噬细胞的极化状态在卒中引起的脑损伤中起关键作用,也是药物治疗的靶点。
CD86是M1型巨噬细胞的分子标志物[15]。本研究发现,模型组及各给药组CD86蛋白表达水平与空白对照组比较明显增加,表明大脑中动脉闭塞后可触发炎性机制,促进M1 型小胶质细胞/巨噬细胞的活化。各给药组CD86 蛋白表达水平明显低于模型组,表明药物干预后可降低M1 型小胶质细胞/巨噬细胞活化的程度,减轻了炎性损伤。M2型极化的特征在于高表达 Arg1、CD206、IL-4 等[3]。本研究发现,模型组及各给药组Arg1蛋白表达水平与空白对照组比较明显增加,表明大脑中动脉闭塞后亦可引起M2型小胶质细胞/巨噬细胞活化;但不同于CD86的表达,模型组中Arg1 蛋白表达水平低于各给药组,说明药物干预后增加了M2 型小胶质细胞/巨噬细胞活化的程度。结合形态学观察,坏死神经元数量减少,正常神经元数目增加,表明药物干预促进了M2 型活化,发挥其抗炎功能,增强神经保护作用。尤其复方景川片高剂量组和尼莫地平组Arg1 蛋白表达水平较模型组和空白对照组明显增强,表明此两组M2型小胶质细胞/巨噬细胞活化显著,与HE染色显示的脑组织病理改变结果一致,证实复方景川片对缺血性脑损伤具有神经保护作用,且作用的发挥与其对小胶质细胞/巨噬细胞极化的调控有关,可在一定剂量范围内抑制M1型极化,促进M2型极化。

