RITA通过ROS/Src/Stat3通路诱导肺鳞癌H226细胞凋亡
区豪杰,孙嘉,李华宇,董超,刘冰
肺癌在世界范围内发病率和病死率均位于各种恶性肿瘤之首[1],其中非小细胞肺癌(NSCLC)占肺癌的80%~85%。肺鳞癌是NSCLC 的亚型之一,约占30%。目前临床上针对表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)等驱动基因的靶向治疗药物对于肺鳞癌的治疗效果始终欠佳,且预后较差[2],故亟需研发治疗肺鳞癌的有效药物。肿瘤凋亡和P53再生化合物(RITA)是一种小分子抗肿瘤药物,对肿瘤细胞具有较强的杀伤作用[3]。相比传统化疗药物,RITA 结构更加稳定,在肿瘤细胞内作用时间更长,血药浓度更高[4]。既往研究认为RITA 能够与P53 结合并增强P53 介导的抑癌效应,诱导淋巴瘤[5]、人结肠癌[6]、慢性粒细胞白血病[7]等多种肿瘤细胞的凋亡。更重要的是,RITA能独立于P53引起肿瘤细胞内活性氧(ROS)增多,导致其发生氧化应激,进而诱导细胞凋亡[8-9]。目前RITA 对肺鳞癌细胞的作用尚少见研究报道,本研究拟明确RITA对肺鳞癌细胞的作用,检测其对ROS产生及其下游信号的影响以探讨其作用机制,为抗肺鳞癌新药研发提供新的科学依据。
1 材料与方法
1.1 试剂与仪器 RITA(结构式见图1)、抗氧化剂N-乙酰半胱氨酸(NAC)购自MCE公司。RPMI-1640培养基、胎牛血清、Trypsin-EDTA(0.25%)、Trypsin(不含EDTA,0.25%)均购自Gibco公司。苯甲基磺酰氟(PMSF)、磷酸盐缓冲液(PBS)、ECL 发光液购自Biosharp 公司。噻唑蓝四唑溴化铵(MTT)、ROS 检测探针 DCFH-DA 购自 Sigma-Aldrich 公司。Annexin V-FITC/PI 细胞凋亡检测试剂盒购自贝博生物科技公司。BCA 蛋白定量试剂盒购自Thermo Scientific 公司。SDSPAGE蛋白上样缓冲液购自Mikx公司。P-Src、Src、转录信号转换器和激活因子3(Stat3)、P-Stat3、Bim、Mcl-1、Survivin、Bax 及 B 淋巴细胞瘤-2(Bcl-2)等一抗抗体购自 ABclonal 公司。β-Tubulin 一抗、山羊抗兔IgG 二抗购自Cell Signaling Technology公司。

Fig.1 The structure of RITA图1 RITA结构
1.2 主要仪器 超净工作台购自安泰空气技术有限公司。CO2培养箱购自力康生物医疗公司。流式细胞仪、Multiskan FC全波长酶标仪购自Thermo Scientific公司。冷冻离心机购自Beckman coulter 公司。化学发光成像系统购自勤翔科学仪器有限公司。
1.3 方法
1.3.1 细胞培养 肺鳞癌细胞H226 和正常肺上皮细胞BEAS-2B 购自中国科学院上海细胞库。2 种细胞均于RPMI-1640培养基中培养,培养基含有质量分数为10%的胎牛血清,置于37 ℃、5%CO2加湿培养箱中培养,取对数生长期细胞用于后续实验。
1.3.2 细胞活力检测 采用MTT 法检测RITA 对H226 和BEAS-2B 细胞活力的影响。细胞以5×103个/孔的密度接种于96 孔板,分别用不同浓度RITA(0、0.025、0.05、0.1、0.15 和0.2 μmol/L)处理H226细胞24 h[7]。以不同浓度RITA(0、0.2、0.4、0.6、0.8、1 μmol/L)处理BEAS-2B细胞24 h。药物干预结束后,每孔中加入180 μL无血清培养基和20 μL质量浓度为0.5 g/L的MTT溶液,并37 ℃下避光孵育4 h。吸去液体,每孔加入150 μL 二甲基亚砜,用酶标仪在570 nm 下测量每孔的吸光度(A)并计算细胞活力。细胞活力=(A实验组-A空白组)/(A对照组-A空白组)。
1.3.3 ROS 水平检测 用DCFH-DA 探针标记H226 细胞内ROS 水平。将H226 细胞接种于60 mm 培养皿中,待细胞贴壁后给予不同浓度RITA(0、0.05、0.1和0.2 μmol/L)干预12 h。干预结束后,培养皿中加入浓度为10 μmol/L 的DCFH-DA,在37 ℃条件下避光孵育30 min。PBS 重悬3 次,流式细胞仪以488 nm的激发波长和525 nm的发射波长进行分析。
1.3.4 Annexin V-FITC/PI法检测细胞凋亡 将H226细胞接种于60 mm培养皿中,待细胞贴壁后给予不同浓度RITA(0、0.05、0.1 和0.2 μmol/L)干预处理24 h。药物干预结束后,用不含EDTA 胰酶消化并收集细胞。PBS 重悬2 次后,加入Annexin V 结合缓冲液并在避光条件下用5 μmol/L Annexin V-FITC 孵育15 min,然后加入10 μmol/L 碘化丙啶(PI)避光孵育5 min后上机分析。
1.3.5 Western blot 检测细胞中Src/Stat3 通路及凋亡相关蛋白表达 将H226细胞接种于6孔板中,待细胞贴壁后给予不同浓度RITA(0、0.05、0.1和0.2 μmol/L)干预处理24 h。给药干预结束后,加入细胞裂解缓冲液与质量分数为0.5%蛋白酶抑制剂混合物获得全细胞提取物。采用BCA 试剂盒测定蛋白浓度。取50 μg 蛋白进行聚丙烯酰胺凝胶电泳,浓缩胶电泳:恒压80 V,20 min。分离胶电泳:恒压120 V,60 min。330 mA 恒流转膜30 min 后,5%脱脂奶粉溶液室温封闭1 h。P-Src、Src、Stat3、P-Stat3、Bim、Mcl-1、Survivin、Bax、Bcl-2 及β-Tubulin 一抗(均1∶1 000 稀释)分别在4 ℃下孵育过夜,山羊抗兔IgG二抗(1∶10 000稀释)孵育1 h,使用ECL发光液显色。使用Image J 分析软件对目的蛋白和内参蛋白的灰度值进行分析。
1.3.6 NAC 对RITA 处理的细胞中ROS、凋亡及相关蛋白表达的影响 将H226 细胞接种于6 孔板中,待细胞贴壁后,分为空白对照组、5.0 mmol/L NAC 组、0.2 μmol/L RITA 组、0.2 μmol/L RITA 与 5.0 mmol/L NAC[10]联合用药组。分组处理12 h 后,检测细胞内ROS 含量;24 h 后检测细胞凋亡和相关蛋白的表达,检测方法同1.3.3~1.3.5。
1.4 统计学方法 采用GraphPad Prism 7.01进行数据分析,实验所得数据重复3 次并以均数±标准差()表示,计量资料多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 RITA 对 H226 细胞、BEAS-2B 细胞活性的影响 MTT 结果显示,0.05~0.2 μmol/L RITA 可抑制H226 细胞增殖活性,半抑制浓度(IC50)为(0.130±0.008)μmol/L(图2A);而在相同浓度条件下,RITA对人正常肺上皮细胞BEAS-2B 增殖无明显抑制作用(图2B)。
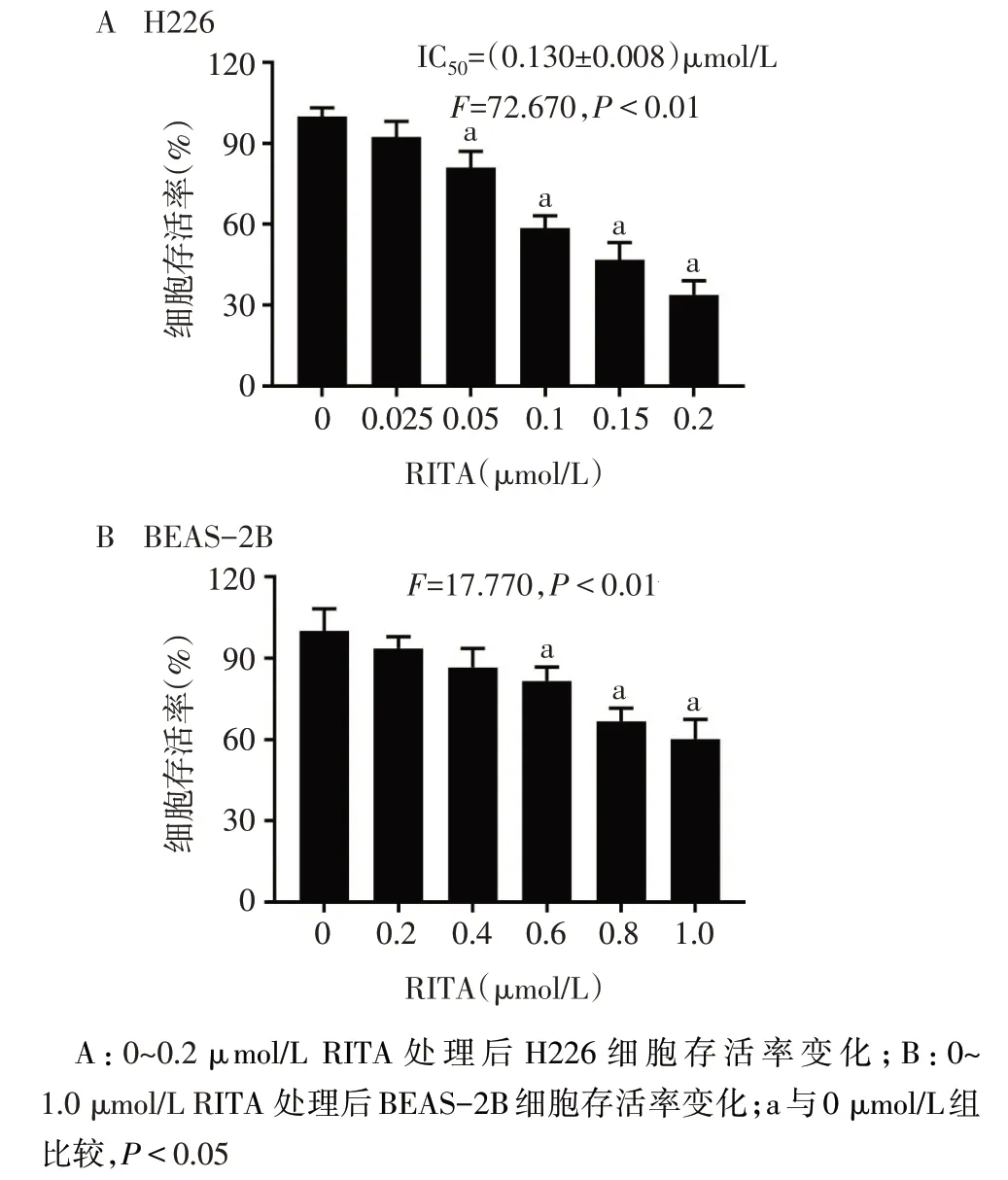
Fig.2 The effect of RITA on the survival rates of H226 and BEAS-2B cells图2 RITA对H226和BEAS-2B细胞存活率的影响
2.2 不同浓度RITA 对H226 细胞内ROS 水平的影响 0~0.2 μmol/L 范围内,随着RITA 的升高,H226细胞内ROS水平明显升高,见图3。

Fig.3 The effect of RITA on ROS activity in H226 cells图3 RITA对H226细胞内ROS活性的影响
2.3 RITA对H226细胞Src/Stat3通路相关蛋白表达及凋亡的影响 Western blot 结果显示,随着RITA浓度的升高,H226 细胞中 P-Src、P-Stat3 水平下降,抗凋亡蛋白Mcl-1、Survivin、Bcl-2表达下调,促凋亡蛋白Bim、Bax 表达上调,细胞凋亡率升高,见图4、5,表1。
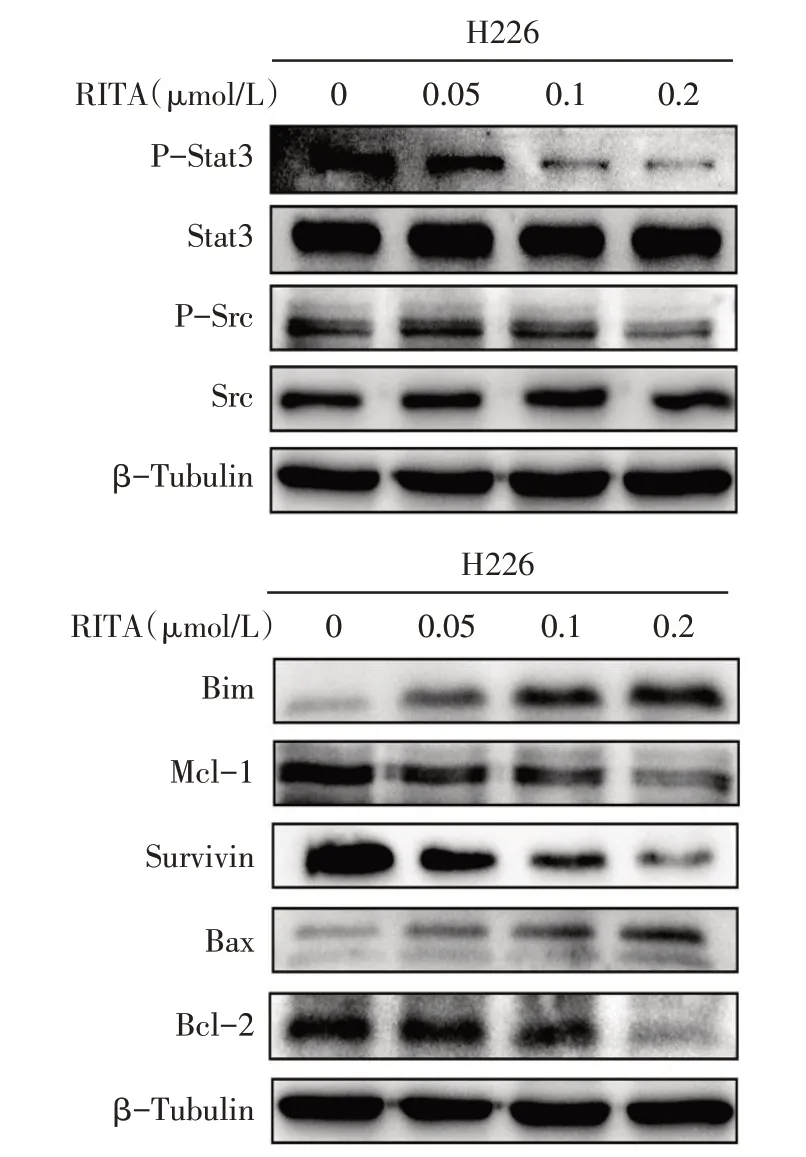
Fig.4 The changes of Src/Stat3 pathway and apoptosis-related protein expression in H226 cells after RITA treatment图4 RITA处理后H226细胞内Src/Stat3通路及凋亡相关蛋白表达变化
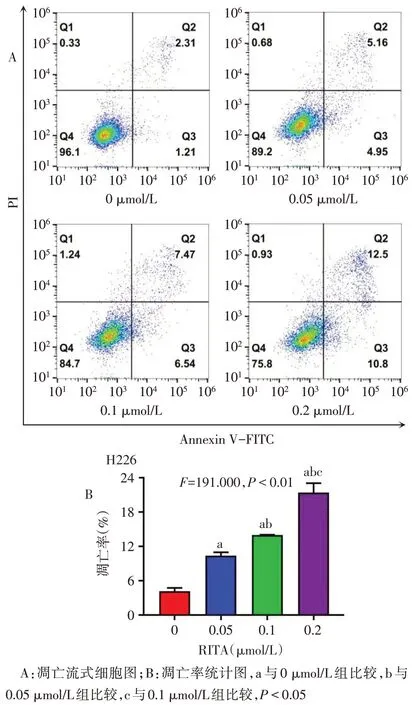
Fig.5 RITA induced the cell apoptosis of H226 cells图5 RITA诱导H226细胞凋亡
Tab. 1 Comparison of expression levels of Src/Stat3 pathway and apoptosis-related proteins in H226 cells treated with RITA表1 经RITA处理后的各组H226细胞内Src/Stat3通路及凋亡相关蛋白表达水平比较 (n=3,%,)

Tab. 1 Comparison of expression levels of Src/Stat3 pathway and apoptosis-related proteins in H226 cells treated with RITA表1 经RITA处理后的各组H226细胞内Src/Stat3通路及凋亡相关蛋白表达水平比较 (n=3,%,)
**P<0.01;a与0 μmol/L组比较,b与0.05 μmol/L组比较,c与0.1 μmol/L组比较,P<0.05
组别0 μmol/L组0.05 μmol/L组0.1 μmol/L组0.2 μmol/L组F P-Stat3 100.00±1.04 65.69±9.37a 19.25±4.61ab 7.67±2.55abc 125.000**Stat3 100.00±6.86 100.26±2.42 102.96±2.33 102.49±2.74 0.278 P-Src 100.00±3.72 94.85±1.96 86.30±5.27a 56.55±13.30abc 13.580**Src 100.00±12.91 102.38±2.63 104.75±1.49 102.83±4.94 0.152 Bim 100.00±12.22 159.18±11.23a 248.13±24.81ab 310.93±19.83abc 54.420**Mcl-1 100.00±5.60 84.89±8.97 74.86±6.42a 62.41±1.98ab 12.880**Survivin 100.00±13.51 65.94±8.37a 46.06±5.45ab 26.51±4.63abc 25.900**Bax 100.00±4.73 147.23±5.99a 195.42±15.55ab 255.15±19.18abc 52.840**Bcl-2 100.00±7.75 75.79±6.22a 52.32±2.92ab 37.05±3.41abc 51.100**
2.4 NAC 对 RITA 引起 H226 细胞内 ROS 上升的影响 RITA(0.2 μmol/L)与NAC(5.0 mmol/L)同时给药干预12 h 后,NAC 能够有效地逆转RITA 引起H226细胞内ROS的上升,见图6。
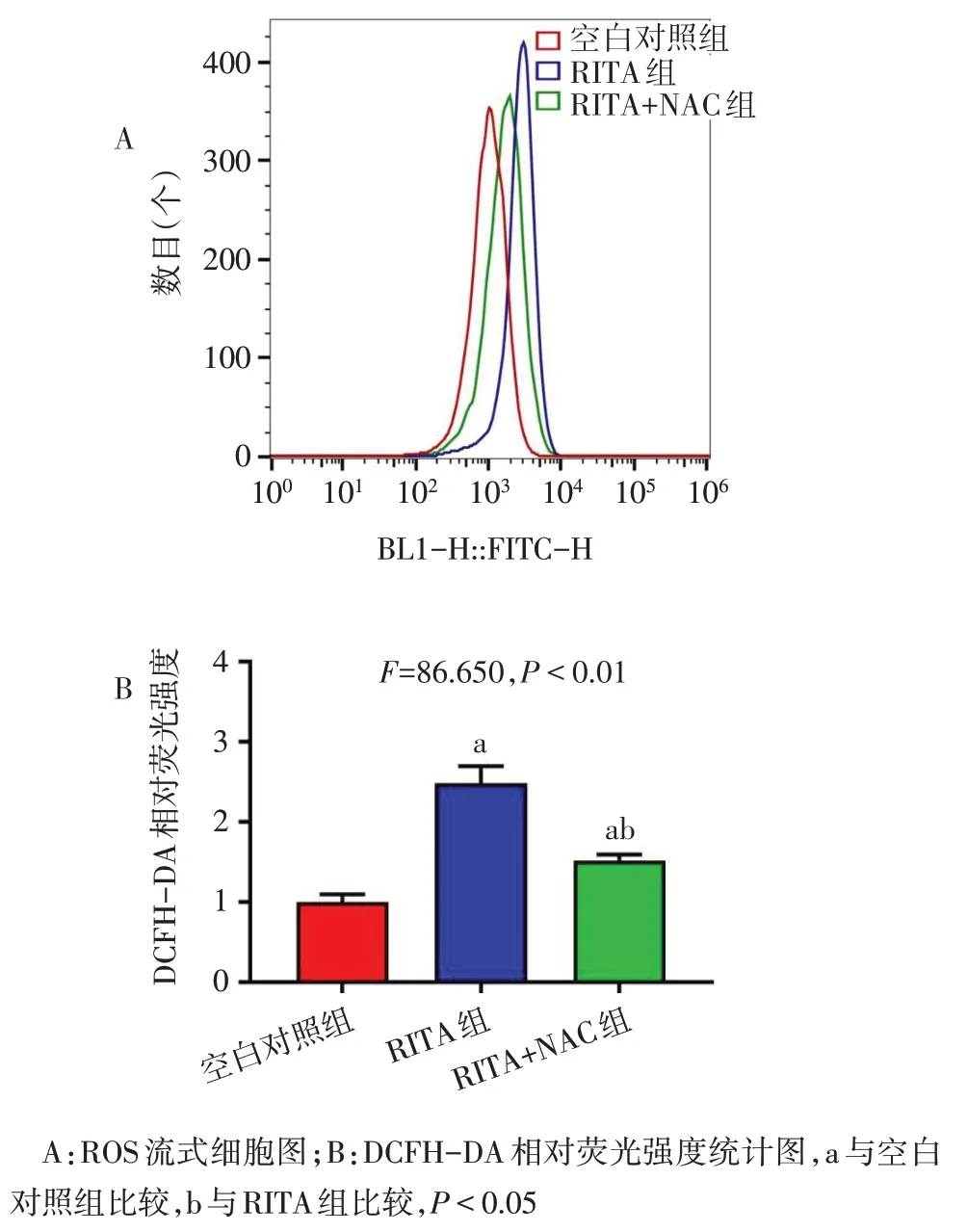
Fig.6 NAC decreased the increase of ROS caused by RITA in H226 cells图6 NAC减少RITA引起H226细胞内ROS的升高
2.5 NAC 对 RITA 抑制 Src/Stat3 通路活性及诱导H226 细胞凋亡的影响 Western blot 结果显示,与RITA 组相比,RITA+NAC 干预后,P-Src、P-Stat3 及抗凋亡蛋白Mcl-1、Survivin、Bcl-2表达水平增高,促凋亡蛋白Bim、Bax 的表达水平减少,见表2、图7。此外,流式细胞术结果发现NAC 能够逆转RITA 诱导的H226细胞凋亡,见图8。
Tab.2 Comparison of protein expression results related to apoptosis rate of H226 cells in each group表2 各组H226细胞凋亡相关蛋白表达结果比较 (n=3,%,)

Tab.2 Comparison of protein expression results related to apoptosis rate of H226 cells in each group表2 各组H226细胞凋亡相关蛋白表达结果比较 (n=3,%,)
*P<0.05,**P<0.01;a与空白对照组比较;b与NAC组比较,c与RITA组比较,P<0.05
组别空白对照组NAC组RITA组RITA+NAC组F P-Stat3 100.00±6.10 93.81±3.08 14.25±2.06ab 32.71±1.50abc 279.700**Stat3 100.00±13.65 102.95±0.98 102.98±2.97 103.06±4.32 0.084 P-Src 100.00±12.59 93.62±8.19 35.28±4.95ab 70.88±12.52c 16.820**Src 100.00±8.49 96.98±8.04 102.91±6.16 103.25±5.24 0.339 Bim 100.00±4.64 120.86±9.31 262.26±36.69ab 120.99±5.71c 9.492**Mcl-1 100.00±18.45 95.23±4.51 47.20±7.87ab 101.34±5.70c 11.840**Survivin 100.00±2.17 99.74±3.69 63.78±3.32ab 100.69±7.77c 29.470**Bax 100.00±16.43 91.72±11.93 157.33±25.37ab 97.81±11.58c 6.297*Bcl-2 100.00±26.15 95.39±4.16 55.10±2.37ab 82.43±8.84c 4.148*
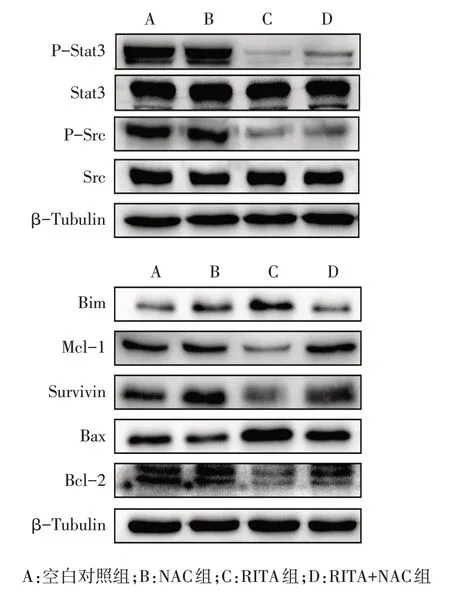
Fig.7 NAC reversed the changes of Src/STAT3 pathway and apoptosis-related protein expression induced by RITA in H226 cells图7 NAC逆转RITA对H226细胞Src/Stat3通路及凋亡相关蛋白表达的影响
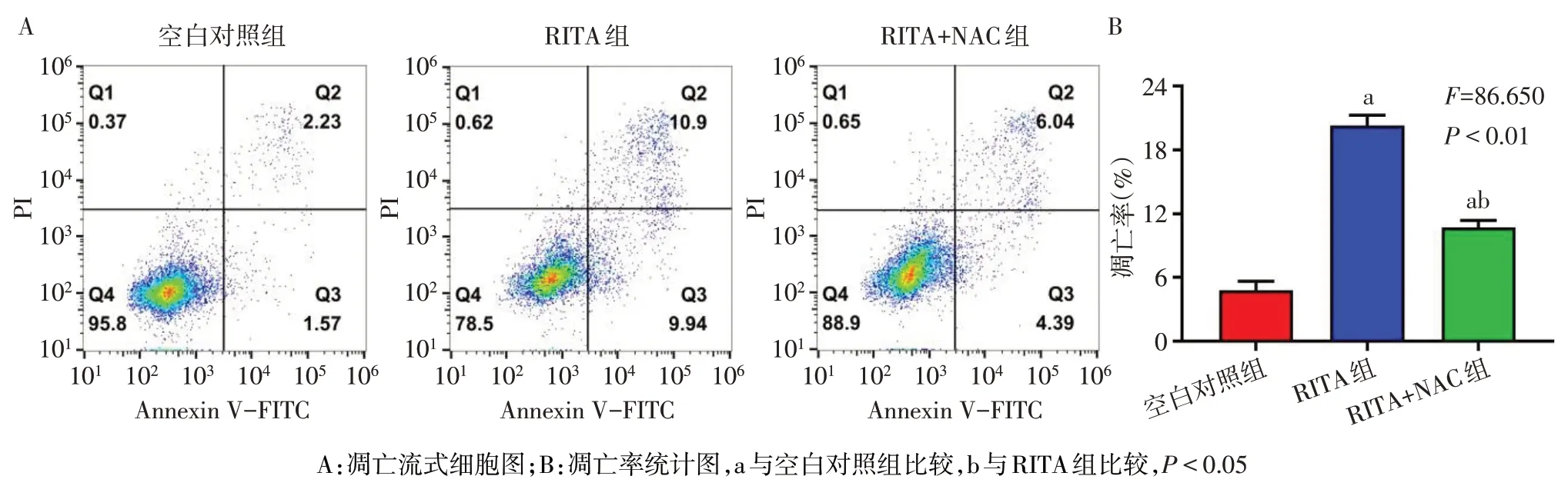
Fig. 8 NAC reversed RITA induced apoptosis of H226 cells图8 NAC减少RITA诱导H226细胞的凋亡效应
3 讨论
临床上治疗肺鳞癌多以化疗为主,而针对EGFR、ALK 和ROS1等驱动基因的靶向药物的治疗效果始终不佳[11]。本研究发现,RITA 对 H226 细胞具有良好的抑制作用,而在相同浓度条件下,RITA对人正常肺上皮细胞BEAS-2B 增殖无明显抑制作用,提示RITA 对肺鳞癌细胞具有选择性杀伤作用,可能是治疗肺鳞癌的潜在药物。
既往研究发现,RITA 除了激活P53 蛋白表达外,还能引起细胞内ROS 上升,导致氧化应激,从而诱导肿瘤细胞的凋亡[8-9],均提示氧化应激可能是RITA 诱导细胞凋亡的重要潜在机制。ROS 作为信号分子参与许多癌症生物学过程,包括细胞增殖、细胞周期停滞和细胞凋亡等。与正常细胞相比,癌细胞通常具有较高的ROS 水平,这对于癌细胞增殖及凋亡抵抗起着重要作用[12]。此外,癌细胞对细胞内ROS 的改变更为敏感[13]。肿瘤细胞内 ROS 的显著增加会破坏氧化还原平衡,从而引起细胞损伤,持续的损伤最终诱导肿瘤细胞的凋亡。因此,通过破坏细胞内ROS平衡可能是治疗癌症的有效途径。NAC是经典的抗氧化剂,可有效消除细胞内ROS[14]。本研究结果表明,在0~0.2 μmol/L 范围内,随着 RITA的升高,H226 细胞内ROS 水平上升,细胞凋亡率增加。与单独给药RITA 相比,RITA 与NAC 联用后,H226细胞内ROS水平及细胞凋亡率显著降低,提示RITA 可能通过促使H226 细胞内ROS 的失衡,从而引起细胞氧化应激,诱导凋亡。这可能是RITA抗肿瘤的一个新的作用机制。
细胞内ROS 水平失衡可引起细胞内氧化应激,进而抑制 Src/Stat3 通路活性,导致细胞凋亡[15-16]。因此细胞内过多ROS的产生在抑制Src/Stat3信号转导中起着关键作用。Src 是一种非受体蛋白酪氨酸激酶,其广泛存在于组织细胞中,参与肿瘤的发生发展;而Stat3是肿瘤发生的关键转录因子,也是Src靶向调节的下游细胞因子[17]。Src/Stat3通路是调控癌症细胞增殖和生存的重要细胞信号,激活的Stat3蛋白最终传递到细胞核,促进Survivin 和Bcl-2 的转录、翻译,使肿瘤细胞产生抗凋亡作用[18]。更重要的是,Src/Stat3通路的激活会导致肺癌细胞增殖、抗凋亡、产生耐药和转移等一系列生物效应[19]。本研究发现,RITA 可呈剂量依赖性减少 P-Src、P-Stat3,降低抗凋亡蛋白Mcl-1、Survivin、Bcl-2 的表达及增加促凋亡蛋白Bim、Bax 的表达,并伴随肺鳞癌细胞凋亡的增加。使用NAC后,RITA抑制Src/Stat3通路活性及诱导H226 细胞凋亡的效应被逆转,表明RITA通过引起ROS 水平上升,进而抑制Src/Stat3 通路活性。
综上所述,RITA 通过引起肺鳞癌H226 细胞内ROS水平上升,从而产生细胞氧化应激,细胞内氧化还原平衡被打破,进一步抑制Src/Stat3 信号通路激活,最终诱导肺鳞癌细胞凋亡。

