温针灸对膝骨关节炎大鼠软骨组织ADAMTS-4及MMPs-3的影响
江 润,张 涛,毛 珍,张红星
(1.武汉协和江北医院风湿科,武汉 430100;2.武汉协和江北医院康复疼痛科,武汉 430100;3.湖北中医药大学针灸骨伤学院,武汉 430061)
膝骨关节炎(knee osteoarthritis,KOA)是一种临床常见的疾病,以关节软骨、韧带、包膜和肌腱等退化为病理表现[1-2]。本病发病机制复杂,多与遗传、代谢、年龄等因素密切相关[3-4]。研究表明,ADAMTS-4、MMPs-3 为关节软骨外基质的水解酶,参与关节软骨的降解,是关节退化的重要标志[5]。故本次研究拟观察温针灸对膝骨关节炎大鼠关节软骨组织ADAMTS-4、MMPs-3 的影响,探讨其作用机制。
1 材料与方法
1.1 实验材料 选取6~8 周龄雄性SPF 级SD 大鼠(180±20)g,40 只,均购于三峡大学实验动物中心,合格证号SCXK(鄂)2017-0012,喂养于华中科技大学同济医学院动物实验中心SYXK(鄂)2016-0057。饲养于SPF 级动物房,室温20~25 ℃。本次实验由华中科技大学同济医学院动物福利委员会许可。所有动物适应性喂养1 周后,随机分为正常组10 只(不做任何处理),模型组30 只。水合氯醛(国药集团公司,批号:32584210),单碘乙酸盐(北京欧北生物科技有限公司,批号:408251756);ADAMTS-4 抗体(美国ASPEN 公司,批号:HS-320145),MMPs-3 抗体(武汉三鹰,批号:125847-2-ap);HRP 标记羊抗兔二抗(上海生工生物有限公司,D110058 )。华佗牌一次性无菌毫针,规格0.25×25 mm(江苏医疗机械用品有限公司);艾柱(南阳金堂艾制品有限公司);自制鼠衣及固定装置;电泳仪(北京市六一仪器厂,型号:DYY-6C);酶标仪(Diatek 公司,型号:DR-200Bs);转移电泳仪槽(北京市六一仪器厂,型号:DYCZ-400D);X 线检测设备(美国ASPEN 公司出厂)。
1.2 动物造模及分组 采用经典KOA动物造模方法,膝关节腔内注射木瓜蛋白酶溶液制备KOA大鼠模型[6]。具体操作:所有大鼠,用10%水合氯醛,0.03 mL/g,腹腔注射麻醉,对大鼠双侧膝关节附近的鼠毛进行清理,将膝关节处于屈曲45°;将4%木瓜蛋白酶溶液0.1 mL 注射到除正常组以外大鼠双侧膝关节腔内,隔日1 次,连续2 周。正常组,以同样的方式,注射9%生理盐水0.1 mL。造模2周后,采用X线进行模型鉴定。
造模成功标志。KOA 大鼠X 线示关节软骨退化,胫骨平台欠光滑,关节间隙变窄,或伴有唇样骨赘。本次实验造模成功26 只,造模成功率86.67%。造模过程中,所有大鼠均正常饮食、自由摄水。将造模成功的大鼠分为模型组(8 只,仅造模),温针灸组(9 只,造模后给予干预),针刺组(9 只,造模后,给予干预)。
1.3 方法 温针灸组大鼠穿上自制鼠衣后,固定在装置上,将双侧膝关节弯曲45°,充分暴露关节腔。参照《实验针灸学》[7]取“后三里”和“膝前穴”。皮肤常规消毒,取0.25×25 mm 针具迅速刺入,刺入深度3~5 mm,停止进针;将艾柱置于针柄,点燃艾柱,燃尽后,换另一壮,每次2 壮,连续治疗10 d。针刺组仅给予针刺,不作艾灸处理,方法同温针灸组。正常组与模型组不做任何处理。
1.4 观察指标
1.4.1 膝关节厚度及被动活动度 关节被动活动度=最大屈曲角度-最大伸展角度。
1.4.2 关节液中IL-6、TNF-α含量 采用ELISA法检测。最后一次治疗后,大鼠用戊巴比妥钠麻醉后,用注射器抽取2 mL 生理盐水注射到大鼠双侧膝关节腔内,被动活动膝关节数次,抽取关节滑液,离心后取上层清液,于-80 ℃冰箱备用。按照ELISA 试剂盒操作说明,检测关节液中IL-6、TNF-α 含量。
1.4.3 软骨组织中ADAMTS-4、MMPs-3 蛋白含量 采用Western blot 检测法。摘取大鼠双侧膝关节,剥离软骨组织,将软骨组织粉碎;将少量软骨组织加入0.5 mLRIPA 裂解液后,于2 ℃下15 000 r/min 离心10 min,取上清液;用DR-200Bs 酶标仪测定蛋白浓度,对待测蛋白进行上样,依次完成电泳、转膜、封闭及免疫印迹显色等步骤。采用Image J 软件分析条带灰度值。
1.4.4 滑膜组织中ADAMTS-4、MMPs-3 的mRNA 表达 取少量滑膜组织于液氮中研磨成粉末,用Trizol试剂提取组织RNA,并测定RNA 浓度;将提取的RNA 样品进行cDNA 合成;将cDNA 样品置于RTPCR 反应体系进行PCR 扩增;以GAPDH 作为内参,选用待测mRNA 相对含量。PCR 引物列表见表1。

表1 引物序列情况
1.5 统计学方法 数据采用SPSS 22.0软件进行分析,先采用ShaPiro-Wilk 检验法对数据进行正态性检验,若符合正态分布,采用均数±标准差()表示。多组间比较,采用单因素方差分析,若组间有差异,采用Bonferroni 法进行两两比较;若不符合正态分布,选择Kruskal-Wallis 检验。计数资料,采用卡方检验。
2 结果
2.1 正常组与模型组膝关节X 线检查结果 正常组关节间隙正常,关节软骨厚度适中;模型组关节间隙变窄,伴轻度骨赘,软骨变薄。表明膝骨关节炎模型造模成功。
2.2 各组膝关节厚度及被动活动度 见表2。

表2 各组膝关节厚度及被动活动度比较
2.3 各组大鼠关节液中IL-6、TNF-α 含量 见表3。
表3 各组大鼠关节液中IL-6、TNF-α 含量()μg/L

表3 各组大鼠关节液中IL-6、TNF-α 含量()μg/L
注:与正常组比较,# P <0.05;与模型组比较,△P <0.05
2.4 各组大鼠软骨组织中ADAMTS-4、MMPs-3 蛋白表达 见表4、图1。
表4 各组大鼠滑膜组织ADAMTS-4、MMPs-3 蛋白相对含量()
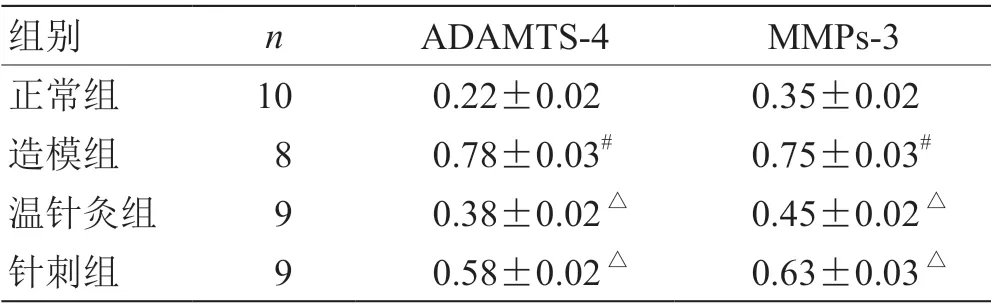
表4 各组大鼠滑膜组织ADAMTS-4、MMPs-3 蛋白相对含量()
注:与正常组比较,# P <0.05;与模型组比较,△P <0.05

图1 各组大鼠滑膜组织ADAMTS-4、MMPs-3 蛋白表达情况
由表4、图1 可知,与正常组比较,造模组ADAMTS-4、MMPs-3 含量升高,P<0.05;与针刺组比较,温针灸组ADAMTS-4、MMPs-3 含量更低,P<0.05。
2.5 各组大鼠滑膜组织中ADAMTS-4、MMPs-3 的mRNA 相对表达 见表5。
表5 各组大鼠滑膜组织ADAMTS-4、MMPs-3 的mRNA 相对含量()

表5 各组大鼠滑膜组织ADAMTS-4、MMPs-3 的mRNA 相对含量()
注:与正常组比较,# P <0.05;与模型组比较,△P <0.05
3 讨论
随着人口老年化趋势,膝骨关节炎的发病率日益增加[8-9]。当前西医对本病多采用药物(非甾体抗炎药)治疗、手术治疗等,但手术疗法容易造成二次损伤,药物服用容易产生依赖性,这些疗法只能暂时缓解患者的症状[10]。温针灸作为祖国医学的特色疗法,将针刺效应与艾灸的温热刺激结合,发挥温通经络,疏通气血之效[11]。大量研究证明,温针灸治疗膝骨关节炎的有效性,但其作用机制尚未完全明确[12-13]。
ADAMTS-4 是一类参与膝关节软骨退化的酶类[14]。研究[15]表明,如果对小鼠ADAMTS-4 基因进行敲除,小鼠膝骨关节炎发病率明显降低。关节软骨受机械摩擦长期刺激,会激活ADAMTS 系统,导致ADAMTS-4 含量增加,从而加速软骨破坏,使软骨变硬变薄。体外软骨细胞培养表明,膝骨关节炎早期ADAMTS-4 是参与聚蛋白多糖酶裂解的主要酶类,给予ADAMTS 抑制剂,聚蛋白多糖降解受到抑制[16]。因此调节ADAMT 活性可以作为防治KOA 的新靶点。MMPs-3 作为MMPS 家族成员,由软骨细胞分泌,存在于软骨细胞外基质,降解蛋白、多糖等物质,参与关节软骨的破坏[17]。研究[18]表明,MMPs-3 并非单一作用,若MMPs-3 含量增多,能激活其他MMPs 成员,产生联合反应,加速关节软骨的破坏,MMPs-3 代谢产物能诱导T 细胞活化,产生多种细胞因子,加重炎症反应。研究[19]表明,在膝骨关节炎不同阶段,关节软骨内的滑膜细胞和软骨细胞存在大量的MMPs,关节软骨的抗应力因此下降,骨代谢异常,诱导软骨细胞发生凋亡,细胞基质加速降解,最终导致关节退变。史广强等[20]研究发现,膝骨关节炎患者血清MMP-3水平均明显高于健康人群,MMPs-3 分泌失衡是引起关节软骨退行性变的主要原因。因此,在KOA 的发病过程中,MMPs-3 是促进关节滑膜炎症、关节软骨降解最重要的酶,也是反映关节软骨退变程度的重要标志物。IL-6、TNF-α 为一类促炎性细胞因子,能介导免疫和炎症反应,能诱导滑膜细胞、软骨细胞分泌ADAMTS-4、MMPs-3,从而增强炎症反应,加速软骨退化[21]。本次研究中,温针灸组KOA 大鼠关节炎中IL-6、TNF-α 含量均低于造模组,表明温针灸能减轻KOA 大鼠关节液中的炎性反应。在滑膜组织中,温针灸组大鼠ADAMTS-4、MMPs-3 蛋白表达及mRNA 相对含量均低于造模组、针刺组。由此可知,温针灸对KOA 大鼠的作用机制可能是通过抑制ADAMTS-4、MMPs-3 表达减轻炎症反应,从而减少膝关节厚度,增大膝关节被动活动度。

