受精第3日发育滞后胚胎冻融胚胎移植的临床结局研究
邱佩嫦 陈彩蓉 况玉兰 赵晓英 王秋香 李艳红 陈婉乐
广州医科大学附属第六医院(清远市人民医院)生殖中心,广东清远 511518
在实施体外受精-胚胎移植(in vitrofertilization and embryo transfer,IVF-ET)技术的过程时,经常可遇到形态正常但分裂速率较慢、卵裂球数目较少的胚胎。受精第3日(D3)卵裂球<6 个、受精第4日卵裂球<8 个的胚胎称为滞后胚胎[1]。滞后胚胎移植后种植率和体外培养形成可利用囊胚的概率均低于D3 细胞胚胎[2-4]。滞后胚胎是否有用、如何有效利用滞后胚胎这两个问题在辅助生殖领域的仍未有统一意见。本研究目的是将D3 发育滞后胚胎移植到转换后第2天的子宫内膜中,以探索发育滞后胚胎的临床价值以及临床移植策略。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月—2020年3月广州医科大学附属第六医院(清远市人民医院)生殖中心收治的684 例冻融胚胎移植(frozen-thawed pmbryo transfer,FET)周期患者的临床资料。按照卵裂期胚胎评分系统[5]对D3 卵裂期胚胎质量进行评估,将卵裂期胚胎分成Ⅰ~Ⅳ级,本研究纳入到胚胎均为Ⅰ~Ⅲ级胚胎。按照D3 胚胎卵裂球数目分为A 组(4~5 个细胞)和B 组(7~9 个细胞)。A 组44 例,年龄26~42 岁,平均(35.50±4.34)岁;体重指数(body mass index,BMI)16~28 kg/m2,平均(21.91±2.78)kg/m2;不孕年限1~16年,平均(4.68±4.06)年;子宫内膜厚度8~15 mm,平均(10.41±1.88)mm;移植日雌二醇(estradiol,E2)值105.00~1373.00 pg/mL,平均(294.93±252.74)pg/mL;移植日孕酮(progesterone,P)值11.66~60.00 ng/mL,平均(23.85±13.60)ng/mL。B 组640 例,年龄22~43 岁,平均(34.20±5.77)岁;BMI 15~32 kg/m2,平均(21.90±2.75)kg/m2;不孕年限1~20年,平均(4.19±3.40)年;子宫内膜厚度8~18 mm,平均(10.75±2.19)mm;移植日E2值74.00~993.00 pg/mL,平均(285.95±203.01)pg/mL;移植日P值10.24~56.64 ng/mL,平均(24.56±15.12)ng/mL。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
A 组纳入标准:①采用常规方案进行控制性卵巢刺激(包括GnRH 激动剂方案和拮抗剂方案);②可利用胚胎≤3 个,且冻存的胚胎为D3 4~5 细胞Ⅰ~Ⅲ级的滞后胚胎。B 组纳入标准:①同期在本中心采用常规方案进行控制性卵巢刺激;②移植的胚胎为D3 7~9 细胞Ⅰ~Ⅲ级的胚胎。
两组排除标准:①既往移植周期≥3 次的患者;②相应取卵周期由于子宫内膜因素(子宫内膜息肉,子宫内膜薄,宫腔积液)取消移植的;③合并子宫肌瘤,子宫腺肌症以及子宫畸形的患者④男女双方或其中一方为染色体异常患者;⑤复发性流产的患者。
本研究所有患者及家属均签署知情同意书。
1.2 方法
1.2.1 胚胎评分标准 D3 按照卵裂期胚胎评分系统[5]对卵裂期胚胎质量进行评估,将卵裂期胚胎分成Ⅲ~Ⅳ级,本研究纳入到胚胎均为Ⅰ~Ⅲ级胚胎。
1.2.2 胚胎冷冻解冻 胚胎冷冻采用玻璃化冷冻解冻方法。
1.2.3 子宫内膜准备方案 子宫内膜准备方案包括自然周期方案和人工周期方案两种[6]。①自然周期FET:在自然月经周期第10 天开始通过阴道B 超和血清黄体生成激素监测排卵,至卵泡排出,排卵日当天为转换日。②人工周期FET:适用于自然周期无排卵的患者,从月经或撤退性出血的第2~3 天起,戊酸雌二醇(拜耳医药保健有限公司,国药准字J20171038,生产批号:581A)口服2~8 mg/d。8~14 d 后根据B 超监测子宫内膜厚度,酌情调整戊酸雌二醇剂量;当子宫内膜≥8 mm 时开始肌肉注射黄体酮注射剂(浙江仙琚制药股份有限公司,国药准字H33020828,生产批号:201112)40~60 mg/d,黄体酮首次注射日为转换日。A组在排卵日或子宫内膜转换日后第2 天进行胚胎解冻,当天移植,B 组在排卵日或子宫内膜转换日后第3天进行胚胎解冻移植,所有患者均移植两个D3 的卵裂期胚胎。
1.2.4 黄体支持方案 移植后常规予黄体酮注射液40~60 mg/d 肌肉注射,孕8 周减量,确认宫内妊娠后药物持续至胚胎移植后9~10 周或者黄体酮阴道缓释凝胶(默克雪兰诺有限公司,国药准字H20140552,生产批号C19136/A)90 mg/d,妊娠者维持至移植后8~10 周。
1.2.5 妊娠结局判定 ①未妊娠:从胚胎移植后14~15 d抽取静脉血,检查绒毛膜促性腺激素-β(Beta-human chorionic gonadotropin,β-HCG),若数值<10 U/L 为未妊娠;②生化妊娠:从胚胎移植后监测,血β-HCG 值出现短暂升高,幅度不定,随后很快降至10 U/L 以内,并且超声检查宫内及宫外未见孕囊的患者;③临床妊娠:胚胎移植后β-HCG 值升高(>10 U/L)且超声检查子宫内或宫外探及孕囊的患者;④单胎妊娠:子宫内仅见1 个孕囊的患者;⑤双胎妊娠:子宫内可见2 个孕囊的患者;⑥流产:经阴道超声检查证实子宫腔内有孕囊但在妊娠8 周以后行仍未探及胎儿心管搏动或虽然在妊娠8 周探及胎儿心管搏动但在妊娠12 周内(包括12 周)出现胎心搏动消失或者胎儿娩出的患者;⑦异位妊娠组:经过阴道超声检查或者经过手术、病理检查证实孕囊位于子宫腔以外部位的患者;⑧活产:妊娠28 周或以上活胎分娩者。
1.3 观察指标及评价标准
比较两组不孕因素、临床妊娠率、生化妊娠率、异位妊娠率、流产率、活产率、多胎(双胎)率和活胎分娩的新生儿出生体重。临床妊娠率=临床妊娠周期数/移植周期数×100%;活产率=活胎分娩周期数/移植周期数×100%;流产率=12 周内流产周期数/临床妊娠周期数×100%。
1.4 统计学方法
采用SPSS 20.0 统计软件进行数据分析,计量资料用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者不孕因素的比较
两组患者的不孕因素比较,差异无统计学意义(P>0.05)(表1)。
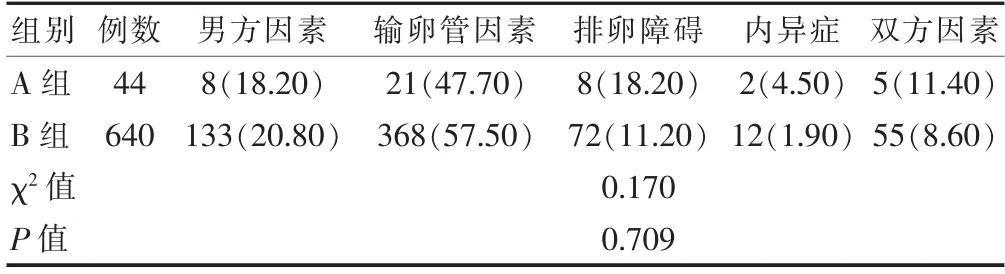
表1 两组患者不孕因素的比较[n(%)]
2.2 两组患者FET 周期妊娠结局的比较
A 组的临床妊娠率、活产率低于B 组,差异有统计学意义(P<0.05);A 组的生化妊娠率、异位妊娠率、流产率、多胎妊娠率(均为双胎)与B 组比较,差异无统计学意义(P>0.05);两组患者活胎分娩的新生儿出生体重比较差异无统计学意义(P>0.05)(表2)。两组多胎妊娠均为双胎妊娠,未见三胎或以上妊娠。

表2 两组患者FET 周期妊娠结局的比较[n(%)]
3 讨论
在IVF 治疗周期中,胚胎能否成功种植取决于胚胎质量、子宫内膜容受性以及胚胎与内膜的同步性[7]。目前临床上最常用的胚胎质量评价方法是卵裂期胚胎的形态学评估,包括细胞数、细胞均一性、碎片程度,有无多核细胞以及是否发生致密化融合现象等[8]。然而,即使是形态差、评分低的胚胎,仍然有一定的发育潜能。D3 4~5 个卵裂球的胚胎称为滞后胚胎,作为一种非优质胚胎,滞后胚胎在IVF 治疗周期中的应用价值存在争议。有研究表明,滞后胚胎进行FET 临床妊娠率可达15.9%~26.4%,活产率达14.2%~15.0%[9-12],可见,滞后胚胎仍具有一定的发育潜能。因此,对于IVF 治疗过程中可用胚胎少,无优质胚胎可供移植的患者,滞后胚胎仍具有一定的冷冻和移植的临床价值。
D3 4~6 细胞的滞后胚胎发育速度慢,发生染色体异常率高[13-14],对于滞后胚胎,临床上多采用延长体外培养时间的方法,对其进行二次挑选。然而,有学者对延长体外培养时间的做法持不同意见。实验表明,滞后胚胎体外培养的囊胚形成率和优质囊胚形成率均低于7~9 细胞的胚胎[15],着床率低[16],而且随着体外培养时间延长胚胎基因表达错误概率增多[17],囊胚移植后继发性别比例失衡和单卵双胎的风险增多[18]。因此,对于滞后胚胎来说,通过延长培养时间达到挑选有发育潜能的胚胎进行移植目的的做法仍有待商榷。
为提高D3 滞后胚胎的临床利用率,避免延长体外培养时间导致胚胎基因错误表达概率增加的风险,本研究从改善胚胎与子宫内膜同步性方面着手,将FET 周期中D3 4~5 个细胞的滞后胚胎解冻后移植到黄体酮转换后第2 天的子宫内膜中,获得一定的临床妊娠率和活产率,提示D3 4~5 个细胞胚胎与转换后第2 天的子宫内膜具有良好的同步性。本研究中A组的临床妊娠率以及活产率低于B 组,差异有统计学意义(P<0.05),这可能与滞后胚胎发育潜能不足有关,但对于可用胚胎少的不孕患者来说,移植滞后胚胎仍具有一定临床意义。
本研究结果提示,A、B 两组的生化妊娠率、异位妊娠率、流产率、多胎(双胎)妊娠率、活胎分娩的新生儿出生体重比较,差异无统计学意义(P>0.05),提示在胚胎成功种植后,D3 发育正常胚胎与滞后胚胎具有相似的临床结局,与Zhao 等[4]报道的滞后胚胎形成囊胚后妊娠结局与发育速度正常的胚胎结局一致,验证了本研究的安全性。
综上所述,在临床工作中,胚胎移植应当优先挑选发育速度正常,胚胎形态学评分高的胚胎进行移植。本研究提出的将D3 发育滞后胚胎移植到黄体酮转换后第2 天的子宫内膜中的方法可作为处理卵裂期发育滞后胚胎的备选方案,对于高龄、卵巢储备功能低下、可利用胚胎少的不孕症患者具有一定的临床意义,以减少资源浪费,减轻患者的精神和经济负担[19-20]。

