DWI在PVA微球肝动脉化疗栓塞疗效评价中的应用价值
1.安徽医科大学附属巢湖医院介入血管科(安徽 合肥 238000)
2.安徽医科大学附属巢湖医院影像科(安徽 合肥 238000)
朱 虎1,* 周桂荣2
肝癌是临床发病率较高恶性肿瘤之一,流行病学研究显示由于我国人口基数相对较高,肝癌发病以及死亡患者均居于全球首位,已经成为死亡率较高的第三大恶性肿瘤疾病[1]。虽然手术切除是肝癌治疗的有效方式,但是部分处于进展期或者肝脏功能损伤严重患者不能接受手术切除治疗,介入治疗是此类患者治疗重要方式[2]。肝动脉化疗栓塞是临床上肝癌治疗重要方式,对于改善患者预后以及减缓病灶生长具有积极意义,聚乙烯醇微球是肝癌栓塞治疗新型材料,在栓塞肝脏病灶供血动脉上作用显著[3]。聚乙烯醇微球肝动脉化疗栓塞是姑息性治疗的重要方式,患者需要多次治疗以及疗效评估,因此准确评估患者治疗效果对于其后续治疗方案制定意义重大[4]。磁共振扩散加权成像(diffusion-weighted imaging,DWI)为经由检测组织中水分子扩散运动影像学检查方法,其在化疗残留病灶检查上价值优异,加之其无创优点,被广泛应用于肿瘤化疗后疗效评估中[5]。DWI用于聚乙烯醇微球肝动脉化疗栓塞疗效评估中是否依然价值优异尚需要进一步明确,基于此,本研究在我院近期聚乙烯醇微球肝动脉化疗栓塞疗效评估中应用DWI,明确其在聚乙烯醇微球肝动脉化疗栓塞疗效评估中价值,为其后续临床应用提供参考意见。
1 资料与方法
1.1 一般资料以我院2015年12月至2020年6月期间收治80例行聚乙烯醇微球肝动脉化疗栓塞治疗患者为研究对象,纳入标准:肝癌患者病情确诊参照原发性肝癌诊断标准[6],且病情由血清检查、影像学检查以及病理检查予以证实;均行聚乙烯醇微球肝动脉化疗栓塞治疗;患者在治疗前后行DWI检查;精神意识正常,可以配合研究中治疗以及影像学检查;患者同意参与研究,且研究已经获得医院伦理会批准。排除标准:存在DWI检查禁忌证;伴凝血功能障碍、感染或者免疫功能异常者;肝癌已经广泛转移或者显示为弥漫型;并发其他肿瘤或者存在多器官功能衰竭者;治疗后随访期间失访者。80例患者中男43例,女37例;年龄32~81岁,平均年龄(56.94±11.28)岁;病灶位置:肝尾叶、肝右叶以及肝左叶分别为5、47、28例;病灶直径1.4~14.3cm,平均直径(7.26±2.36)cm;肝功能分级:Child-Pugh分级[7]A级与B级分别为38例和42例。
1.2 方法
1.2.1 磁共振检查 检查仪器为Siemens Trio 3.0T超导磁共振扫描仪,采用体部相控阵柔软线圈进行扫描。患者在进行检查前禁食禁水6~8h。以仰卧位进行肝脏扫描。相关参数设置:T1WI扫描选择快速绕向梯度回波序列,重复时间、矩阵、激励次数、回波时间、间隔、层厚、视野分别为180.0ms、320×320、2次、3.5ms、2mm、6.5mm、40cm×30cm;T2WI扫描选择呼吸触发快速自旋回波序列,重复时间、矩阵、激励次数、回波时间、间隔、层厚、视野分别为4500.0ms、256×256、2次、87.8ms、2mm、6.5mm、38cm×38cm;DWI扫描选择取单次激发自旋回波-平面回波,重复时间、矩阵、激励次数、回波时间、间隔、层厚、视野分别为4800.0ms、256×256、2次、120.0ms、2mm、6.5mm、45cm×45cm,扩散敏感梯度因子b值选择0、600、1000s/mm2,需要同时在XYZ三个方向施加上述敏感梯度脉冲。动态增强扫描则选择三维容积式插入法屏气检查序列,将10mL轧喷酸葡胺对比剂以肘静脉推注方式注入,速度为2.5mL/s,注入完成后需要追加生理盐水15mL,在完成注射后20、60以及120s时获得动脉期、门静脉期以及延迟期影像图。检查完毕后所有图像均需上传至工作站,由2位高年资影像学医师单独阅片,应用Function 2.0软件获得病灶直径最大层面感兴趣区实性结节表观扩散系数(apparent diffusion coefficient,ADC)值,需要尽可能避开血管、胆管以及存在伪影位置,同一病灶不同位置需要至少测定3次,最终结果为2位医师测定结果均值。
1.2.2 疗效评估 所有患者均在治疗前以及治疗后4个月接受磁共振检查,分析患者在进行治疗前后测定肿瘤ADC值,同时评估患者治疗后病灶复发、转移以及缓解情况,各种检查均需要在7d内完成。依据患者治疗后4个月磁共振检查结果以及相关瘤体评估标准[8]评估患者治疗效果,病情进展为治疗靶区直径之和增加值超过了开始随访时最小值的20%或者有新病灶出现,反之则可以定义为稳定。依据患者疗效将患者分为病情稳定组以及病情进展组,分析患者在进行治疗前后病灶信号特点以及ADC值。
1.3 观察指标分析患者治疗疗效,治疗前、后磁共振影像学特点,比较两组患者治疗前后ADC值以及肿瘤体积,分析ADC值与肿瘤体积相关性,ADC值对于患者疗效预测价值。
1.4 统计学方法本研究中数据采用SPSS20.0软件进行分析,表示为()形式计量资料,比较应用t检验,表示为例(%)形式计数资料采用χ2检验进行差异比较,相关性分析应用Pearson相关性分析,预测价值则应用ROC曲线予以分析,P<0.05为差异有统计学意义。
2 结 果
2.1 疗效评估分析聚乙烯醇微球肝动脉化疗栓塞治疗后4个月应用磁共振加权成像进行检查,80例患者中稳定期35例,进展期45例,两组患者各项一般资料比较没有统计学意义(P>0.05),见表1。
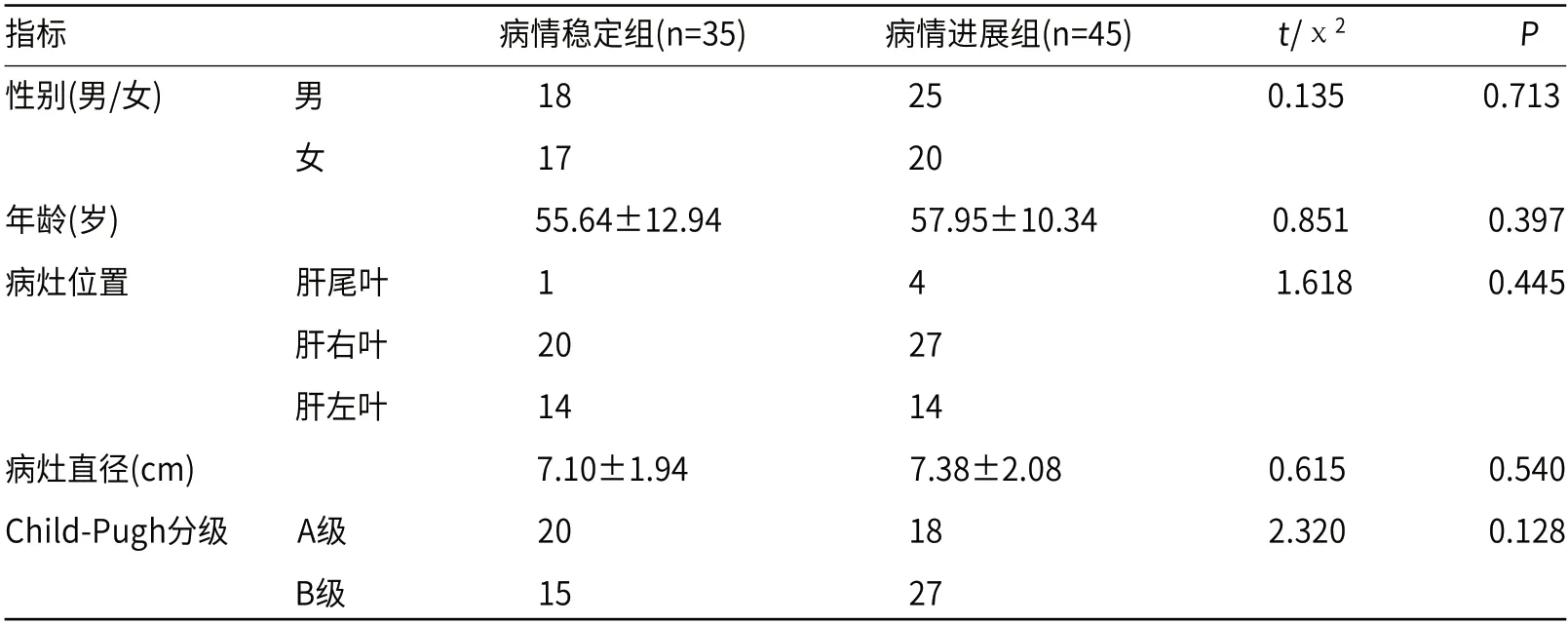
表1 两组患者一般资料比较
2.2 治疗前后磁共振影像学特点分析患者治疗前病灶T1信号显示为稍长或者等长,T2信号显示为稍长,信号混杂或者均匀,部分患者病灶内部存在显著囊变坏死,其T1以及T2均显示为长信号,DWI检查则显示为均匀或者不均匀高信号,ADC则为低信号,增强扫描时动脉期强化均匀或者不均匀,门静脉期强化减弱,见图1。
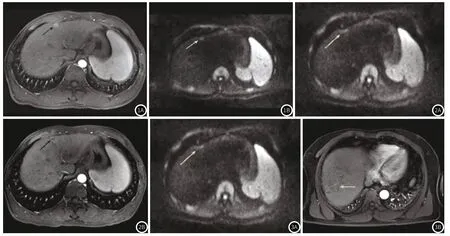
图1 治疗前患者磁共振检查影像学表现。图1A:增强扫描;图1B:DWI扫描。图2 稳定期患者治疗后4个月磁共振检查影像学表现。图2A:DWI扫描;图2B:增强扫描。图3 进展期患者治疗后4个月磁共振检查影像学表现。图3A:DWI扫描;图3B:增强扫描。
稳定期患者治疗后碘沉积区T1以及T2显示为等长或者稍长信号,显示为欠均匀或者均匀,DWI则为稍低或者等信号,增强扫描中三期均未见强化,见图2。
进展期患者T1与T2信号表现多样,病灶进一步扩大或者出现新病灶,DWI扫描显示为不均匀高信号,ADC则为混杂低信号,增强扫动脉期强化,门静脉期以及延迟期强化减弱,见图3。
2.3 两组患者治疗前后ADC值以及肿瘤体积比较病情稳定组患者治疗后ADC值显著高于治疗前,肿瘤体积显著低于治疗前(P<0.05),病情进展组治疗前后ADC、肿瘤体积差异比较没有统计学意义(P>0.05);治疗后病情稳定组ADC值显著高于病情进展组,肿瘤体积显著低于病情进展组(P<0.05),见表2。
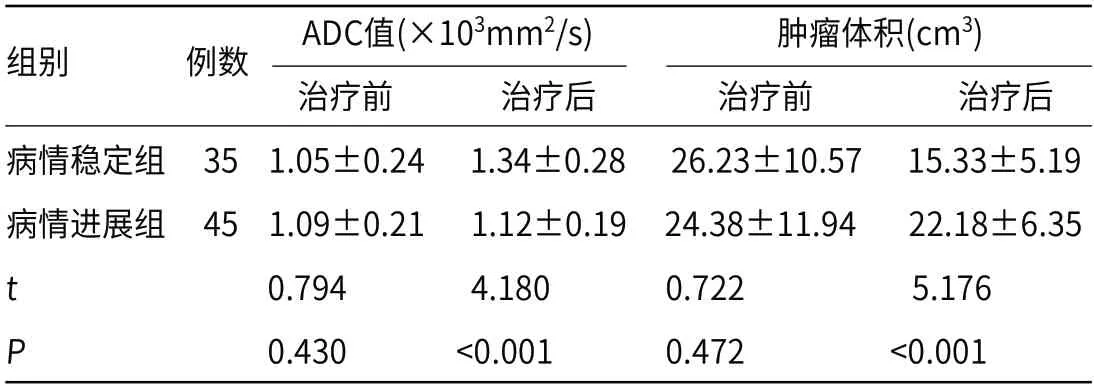
表2 两组患者治疗前后ADC值以及肿瘤体积比较
2.4 ADC值与肿瘤体积之间相关性分析Pearson相关性分析结果显示,ADC值与肿瘤体积负相关(r=-0.419,P<0.05)。
2.5 治疗后ADC值对于患者疗效预测价值分析ROC曲线显示ADC值评估患者疗效曲线下面积为0.850,95%CI为0.765~0.935,ADC最佳截断值为1.25×103mm2/s,敏感度与特异度分别为81.3%和86.9%,见图4。
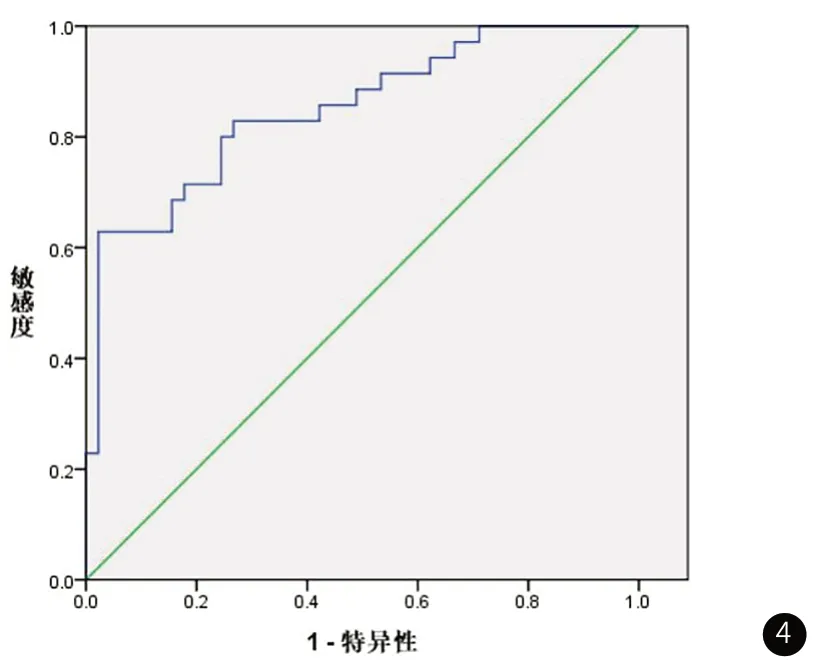
图4 治疗后ADC值对于患者疗效预测价值分析ROC曲线
3 讨 论
3.1 聚乙烯醇微球肝动脉化疗栓塞疗效评估检查手段肝癌患者病灶中大部分血供均由肝动脉提供,病灶边界位置血液则由门静脉提供,应用聚乙烯醇微球肝动脉化疗栓塞治疗使病灶大面积缺血坏死,但是其边界则因为碘油不能充分沉积使在治疗后形成侧支循环,影响治疗效果,重复肝动脉化疗栓塞治疗则会使患者肝脏功能损伤,因此及时进行疗效评估对于合理治疗及其后治疗方案制定意义重大[9-10]。目前临床上判断肝癌病情变化检查“金标准”为数字减影技术,但是其检查费用昂贵、检查有创以及要求患者住院等特点使其应用受限[11]。DWI检查依据机体水分子扩散特性反映机体病理状态、组织结构以及密度,可以有效反映病灶中活性成分以及坏死病灶,其检查具有无创、重复性好、快捷以及不会受呼吸运动影响优势,在评估介入治疗疗效上价值优异[12]。
3.2 肝癌患者治疗前后DWI影像表现肝癌患者在进行治疗前,病灶内部细胞排布紧密,细胞内部存在间隙少,因此水分子扩散运动相对较慢,DWI检查显示为高信号,而由于病灶活性相对较高,因此T1WI以及T2WI序列检查显示为长信号、等信号。患者接受聚乙烯醇微球肝动脉化疗栓塞治疗后坏死以及活性组织均存在碘油沉积区,完全坏死病灶中存在坏死、肉芽、纤维素沉着,因此其内部细胞结构损伤,细胞膜通透性改变,水分子扩散作用增加,T1WI以及T2WI序列上显示为稍长以及等长信号,但是DWI则显示为低信号。病情进展组患者病灶残余或者复发位置细胞排列紧密,病灶组织活性相对较高,水分子在其中运动受限,因此T1WI显示为长信号,T2WI显示为低信号,而DWI则为高信号。
3.3 DWI评估聚乙烯醇微球肝动脉化疗栓塞疗效价值DWI检查测定ADC值可以有效反映组织正常结构及病灶血管灌注情况,其值越大显示患者在组织内部水分子扩散运动越快[13]。研究显示水分子扩散情况与肿瘤组织细胞密度大小显示为正相关关系,化疗药物会使细胞膜完整性被破坏,进一步加快病灶内部水分子运动,而DWI是评估病灶细胞活性变化敏感性影像学检查方法[14]。本研究中病情稳定组患者治疗后ADC值显著高于治疗前,肿瘤体积显著低于治疗前,病情进展组治疗前后ADC、肿瘤体积差异比较没有统计学意义,分析认为病情稳定患者治疗后病灶坏死率较高,病灶细胞内部活性成分含量较少,大部分病灶出现液化坏死,水分子自由扩散能力增加,所以其ADC值较治疗前显著上升,而病情进展组患者治疗后残余以及复发病灶相对较多,因此其ADC值变化较小。高回青等[15]研究认为疗效较好患者治疗后ADC值上升主要因为肿瘤内部药物栓塞缺血以及细胞毒性作用,导致病灶内部出现坏死变化,分析原因为病灶细胞结构损伤、细胞间隙增加导致水分子在病灶扩散运动增加,因此ADC值上升。另有研究则认为肝动脉化疗栓塞治疗后肿瘤细胞凋亡因子表达水平上升,因此其内部凋亡细胞增加,ADC值上升[16]。为进一步反映聚乙烯醇微球肝动脉化疗栓塞疗效与ADC值之间关系,本研究评估了肿瘤体积与ADC值之间关系,结果显示ADC值与肿瘤体积负相关(r=-0.419),治疗后患者瘤体体积下降时ADC值上升,进一步表明DWI测定ADC值可用于评估聚乙烯醇微球肝动脉化疗栓塞疗效。最后ROC曲线显示ADC值评估患者疗效曲线下面积为0.850,95%CI为0.765~0.935,ADC处于最佳截断值时,敏感度与特异度分别为81.3%和86.9%,显示其用于评估患者治疗效果价值优异。杨耀文等[17]研究中经导管肝动脉化疗栓塞术治疗采用DWI评估治疗疗效敏感度以及特异度分别为82.6%、85.3%,证实DWI用于评估经导管肝动脉化疗栓塞术治疗疗效价值优异。但本研究中纳入研究样本量相对较少,后续需要扩大样本量以进一步证实本研究结论可靠性,同时本研究中所有感兴趣区均由影像科医师手动勾画,存在一定主观性,可能会影响最终结果。
综上,聚乙烯醇微球肝动脉化疗栓塞治疗采用DWI检查可以定性、定量评估患者治疗疗效,其测定ADC值用于评估患者治疗效果价值优异,值得临床推广。

