HRCT征象联合TTF-1用于区分不同浸润程度的磨玻璃结节样肺腺癌*
1.南方医科大学顺德医院(佛山市顺德区第一人民医院)放射科(广东 佛山 528308)
2.南方医科大学顺德医院(佛山市顺德区第一人民医院)呼吸科(广东 佛山 528308)
张 榕1 杨少民1 郭保亮1 欧阳富盛1 刘子蔚1 周翠铷1 肖 强2 胡秋根1,*
随着工业化和城市化的进展,肺癌已经从罕见疾病转变为全球性公共卫生问题[1]。据估计,每年约有1800万人被诊断出患有肺癌,且5年生存率仅约4%~17%[2]。近年来,对肺癌基因组学的了解使得肺癌的治疗取得实质性进展。然而,挑战仍然存在,因为早期肺癌的共识性检测方法仍然难以捉摸[3]。其中,直径小于2cm的磨玻璃结节样肺腺癌(small ground glass nodular lung adenocarcinoma,GGNs)的清晰显示高度依赖于CT扫描和后处理技术。普通CT无法显示GGNs或清晰显示,因此,GGNs的早期检测存在很大的限制[4]。而高分辨率计算机断层扫描(high-resolution computed tomography,HRCT),一种非破坏性技术,可进行3D成像和各种物体内部特征的分析,具有良好的敏感性和特异性[5]。根据解剖分布,HRCT征象可大致分为四类:实质、气道、血管和胸膜征[6],可以更清晰地显示GGNs[3-4],并有助于胸外科医师明确更合理的切除范围[7]。因此,本文旨在进一步评估HRCT征象对于预测GGNs浸润程度的临床价值。此外,本研究进一步分析了HRCT征象与肺癌临床相关免疫组化指标的相关性,以期进一步提高GGNs患者的早期诊断和及时治疗。
1 资料与方法
1.1 临床资料回顾性分析2019年1月至2020年5月于我院进行HRCT扫描的144例(男46例,女98例)GGNs患者,最小年龄为28岁,最大年龄为80岁,平均年龄为(51.9±11.9)岁。根据2015年WHO制定的肺腺癌新分类[8],将144例患者分为三组:浸润前病变(pre-invasive lesion,PI)组(n=35)(图1)微浸润性腺癌(microinvasive adenocarcinoma,MIA)组(n=46)(图2)和浸润性腺癌(invasive adenocarcinoma,IA)组(n=63)(图3)。此外,收集了144例患者的免疫组化切片,通过显微镜随机拍摄每个样本的3个视野并通过Image J打开图片(400倍)。然后,根据图片灰度值与OD(optical density)值进行转换,取平均值作为基因的相对表达以进行后续统计分析。本项研究获得了所有患者的知情同意以及我院伦理委员会的批准。
1.2 检查方法使用SIEMENS Somatom Definition AS 128层CT机(西门子,德国)进行HRCT靶扫描检查,扫描的上下范围由肺尖到膈面,左右范围包括两侧腋窝及胸壁。HRCT靶扫描的具体参数:扫描视野(FOV)180mm×180mm,管电流300mA,管电压120kV,螺距(pitch)0.8mm,准直0.6mm×128,扫描时间1.91s,重建厚度0.6mm,图像矩阵512×512,扫描结束将原始图像传送至后平台,再进行多平面重建(MPR)和容积重组(VR)等后处理进行阅片。所有图像传入SIEMENS后处理工作平台进行重建,并由两位高年资医生以双盲法进行阅片。在薄层图像及重建图像取最大合适截面进行参数测量,每个样本测量三次并取平均值。
1.3 统计学分析所有统计分析均采用SPSS22.0软件进行。符合正态分布的测量数据以()表示,并通过单因素方差分析和无序多分类logistic回归分析比较三组患者的HRCT征象。使用独立样本t检验进行组间比较。使用R语言软件4.1.0版本绘制小提琴图和热图。P<0.05被认为差异具有统计学意义。
2 结 果
2.1 三组患者HRCT征象的单因素分析如表1所示,三组患者的GGNs平均大小、GGNs平均密度、分叶征、毛刺征、胸膜牵拉征、瘤-肺边界、微血管穿行征及空气支气管征均有显著的差异(P<0.05)。然而,空泡征在三组患者中无显著差异(P>0.05)。
2.2 三组患者HRCT征象的无序多分类Logistic回归分析为进一步验证单因素分析筛选出来的自变量对不同浸润程度肺腺癌的影响,引入了无序多分类Logistic回归模型。模型Ⅰ:MIA组(参照=PI组),模型Ⅱ:IA组(参照=PI组)和模型 Ⅲ:MIA组(参照=IA组)。由表2可知,所建立模型的拟合优度检验结果较好且有效。如表3所示,在模型Ⅰ中,与PI组相比,MIA组的GGN平均大小和空气支气管征均具有显著差异(P<0.05);在模型Ⅱ中,与PI组相比,IA组GGNs平均大小、分叶征、瘤-肺边界和空气支气管征均差异显著(P<0.05);在模型Ⅲ中,与IA组相比,MIA组GGNs平均大小、分叶征、毛刺征和瘤-肺边界均差异显著(P<0.05)。结合数据看:除了GGNs平均大小,其他单独的HRCT征象不足以成为区分PI、MIA和IA病变的独立因素。
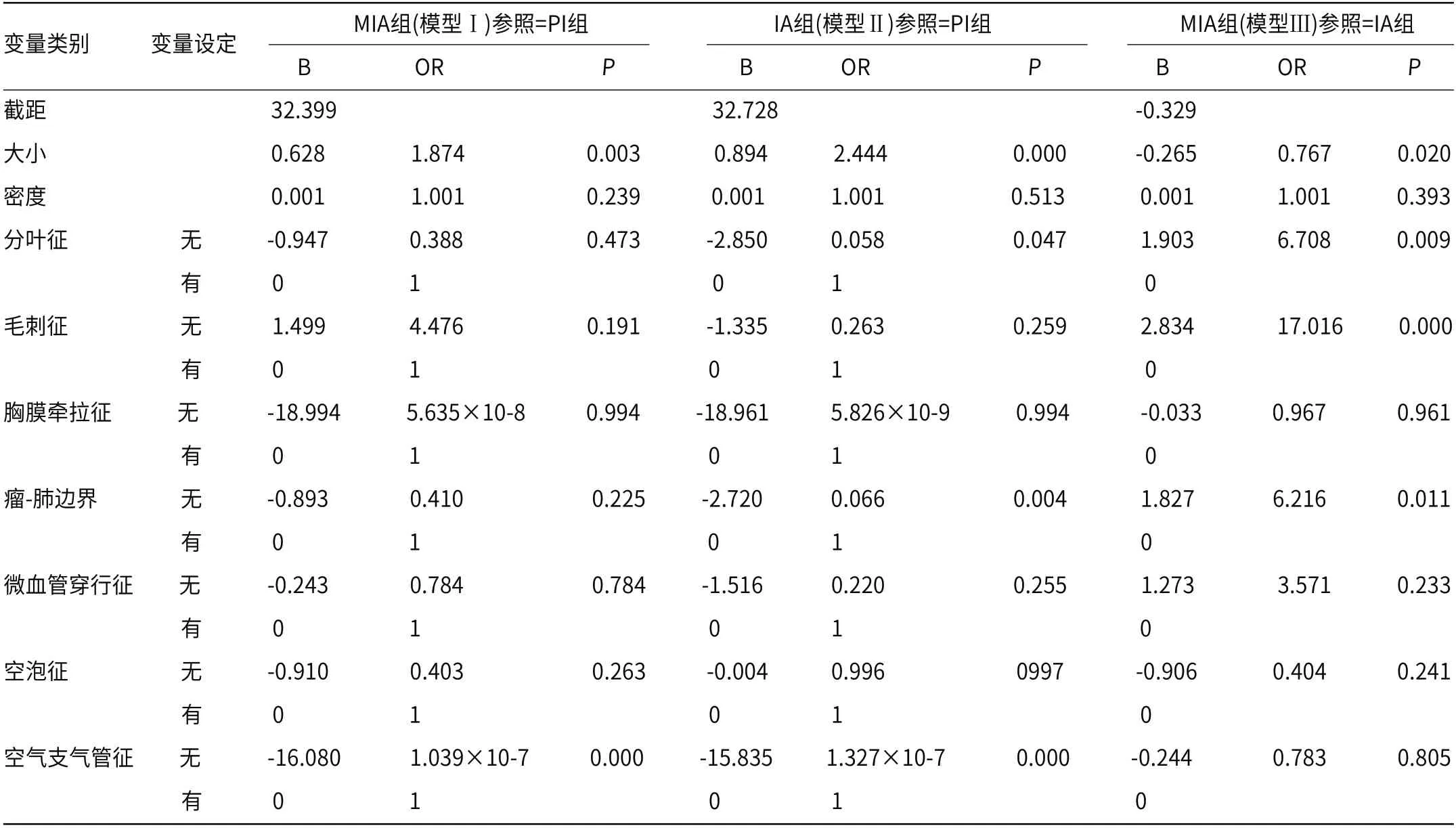
表3 影响浸润程度的无序多分类logistic回归分析结果
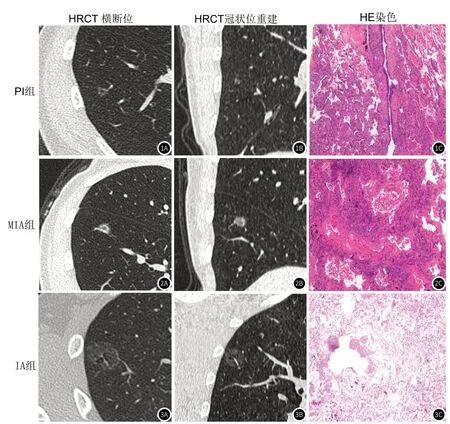
图1~3 三组患者HRCT征象和HE染色的示意图。图1 为PI组,右肺下叶外基底段见一大小约5mm×5mm磨玻璃结节,周围可见微血管穿行,病灶内见空泡征;术后病理:符合原位癌(浸润前病变)。图2 为MIA组,右下肺前基底段见一大小约9mm×10mm磨玻璃结节,病灶边缘可见微血管穿行,边界显示清晰,微血管壁显示毛糙,病灶边缘见少许短毛刺,病灶中央见空泡征;术后病理:微浸润性腺癌。图3 为IA组,右上肺见一大小约22mm×16mm纯磨玻璃结节,常规CT扫描显示边界稍模糊,病灶内见微血管穿行及小空泡影;术后病理:浸润性肺腺癌。
2.3 HRCT征象与肺癌相关蛋白的对比分析如图4所示,与PI组相比,10个肺癌相关的临床指标CEA、EGFR、VEGF、NapsinA、CK7、TTF-1、CK5/6、P53、Ki67和P40在MIA组和IA组均显著升高(P<0.05)。进一步根据HRCT征象对这144个样本进行分类(图5):(1)与GGNs平均大小≤10mm组相比,GGNs平均大小>10mm组中10个肺癌相关的临床指标均显著升高(P<0.05);(2)与GGNs平均密度≤-425HU组相比,GGNs平均密度>-425HU组中仅TTF-1显著增加(P<0.05);(3)与分叶征阴性组相比,分叶征阳性组中CEA、VEGF、NapsinA、CK7、CK5/6、P53、P40的表达均显著下降,然而EGFR、TTF-1和Ki67的表达均显著增加(P<0.05);(4)与毛刺征阴性组相比,毛刺征阳性组中10个肺癌相关的临床指标的表达均显著升高(P<0.05);(5)与胸膜牵拉征阴性组相比,胸膜牵拉征阳性组中TTF-1和Ki67的表达均显著升高,然而,P53和P40的表达均显著下降(P<0.05);(6)与瘤-肺边界阴性组相比,瘤-肺边界阳性组中10个肺癌相关的临床指标均显著升高(P<0.05);(7)与微血管穿行征阴性组相比,微血管穿行征阳性组中CEA和TTF-1的表达均显著升高,然而,EGFR、VEGF、NapsinA、CK7和P53的表达均显著下降(P<0.05);(8)与空气支气管征阴性组相比,空气支气管征阳性组中TTF-1和Ki67均显著升高且CK5/6、P53和P40均显著下降(P<0.05);(9)与空泡征阴性组相比,空泡征阳性组中10个肺癌相关的临床指标均无显著差异(P>0.05)。结合数据看:肺癌相关的临床指标结合HRCT征象可以提高PI、MIA和IA病变的分辨率。
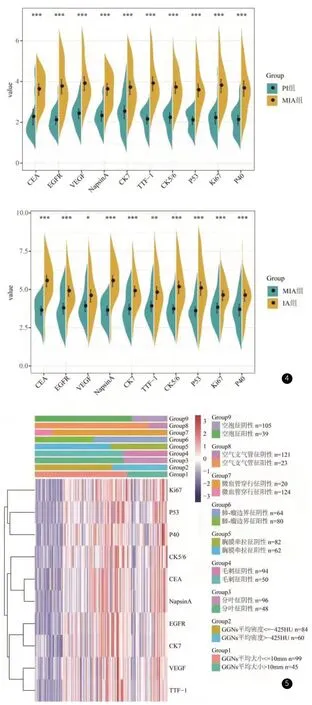
图4 免疫组化检测三组患者中10个肺癌相关临床指标:CEA、EGFR、VEGF、NapsinA、CK7、TTF-1、CK5/6、P53、Ki67和P40的蛋白表达水平。Mann Whitney test结果显示,与PI组相比,MIA组中这10个肺癌相关临床指标均显著高表达。此外,与MIA组相比,这10个肺癌相关临床指标在IA组中显著高表达。备注:*代表P<0.05,**代表P<0.001,***代表P<0.0001。图5 这10个肺癌相关临床指标:CEA、EGFR、VEGF、NapsinA、CK7、TTF-1、CK5/6、P53、Ki67和P40在HRCT征象阳性和阴性组中的表达情况。
3 讨 论
近年来,随着HRCT的广泛应用,GGNs的检出率明显增加[8-9],从而将PI和MIA患者的5年生存率提高到100%[9]。然而GGNs的检出率并非100%,于是,一些诸如分叶征、毛刺征和胸膜牵拉征等HRCT征象也常用于区分PI、MIA和IA病变[4]。因此,评估HRCT征象对于区分PI、MIA和IA病变具有重要的临床意义,有助于提高肺腺癌患者的生存期和生活质量。
GGNs的大小和密度一直被认为是肺腺癌病变程度的两个重要指标[10]。有研究指出,大于8.12mm且密度大于-449.52HU的GGNs与IA病变密切相关[11]。在本研究中,单因素分析结果显示GGNs平均大小和平均密度在三组患者中均有显著的差异(P<0.05)。其中,PI组平均大小和平均密度分别为(5.03±1.52)mm和(-534.61±328.35)HU,MIA组GGNs平均大小和平均密度分别为(7.80±2.01)mm和(-485.09±100.50)HU,IA组GGNs平均大小和平均密度分别为(11.76±3.10)mm和(-307.87±147.07)HU。然而,无序多分类logistic回归分析结果显示,仅GGNs平均大小可以作为区分PI、MIA和IA病变的独立因素,与Eguchi等[12]的研究报道一致。结合本研究结果可知:GGNs平均大小大于(7.80±2.01)mm和大于(11.76±3.10)mm,可作为预测MIA和IA病变的独立危险因素。
除了GGNs的大小和密度,诸如分叶征、毛刺征和胸膜牵拉征等其他HRCT征象也与肺癌的发生和发展密切相关[13-14]。随着GGNs浸润程度的增加,病灶细胞的生长速度加快,分叶征和毛刺征也逐渐出现[15]。在本研究中,单因素分析结果显示分叶征和毛刺征在三组患者中均有显著的差异(P<0.05),提示分叶征和毛刺征对于区分GGNs浸润程度具有一定的辅助价值。无序多分类logistic回归分析结果显示,与PI组相比,IA组中分叶征(P=0.047)显著增加而毛刺征无显著差异(P=0.259);与IA组相比,MIA组中分叶征(P=0.009)和毛刺征(P=0.000)均显著变化;然而,分叶征(P=0.473)和毛刺征在(P=0.191)PI组和MIA组中无显著差异。总体来说,本研究结果表明分叶征和毛刺征可作为区分MIA和IA病变的独立因素,然而,由于本研究样本数量的限制,需要扩大样本进一步明确分叶征和毛刺征对于区分PI/IA病变和PI/MIA病变的临床价值。
Lee等[16]报告显示,在PI病变和IA病变之间胸膜牵拉征象的分布没有明显的差异。然而,本研究中,单因素分析结果显示,PI组(0/35)、MIA组(19/46)和IA组(43/63)出现胸-膜牵拉征的病例数量具有显著差异(P=0.000),提示了胸-膜牵拉征在评估GGNs浸润程度方面具有一定的临床价值。在Lee等[16]的研究中,HRCT的重建厚度为1.0~2.5mm,而在本研究中HRCT的重建厚度为0.6mm。此外,本研究做了靶扫描以及冠状和矢状后处理重建技术,在不同方位可更清晰地显示影像特征。因此,本研究结果对于胸-膜牵拉征的检测更加精准。然而,进一步的无序多分类logistic回归分析结果显示,三组患者的胸-膜牵拉征无显著差异(P>0.05),提示胸-膜牵拉征可作为区分GGNs浸润程度的非独立性辅助指标,需要联合其他HRCT征象加以佐证。
肺瘤-肺边界征象的出现往往提示GGNs存在恶性病变可能[17]。微血管穿行征和空气支气管征也与肺癌的进展密切相关[4,18]。在本研究中,单因素分析结果同样表明瘤-肺边界,微血管穿行征和空气支气管征在三组患者中均有显著的差异(P<0.05)。然而,无序多分类logistic回归分析结果显示:(1)与PI组相比,IA组中瘤-肺边界的病例显著增加(P=0.004);与IA组相比,MIA组中瘤-肺边界的病例显著增加(P=0.011);然而瘤-肺边界的征象在PI组和MIA组中无显著差异(P=0.410),提示瘤-肺边界可以作为区分PI/IA病变和MIA/IA病变的独立指标,然而不适用于作为区分PI/MIA病变的独立因素。(2)微血管穿行征在PI组、MIA组和IA组中无显著差异(P<0.05),提示微血管穿行征仅可以作为区分PI、MIA和IA病变的辅助指标。(3)与PI组相比,MIA组(P=0.000)和IA组中空气支气管征(P=0.000)显著增加,然而空气支气管征在MIA组和IA组中无显著差异(P=0.805),提示空气支气管征可以作为区分PI病变和MIA/IA病变的独立危险因素,然而仅可作为区分MIA和IA病变的辅助指标。结合以上数据来看:除了GGNs的大小,其他的HRCT征象不能完全适用于作为评估GGNs病变类型的独立指标。因此,本研究希望通过结合其他临床指标,进一步提高HRCT征象作为诊断GGNs病变类型的临床价值。
肺癌相关的临床指标CEA[19]、EGFR[20]、VEGF[21]、NapsinA[22]、CK7[23]、TTF-1[24]、CK5/6[25]、P53[26]、Ki67[27]和P40[28]常用于评估肺癌的发生和发展。在本研究中,与PI组相比,这10个肺癌相关的临床指标在MIA组和IA组均显著升高(P<0.05)。因此,进一步评估这些肺癌相关临床指标与HRCT征象的相关性,以进一步区分PI、MIA和IA病变。
本研究结果显示,与相应的对照组相比,在GGNs平均大小>10mm组、毛刺征阳性组和瘤-肺边界征阳性组中CEA、EGFR、VEGF、NapsinA、CK7、TTF-1、CK5/6、P53、Ki67和P40均显著升高(P<0.05),表明GGNs平均大小>10mm,毛刺征和瘤-肺边界征结合这10个肺癌相关临床指标的异常升高有助于进一步明确GGNs病变类型的临床诊断。然而,在胸膜牵拉征阳性组中仅TTF-1和Ki67的表达显著升高(P<0.05);在微血管穿行征阳性组中仅CEA和TTF-1的表达显著升高(P<0.05)。此外,在空气支气管征阳性组中仅TTF-1和Ki67显著升高(P<0.05)。这提示胸膜牵拉征和空气支气管征联合高表达的TTF-1和Ki67;微血管穿行征联合高表达的CEA和TTF-1,有助于进一步提高PI、MIA和IA病变的诊断率。基于以上临床分析,发现TTF-1的异常升高与所有HRCT征象密切相关。研究报道由NKX2-1编码的TTF-1是调节肺形态和肺上皮细胞分化的主转录因子,在小细胞肺癌和肺腺癌中均高表达且与不良预后相关[29-30]。因此,可推测TTF-1的高表达是肺癌患者出现异常HRCT的潜在因素。
总之,HRCT征象联合高表达的TTF-1有助于进一步预测GGNs中的PI、MIA和IA病变。然而,本研究未对所纳入病例的性别和年龄等相关指标进行分层分析,需要扩大样本进行前瞻性队列分析,以进一步明确HRCT征象联合肺癌相关的临床指标对于评估GGNs浸润程度的临床价值,以及更细致的病人适用范围。

