电针对糖尿病神经痛模型大鼠背根神经节磷酸化p38 丝裂原活化蛋白激酶的干预作用
蒋晨琳 李 想 陈芷羽 费雪瑜 马益琪 胡群祺 康玉蓉 陈卢杭 邵晓梅 方剑乔 何晓芬
糖尿病神经痛是糖尿病最常见的慢性并发症,极大地影响糖尿病患者的生存质量[1]。同时,因糖尿病神经痛治疗难度大,糖尿病神经病变是糖尿病致死的原因之一[2]。实验表明,在糖尿病神经痛实验动物模型中,背根神经节多种蛋白质的表达上调[3]。已有研究表明,磷酸化p38 丝裂原活化蛋白激酶(pp38MAPK)在病理状态下易被激活,p-p38MAPK 在神经病理性疼痛模型中表达上调,p-p38MAPK 上调产生痛觉过敏,对糖尿病研究意义重大[4-6]。糖尿病神经痛较难治疗,且多数治疗药物有较大的副作用。针刺能够有效治疗疼痛,其较好的效果和较少的不良反应已广为接受和使用。本实验以链脲佐菌素诱导的糖尿病神经痛模型大鼠为研究对象,观察电针对糖尿病神经痛模型大鼠机械痛阈和背根神经节中pp38MAPK 表达的干预,探讨电针治疗糖尿病神经痛的可能机制。
1 实验材料
1.1 动物 SPF 级健康雄性SD 大鼠20 只,6~7周龄,体质量(220±20)g,由中国科学院上海实验动物中心动物科学实验中心提供[SCXK(沪)2018-0006],在浙江中医药大学实验动物中心按屏蔽环境标准饲养[SYXK(浙)2018-0012],大鼠饲养采用啮齿类动物标准颗粒饲料喂养,予以大鼠自由饮水,室温(22±2)℃,湿度恒定,12h 循环灯光。本研究经医学伦理委员会审核通过(伦理审批号:ACUC-2018723-08)。
1.2 试剂与仪器 主要实验试剂:链脲佐菌素(美国Sigma 公司,批号S0130);兔抗p-p38MAPK 抗体(美国Cell Signaling Technology 公司,批号4631);驴抗兔Alexa Fluor488 IgG(H+L)二抗(美国Jackson 公司,批号711-545-152)。机械测痛仪(意大利UGO公司,型号37450);冰冻切片机(德国Thermo 公司,型号NX50);蔡司显微镜(德国ZEISS 公司,型号Image.M2)。
2 实验方法
2.1 选框分组与电针干预 根据随机数字表法选取6 只大鼠作为空白组,空白组仅予以腹腔注射1mL柠檬酸缓冲液。其余14 只大鼠作为造模组,造模组大鼠禁食16h 后采用单次腹腔注射链脲佐菌素(65mg/kg)建立糖尿病神经痛模型[7];其中1 只大鼠注射链尿佐菌素死亡,1 只大鼠注射链尿佐菌素后空腹血糖(FBG)并没有下降故未纳入实验;造模成功的12 只大鼠根据随机数字表法分为模型组和电针组,每组6 只。电针组于2 周后介入电针治疗,取双侧足三里和昆仑穴,每天1 次,每次30min,干预1周。固定大鼠,大鼠穴位选取参照《实验针灸学》,用针灸针刺入足三里、昆仑穴,深度为3mm;进针后连接电针仪,频率选用2Hz,电流强度设为1~2mA,以大鼠肢体微微颤动为度。
2.2 空腹血糖(fasting blood glucose,FBG)检测 分别在造模前、后1、2、3 周时,对各组大鼠予以尾静脉采血,血糖监测仪检测其FBG。
2.3 机械痛阈检测 于造模前、后1、2、3 周时,采用动态足底触觉仪检测大鼠机械痛阈。测痛方法参照文献[8],具体测定方法如下:将实验大鼠放到高为20cm 的金属网上,用透明的围箱限制大鼠,通过反光镜控制角度,将刺激器放置在大鼠足爪下面,刺激器通过VONFREY 细丝提供设定的压力(压力最大设为50g),细丝对大鼠足底不断增加压力,从检测到的阈值开始,直到大鼠收回爪子,机械测痛仪自动记录大鼠收回足爪瞬间所给予动物的压力即为大鼠痛阈值,共检测5 次,最大值和最小值去除后取平均值。
2.4 免疫荧光法检测p-p38MAPK 蛋白表达 大鼠麻醉后,快速取大鼠腰4-腰6 背根神经节,放置多聚甲醛溶液中固定4h,再置于蔗糖溶液中梯度脱水后放于超低温冰箱冷冻保存。将大鼠背根神经节切成厚度为10μm 的片子,TBST 冲洗,5%驴血清封闭1h后,按1∶800 稀释比例加入兔抗p-p38MAPK 一抗,4℃过夜,37℃孵育1h,TBST 冲洗,加入1∶400 稀释的荧光二抗,37℃避光孵育1h,TBST 冲洗后自然晾干,加抗荧光淬灭液后封片。在蔡司显微镜下观察背根神经节并拍片。采用Image J 软件计算阳性细胞个数。
2.5 统计学方法 应用SPSS 22.0 软件对数据进行统计分析,实验数据用均数±标准差()表示,不同时间点指标的比较采用重复测量方差分析;组间比较采用单因素方差分析,方差齐性时采用LSD 检验,方差不齐时采用Dunnett's T3 检验。P<0.05 表示差异有统计学意义。
3 实验结果
3.1 各组大鼠干预前后体质量比较 空白组、模型组和电针组三组大鼠造模前体质量无显著性差异(P>0.05);与空白组比较,模型组和电针组大鼠体质量在造模后1、2、3 周时均显著降低(P<0.05)。见表1。
表1 各组大鼠干预前后体质量比较(g,)

表1 各组大鼠干预前后体质量比较(g,)
注:空白组仅予以腹腔注射1mL 柠檬酸缓冲液;模型组和电针组大鼠,禁食16h,予以腹腔注射65mg/kg 链脲佐菌素;电针组于2 周后介入电针治疗,取双侧足三里和昆仑穴;与空白组比较,aP<0.05
3.2 各组大鼠干预前后FBG 水平比较 造模前,空白组、模型组和电针组大鼠FBG 无显著性差异(P>0.05)。与空白组比较,模型组和电针组大鼠在造模后1、2、3 周时FBG 显著升高(P 均<0.05)。见表2。
表2 各组大鼠干预前后空腹血糖水平比较(mmol/L,)

表2 各组大鼠干预前后空腹血糖水平比较(mmol/L,)
注:空白组仅予以腹腔注射1mL 柠檬酸缓冲液;模型组和电针组大鼠,禁食16h,予以腹腔注射65mg/kg 链脲佐菌素;电针组于2 周后介入电针治疗,取双侧足三里和昆仑穴;与空白组比较,aP<0.05
3.3 各组大鼠干预前后机械痛阈比较 各组大鼠在造模前和造模后1 周时机械痛阈无显著性差异(P>0.05)。与空白组比较,模型组大鼠机械痛域在造模后2、3 周时显著降低,电针组大鼠机械痛阈在造模后2周时显著降低(P 均<0.05);与模型组比较,电针组大鼠机械痛阈在造模后3 周时显著升高(P<0.05)。见表3。
表3 各组大鼠干预前后机械痛阈比较(g,)

表3 各组大鼠干预前后机械痛阈比较(g,)
注:空白组仅予以腹腔注射1mL 柠檬酸缓冲液;模型组和电针组大鼠,禁食16h,予以腹腔注射65mg/kg 链脲佐菌素;电针组于2 周后介入电针治疗,取双侧足三里和昆仑穴;与空白组比较,aP<0.05;与模型组比较,bP<0.05
3.4 各组大鼠干预前后腰4-腰6 背根神经节神经元细胞p-p38MAPK 阳性细胞数比较 造模后3 周,与空白组比较,模型组大鼠腰4-腰6 背根神根节上的p-p38MAPK 阳性细胞个数显著升高(P 均<0.05);与模型组比较,电针组大鼠腰4-腰6 背根神经节上的p-p38MAPK 阳性细胞个数显著降低(P 均<0.05)。见表4、图1。

图1 电针对糖尿病神经痛大鼠腰4-腰6 背根神经节神经元细胞中p-p38MAPK 阳性细胞数的影响
表4 各组大鼠干预前后L4-L6 背根神经节神经元细胞p-p38MAPK 阳性细胞数比较(个,)
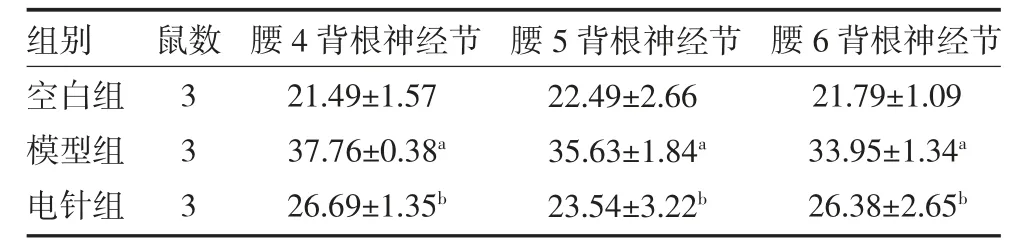
表4 各组大鼠干预前后L4-L6 背根神经节神经元细胞p-p38MAPK 阳性细胞数比较(个,)
注:空白组仅予以腹腔注射1mL 柠檬酸缓冲液;模型组和电针组大鼠,禁食16h,予以腹腔注射65mg/kg 链脲佐菌素;电针组于2 周后介入电针治疗,取双侧足三里和昆仑穴;与空白组比较,aP<0.05;与模型组比较,bP<0.05
4 讨论
糖尿病神经痛作为一种糖尿病常见并发症导致的神经性疼痛,治疗难度大、治疗费用贵、致残致死率高。电针具有良好的镇痛效应,但在临床上应用于糖尿病神经痛并不多,故研究电针治疗糖尿病神经痛的相关机制,有利于推动电针治疗糖尿病神经痛的临床应用。
腹腔注射链脲佐菌素是糖尿病神经痛经典的造模方法之一,糖尿病神经痛模型大鼠多在腹腔链脲佐菌素的1~3 周后成功造模[9]。本实验通过采用腹腔注射链脲佐菌素诱导糖尿病神经痛模型,链脲佐菌素注射后1 周大鼠FBG 明显升高,体质量明显下降,大鼠机械痛阈并没有下降,说明链脲佐菌素注射后1 周只是诱导了糖尿病模型并没有形成糖尿病神经痛模型;链脲佐菌素注射2 周后大鼠FBG 高于空白组,体质量低于空白组,此时模型组大鼠的机械痛阈明显低于空白组,表明链脲佐菌素注射2 周后成功建立了糖尿病神经痛模型。电针是将针刺入腧穴得气后,在针具上通过接近受刺动物生物电的微量电流,以治疗疾病的方法。因其较准确的可控刺激参数而被广泛应用于临床与实验中。此前本课题组He等[10]已证实,低频电针缓解糖尿病神经痛的效果优于高频电针,故本实验采用低频2Hz。低频电针干预从链脲佐菌素注射2 周后开始介入,持续干预1 周后,电针组大鼠机械痛阈明显高于模型组,说明电针有缓解糖尿病神经痛的作用。
背根神经节是传递从外周组织伤害性信息至中枢系统的“桥梁”,也是疼痛信息传导的起点[11]。在病理状态下,背根神经节中的许多离子通道和受体会发生改变[12-13]。已有研究表明,DNP 模型大鼠背根神经节中p-p38MAPK 表达明显上调,p-p38MAPK 表达上调是糖尿病神经痛发生的主要原因之一[14]。本研究结果显示,链脲佐菌素注射3 周后,糖尿病神经痛大鼠背根神经节的p-p38MAPK 阳性细胞表达升高,与以往的研究结果相一致;电针治疗1 周后,糖尿病神经痛模型大鼠背根神经节上的p-p38MAPK表达明显下降。
本研究结果证实,低频电针对糖尿病神经痛模型大鼠FBG 和体质量没有影响,可提高糖尿病神经痛模型大鼠的机械痛阈;电针可下调糖尿病神经痛模型大鼠背根神经节的p-p38MAPK 阳性细胞的高表达。综上所述,电针能缓解糖尿病神经痛模型大鼠疼痛,可能与其有效抑制背根神经节中p-p38MAPK表达有关。
——滋阴养胃 少酸宜甜

