2,4-二硝基甲苯磺酸盐降解菌株的分离、鉴定及降解特性研究
徐文杰 赵泉林 罗明汉 叶正芳,†
1. 南京工程学院环境工程学院, 南京 211167; 2. 北京大学环境科学与工程学院,北京 100871; † 通信作者, E-mail: zhengfangye@163.com
TNT 红水是采用亚硫酸钠精制 TNT 过程中产生的一种废水, 其中的主要污染物为二硝基甲苯磺酸盐(DNTS), 此外还有 TNT, DNT 和 MNT 等硝基苯衍生物[1-3]。TNT 红水中有机物浓度高且毒性大,处理难度非常大[4-6]。甘肃某地由于 TNT 红水蒸发池渗漏, 对土壤造成严重污染, 威胁到黄河上游的水质安全。因此, TNT 红水污染土壤修复是目前亟待解决的环境问题。
与非生物修复技术相比, 生物修复是一种环境友好且成本更低的方法, 许多微生物可以以有毒有机污染物为底物, 将复杂的有机化合物降解为简单的小分子化合物[7-8]。许多学者分离出 TNT 高效降解菌株[9-13]。然而, 目前关于DNTS 的生物降解的研究有限。Tsai[14]研究真菌对 TNT 红水的生物处理方法, 但未涉及降解机理。Zhang 等[15]研究固定化微生物技术对 TNT 红水的生物降解效果, 结果表明只有 2,4-DNT-5-SO3-可被有效降解, 2,4-DNT-3-SO3-不能被生物降解。微生物在自然环境中对 DNTS 的降解受到诸多环境条件的限制, 普通微生物降解效率有限, 故筛选并分离出高效的降解菌是微生物修复技术的关键基础。本研究组分离出一株能高效降解两种磺酸盐的假单胞菌 X5[16], 但能用于 2,4-二硝基甲苯磺酸盐降解的菌种资源仍然匮乏, 未见将鞘氨醇单胞菌属用于磺酸盐降解的研究。
本研究分离纯化能高效降解 2, 4-二硝基甲苯磺酸盐的菌株, 通过形态学观察、生理生化性能研究及基因序列分析, 对降解菌进行鉴定, 探讨环境因素对分离出的降解菌株生长的影响, 研究分离出的菌株对磺酸盐的降解机理以及对其他硝基芳香族化合物的降解效果。
1 材料与方法
1.1 实验材料
2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-由兰州大学合成。污染土壤取自甘肃某 TNT 红水污染场地, 未污染土壤取自当地远离工厂的洁净土壤。磺酸盐降解菌分离自投加复合微生物的 DNTS 污染土壤。
LB 培养基: 胰蛋白胨 10 g、NaCl 10 g 和酵母提取物 5 g 溶于 1000 mL 蒸馏水中, 用 1 mol/L 的NaOH 调节 pH 值至 7.2±0.2, 用高压灭菌锅在 121°C条件下灭菌 15 分钟。在上述培养基中加入 18%琼脂, 得到本研究所用的固体培养基。
无机盐培养基(MSM): NaCl 30 g, NH4NO33 g,KH2PO41 g, K2HPO41 g, CaCl20.02 g, MgSO40.5 g,去离子水 1 L; 微量元素溶液(NiCl2·6H2O 0.03 g,FeSO4·7H2O 0.2 g, CuSO4·5H2O 0.03g, CoCl2·6H2O 0.1 g, MnSO40.1 g, Na2MoO4·2H2O 0.04 g, H3BO30.03 g 和去离子水 1 L) 10 mL。用高压灭菌锅在121°C 条件下灭菌 15 分钟。
1.2 菌株分离与鉴定
取 2 g 投加复合微生物的 DNTS 污染土壤, 放入装有 100 mL 无菌 LB 液体培养基的锥形瓶中, 在30°C 和 120 rpm 的恒温摇床上进行震荡, 富集培养24 小时。取 l mL 培养液, 采用稀释涂布平板法分离纯化菌株。
挑取单克隆菌株在 LB 液体培养基中活化培养一定的时间, 采用场发射扫描电子显微镜对菌株形态进行观察。根据《常见细菌系统鉴定手册》[17]研究其生理和生化特性, 包括革兰氏染色、甲基红测试、七叶灵水解、明胶水解、硝酸盐还原、吲哚生成、H2S 生成、V-P 测试以及不同碳源利用。
通过 16S rDNA 序列分析鉴定分离的菌株。用细菌基因组 DNA 提取试剂盒(Solarbio, D1600)提取分离菌株的基因组 DNA。所用引物为 8F (5'-AGA GTTTGATCCTGGCTCAG-3')和 1513R (5'-TACGGT TACCTTGTTACGACTT-3'), 通过聚合酶链反应(PCR)扩增提取 DNA。纯化的 DNA 送至上海铂天生物技术有限公司进行测序。使用 BLAST 进行核苷酸序列相似性分析。
1.3 环境因素对菌株生长的影响
挑取菌株的单菌落并转移到无菌 LB 液体培养基中, 并在 30°C 和 120 rpm 条件下培养 12 小时作为种子培养物。
1) 温度的影响: 以 1%的接种量, 将菌株的种子培养液接种于 LB 液体培养基中, 分别将锥形瓶置于 20, 25, 30, 35 和 40°C 的摇床中, 120 rpm 培养24 小时, 测定菌液的 OD600值。每组设置 3 个重复。
2) pH 的影响: 以 1%的接种量, 将菌株的种子培养液接种于 pH 分别为 5, 6, 7, 9 和 11 的 LB 液体培养基中, 30°C 和 120 rpm 培养 24 小时, 测定 OD600值。培养基的 pH 值用 1N HCl 和 1N NaOH 调节。每组设置 3 个重复。
3) 盐度的影响: 以 1%的接种量, 接种菌株于NaCl 浓度为 0, 1%, 3%, 5%, 7%和 10%的无 NaCl LB液体培养基中, 于 30°C 和 120 rpm 培养 24 小时, 测定 OD600值。每组设置 3 个重复。
1.4 菌株对磺酸盐及其他硝基化合物的降解能力
将菌株接种在灭菌的 LB 液体培养基中活化 24小时。将各菌液的 OD600稀释至 1, 取 10 mL 菌液分别加入含 100 g 浓度为 500 mg/kg 的 2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-污染土壤的锥形瓶中, 并补加 30 mL 水, 调节液土比为 2:5。将锥形瓶置于 30°C 的恒温培养箱中培养。每隔一定时间取样, 测定土壤中二硝基甲苯磺酸盐浓度。每组设 3 个重复。
为研究菌株对不同硝基芳香化合物的降解能力, 分别配置浓度为 100 mg/kg 的 TNT, 2,4-DNT,2,6-DNT, 2-MNT, 3-MNT 和 4-MNT 污染土壤。分别取 12.5 mL 菌株的种子培养物, 6000 rpm 离心5 分钟收集菌体, 并重新悬浮于 40 mL MSM 培养基中。将菌悬液加入含 100 g 各污染物土壤的锥形瓶中,于 30°C 培养。每组设 3 个平行样。7 天后, 取样测定各硝基化合物浓度。
1.5 2,4-二硝基甲苯磺酸盐及其降解产物、硝基化合物的测定
两种 2,4-二硝基甲苯磺酸盐的测定: 取 2 g 土样和 10 mL 超纯水加入 15 mL 离心管中, 涡旋振荡 30秒, 30°C 超声波振荡 3 小时, 10000 rpm 离心 5 分钟,取上清液用 0.45 μm 水系滤膜过滤, 用高效液相色谱(HPLC)进一步测定其含量。测定条件如下: SBAq 色谱柱(250 mm×4.6 mm, 5 μm), 柱温为 40°C, 检测波长为 230 nm。以乙腈:磷酸二氢钾溶液(0.68‰)为流动相进行梯度洗脱, 流速为 1.0 mL/min, 进样量为 20 μL。
采用液相色谱质谱联用仪对降解过程中的产物进行分析。色谱条件: 色谱柱采用 Agilent Extend-C18 column (150 mm×2.1 mm, 5 μm), 柱温为 40°C,进样量为 10 μL, 检测波长为 230 nm; 流动相为乙酸铵和乙腈梯度洗脱, 流速为 0.3 mL/min。质谱条件: ESI 的电离雾源, 二级质谱负离子扫描模式, 离子阱 SL 系统; 采用 MRM 的 isolation 模式, 目标离子为m/z261; 扫描范围为m/z50~400, 最长积累时间为 300 ms, 毛细管电压为 3500 V, 气化压力为 35 psi (2.4×105 Pa), 干燥器(N2)流速为 8.0 mL/min, 温度为 330°C, 破碎电压为 1.0 eV。
TNT 等硝基化合物的测定: 取 2 g 土样和 10 mL乙腈加入 15 mL 离心管中, 涡旋振荡 30 秒, 4°C 超声波振荡 3 小时, 10000 rpm 离心 5 分钟。取上清液用0.45 μm 有机系滤膜过滤, 用 HPLC 进一步测定硝基芳香族化合物含量。测试方法如下: SB-Aq 色谱柱(250 mm×4.6 mm, 5 μm), 柱温为 30°C, 检测波长为246 nm。流动相为甲醇和超纯水(1:1), 流速为 1.0 mL/min, 进样量为 20 μL。
2 结果与分析
2.1 降解菌株的鉴定
将本研究分离出的磺酸盐高效降解菌株编号为X2, 其在 LB 固体培养基上的群落形态及电镜照片如图 1 所示。菌株 X2 在 LB 平板培养基上生长的菌落形态特征为黄色, 单个菌落呈圆形, 边缘整齐,表面光滑有光泽。在电子显微镜下, X2 菌体为杆状, 长度约为 2~3 μm。
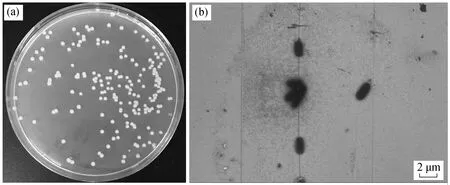
图1 菌株X2 在LB 平板培养基上的附着形态(a)及电镜照片(b)Fig.1 Morphology of X2 on LB plating medium (a) and under FESEM (b)
菌株的生理生化试验结果如表 1 所示, X2 为革兰氏阴性, 可耐受温度范围为 4~41°C, V-P 试验、亚硝酸还原和产酸试验结果为阳性, 明胶水解和H2S 产生试验结果为阴性, 能够代谢利用多种碳源,如葡萄糖、淀粉、麦芽糖、L-鼠李糖和纤维二糖等。

表1 菌株X2 的生理生化指标Table 1 Physio-biochemical characteristics of the isolated strain X2
将菌株 X2 的 16S rDNA 序列在 GenBank 数据库中进行 BLAST 比对, 与鞘氨醇菌Sphingobium yanoikuyaeNBRC 15102 的相似度为 100%。
2.2 环境因素对菌株生长的影响
通过测定培养 24 小时后的 OD600值, 研究不同环境因素对菌株 X2 生长的影响。图 2(a)显示温度对 X2 生长的影响, X2 在 25~40°C 的温度范围内均具有较好的生长效果, OD600在 20~30°C 范围内随温度升高而增加, 在 30°C 时生长效果最佳, 超过 30°C后 OD600值减小。类似地, Park 等[18]采用Sphingobium chungbukenseKCTC 2955 降解邻苯二甲酸酯的研究中, 降解率在 20~30°C 范围内随温度的升高而升高, 温度超过 30°C 后, 降解效率和生长速率均显著下降。图 2(b)显示 pH 对细菌生长的影响, X2可在 7~9 的 pH 范围内快速生长, 最佳 pH 值为 7。菌株 X2 对酸性及碱性环境具有一定的抵抗力, 但在 pH 为 3 和 11 时生长受到显著的抑制。同样地,Fu 等[19]指出鞘氨醇单胞菌 FB3 可在 pH5~9 范围内降解 PAH, 在 pH=7 时降解效果最佳, 可能是因为pH 过低或过高会改变生物大分子(如蛋白质和核酸)的电荷, 影响其生物活性, 同时可能改变细胞膜的电荷, 从而阻碍细胞膜吸收营养物质[20]。图 2(c)显示盐度对细菌生长的影响, 菌株 X2 在 NaCl 浓度为0~3%之间均具有较好的生长效果, 在 NaCl 浓度为1%时生长最佳, 超过 5%时生长受到显著抑制。类似地, 李朔[21]发现, 鞘氨醇单胞菌 YL-JL2C 在 0~2%盐度范围内可生长, 在 NaCl 浓度为1.5% 条件下生长最优。边晨凯[22]发现, 在 NaCl 浓度为 1%时,鞘氨醇单胞菌 B1 对咔唑(CA)的降解率在 96 小时后达到 90%, 但当 NaCl 浓度达到 2%后, 降解率只有50%; 而 NaCl 浓度≥3% 时, 菌株 B1 对 CA 基本上不降解。由此说明, 菌株 B1 具有一定的耐盐能力, 能在较低盐度条件下高效地降解 CA。

图2 环境因素((a)温度、(b) pH 和(c)盐度)对菌株X2 生长的影响Fig. 2 Effect of environmental factors ((a) temperature, (b) pH and (c) salinity) on the growth of X2
2.3 菌株对 2,4-二硝基甲苯磺酸盐的降解机理
在菌株 X2 最佳生长条件(30°C, pH=7, 盐度1%)下进行生物降解试验。菌株 X2 对两种 2,4-二硝基甲苯磺酸盐的降解曲线如图 3 所示。可以看出,当 2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-浓度为 500 mg/kg 时, 菌株 X2 能够完全降解两种磺酸盐, 所需时间分别为 12 天和 3 天。2,4-DNT-5-SO3-比 2,4-DNT-3-SO3-更易被生物降解, 可能是由于 2,4-DNT-3-SO3-的空间位阻大, 导致其难以被还原[23]。Zhang等[15]研究复合菌群 B925 对 TNT 红水的降解效果,结果表明系统在稳定期对 2,4-DNT-5-SO3-具有较高的降解率, 而 2,4-DNT-3-SO3-不能被降解。本研究分离出的鞘氨醇单胞菌 X2 对两种磺酸盐均具有较好的降解效果。
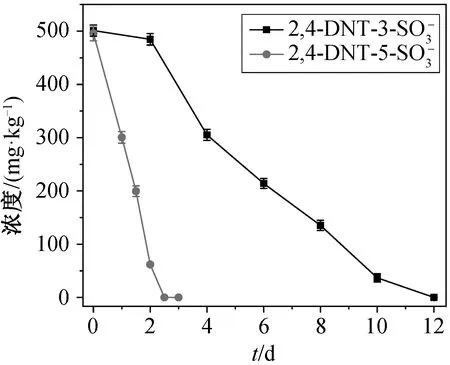
图3 菌株 X2 对 2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-的降解曲线Fig. 3 Biodegradation curve of 2,4-DNT-3-SO3-and 2,4-DNT-5-SO3- by strain X2
图 4 为磺酸盐在菌株 X2 降解前后的液相色谱图。在降解前, 色谱图中两个峰 P1 和 P2 (质谱分析表明两峰对应的质荷比均为 261)分别对应 2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-。经 X2 降解后,P1 和 P2 峰消失, 说明 2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-已被完全降解, 同时出现 3 个新峰(P3~P5)。通过 LC-MS 进一步研究生物降解产物, P3, P4 和 P5 的主要碎片离子质荷比分别为 217, 217 和 231, 推测其对应的物质分别为 2-羟基氨基-4-氨基甲苯-5-SO3-、2-羟基氨基-4-氨基甲苯-3-SO3-和 4-氨基-2-MNT-3-SO3-。由此推断, 在 X2 降解代谢两种 2, 4-二硝基甲苯磺酸盐的过程中, 苯环上的两个硝基还原为羟胺基, 并进一步还原为氨基。Lin 等[24]报道TNT 的好氧降解过程为一个硝基还原形成羟胺基,并进一步还原成氨基。与 TNT 类似, DNTS 的电子密度极小, 因此不可能进行氧化攻击, 在有氧和无氧条件下都经过还原途径降解[25]。与母体相比, 还原产物的电子密度降低, 更易于被氧化, 在好氧条件下可被进一步氧化成小分子物质。

图4 磺酸盐降解前后液相色谱图Fig. 4 Liquid chromatograms of DNTS before and after biodegradation
2.4 菌株对其他硝基芳香族炸药的降解
菌株 X2 对硝基化合物的降解效果如表 2 所示。经过 7 天的降解, TNT, 2,4-DNT, 2,6-DNT, 2-MNT, 3-MNT 和 4-MNT 的浓度分别从 99.65±2.39, 100.27±2.62, 99.96±2.24, 98.84±2.58, 101.11±2.51 和99.47±1.84 mg/kg 下降至 10.93±1.82, 35.21±2.17, 56.08±2.45, 71.44±2.98, 62.04±2.92 和 64.80±1.86 mg/kg,去除率分别为 89.03%, 64.88%, 43.90%, 27.72%,38.64%和 34.85%。以上结果表明, 菌株 X2 对硝基化合物具有广谱降解特性, 不仅可以降解 DNTS,还可以降解 TNT, DNT 和 MNT 等硝基芳烃污染物。目前, 已有研究者分离出 TNT, DNT 和 MNT降解菌株, 如 Lee 等[26]发现Pseudomonassp.HK-6含有编码硝基还原酶的pnrB基因, 能利用 TNT 作为氮源还原 TNT。然而, 这些研究中分离出的菌株往往只对某一种火炸药污染物具有较好的降解性,而实际火炸药污染场地同时含有多种硝基芳香族化合物。本研究中分离的高效降解菌株对多种硝基化合物都具有较好的降解能力, 更适用于火炸药污染场地的修复。
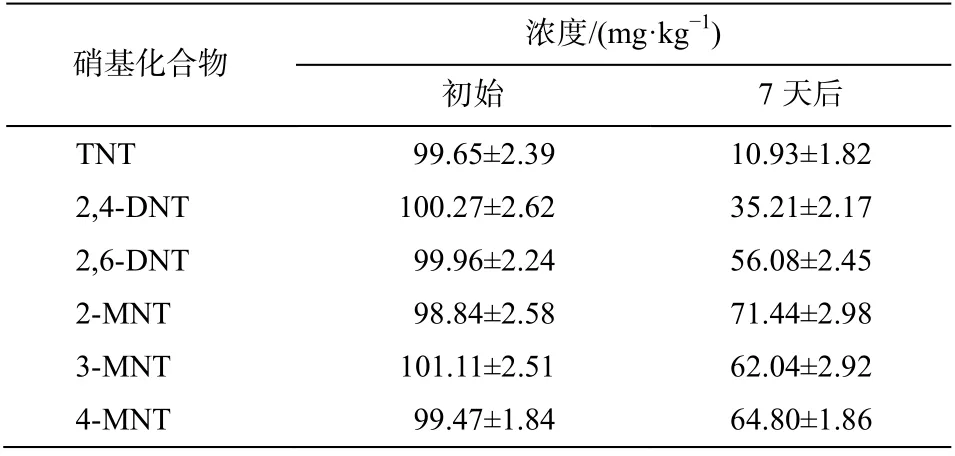
表2 菌株对硝基化合物的降解效果Table 2 Concentrations of nitro-aromatic compounds before and after degradation
3 结论
本研究从复合菌群中分离出一株 DNTS 降解菌株 X2, 经过生理生化分析及 16S rDNA 鉴定, 确定该菌株为鞘氨醇单胞菌属。X2 的最佳生长条件为30°C, pH=7.0 和 1%盐度。该菌株对 2,4-DNT-3-SO3-和 2,4-DNT-5-SO3-降解率分别在第 12 天和第 3天达到 100%。X2 通过还原路径降解 DNTS, 其降解路径为两个硝基被逐步还原为羟胺基, 并进一步还原为氨基。同时, 菌株 X2 具有广谱降解特性, 不仅可以降解 DNTS, 还可以有效地降解其他硝基芳香族火炸药污染物(如 TNT, DNT 和 MNT)。TNT 红水污染土壤的成分复杂, 处理难度大, 鞘氨醇单胞菌X2 的广谱降解特性可以极大地扩展其在环境中的应用, 为修复受各种硝基芳香族化合物污染的场地提供一种环保且廉价的方法。

