黄铁矿型 FeS2 纳米微球的制备及其超级电容性能研究
李搛倬 传秀云
造山带与地壳演化教育部重点实验室, 北京大学地球与空间科学学院, 北京 100871;† 通信作者, E-mail: xychuan@pku.edu.cn
随着城市化进程的加快, 对能源的需求大大增加。然而, 化石燃料逐渐枯竭, 环境污染日益加剧,因此开发低成本、环保和高效的能量储存与转换材料迫在眉睫。目前, 用于电化学能量存储和转换的主要器件有太阳能电池、燃料电池、锂电池和超级电容器。其中, 超级电容器是一种介于传统电容器与二次电池之间的电化学储能装置, 具有比传统电容器更高的比电容和能量密度以及比电池更高的功率密度, 且循环寿命长, 充放电效率高, 工作温度范围宽, 绿色环保, 可以填补传统电容器与电池之间的空白[1-4]。根据电荷储存机制, 可以将超级电容器分为双电层电容和赝电容。双电层电容通过电极材料与电解液界面电荷分离产生的双电层储存能量, 如石墨烯[5]、活性炭[6]、碳化纤维[7]和碳纳米管[8]等。赝电容则通过活性物质(如 RuO2[9]等金属氧化物和聚苯胺[10]等导电聚合物)在电极界面快速可逆的化学吸脱附或氧化还原反应产生。与双电层电容相比, 赝电容具有更好的电荷储存能力和更高的比电容, 是当前研究热点。
FeS2是一种常见的过渡金属硫化物, 在自然界中多以黄铁矿的形式存在, 环境相容性好, 储量丰富, 具有较高的稳定性和优异的光电性能, 在光催化和锂离子电池电极材料等领域具有广泛的应用前景[11-20]。对于 FeS2的超级电容性能, 目前仅有少量研究。
Sandhya 等[21]以四水氯化亚铁(FeCl2·4H2O)和硫粉(S)为 Fe/S 源, 将聚乙烯吡咯烷酮(PVP)和 NaOH(1M)分别作为表面活性剂和 pH 调节剂, 溶剂热制备黄铁矿型 FeS2八面体颗粒。10 mV/s 扫描速率下,FeS2电极材料在 1 M Na2SO4和 3.5 M KOH 电解液中的比电容分别为 234 和 300 F/g, 在 1 A/g 电流密度下, FeS2的比电容分别为 120 和 260 F/g。
Chen 等[22]通过添加阴离子表面活性剂十二烷基硫酸钠制备纳米级 FeS2(N-FeS2)。5 mV/s 扫描速率下, N-FeS2电极材料在 1 M Na2SO4电解液中的比电容为 308.3 F/g, 在 3 A/g 电流密度下可达 317.8 F/g, 远高于微米级 FeS2(约 175 F/g)。当扫描速率和电流密度分别提高 10 倍时, N-FeS2电极材料的电容保持率分别为 64.2%和 42.0%, 1000 次循环后的电容保持率为 81.1%, 表现出较高的稳定性。
Pei 等[23]采用两步自组装法合成石墨烯气凝胶(GA)支撑的类花状 FeS2-GA 复合材料, FeS2均匀地分布在 GA 网络中。0.5 A/g 电流密度下, FeS2-GA复合材料在 6 M KOH 电解液中的比电容为 313.6 F/g, 几乎是纯 FeS2(163.5 F/g)的两倍。在 10 A/g 电流密度下, 该复合材料经 2000 次循环后, 容量保留率为88.2%, 同时表现出较低的转移电阻。
Balakrishnan 等[24]采用水热法合成 FeS2微花,并在被还原的氧化石墨烯(rGO)上生长 FeS2微球,得到 FeS2-rGO 复合材料。5 mV/s 的扫描速率下,FeS2微花和 FeS2-rGO 复合材料在 1 M Na2SO4电解液中的比电容分别为 70.98 和 112.41 mF/cm2。0.3 mA/cm2电流密度下, 经过 10000 次循环后, 容量保持率分别为 48%和 90%, 说明 FeS2-rGO 复合材料的比电容和循环稳定性均优于 FeS2微花。
Sridhar 等[15]采用微波合成法, 在碳纳米纤维(CNF)中交联 FeS2, 得到三维介孔 FeS2-CNF 纳米复合材料, 大部分 FeS2以纳米片堆叠的形式存在。在6 M KOH 电解液中, 5 mV/s 和 100 mV/s 扫描速率下的比电容分别为 612 和 342 F/g, 2000 次循环后, 电容保持率高达 97%。这归因于材料的介孔性有利于电解质逐渐渗透到电极材料中, 到达 CNF 与 FeS2的活性位点, 分别参与 CNF 的双电层电容和 FeS2的赝电容, 也突显 CNF 与 FeS2之间具有很好的协同作用。
Zhong 等[25]采用一步水热法, 将 Fe2O3纳米微球(粒径为 100~200 nm)锚定在 FeS2纳米片(宽 1~2 μm)上, 合成异质结构的 FeS2-Fe2O3分级复合材料。1 A/g 电流密度下, 复合电极在 1 M Li2SO4电解液中的比电容为 255 F/g, 远高于纯 Fe2O3(112 F/g),同时表现出更好的倍率性能(8 A/g 电流密度下的比电容为 145 F/g)和更高的循环稳定性(5000 次循环后, 容量保持率为 90%), 归因于复合材料独特的异质结构为电荷储存提供了快速的电荷转移和大的表面积。
虽然在目前的相关研究中 FeS2均表现出较高的赝电容, 但其电化学性能存在较大的差距。除材料微观结构和形貌不同外, 所用电解液体系的不同可能也是造成差异的原因之一。为了深化 FeS2超级电容的相关研究, 为其作为超级电容器电极材料提供基础数据, 本文合成黄铁矿型 FeS2纳米微球,并且对比其在 3 种常见水系电解液(6 M KOH, 6 M NaOH 和 1 M Na2SO4)中的电化学性能, 选择适用的最佳电解液。
1 实验方法
1) 实验试剂: 七水合硫酸亚铁(FeSO4·7H2O,98%)、硫粉(S, 99%)和三乙醇胺(C6H15NO3, 分析纯)均购于国药集团化学试剂(北京)有限公司, 所有试剂使用前均未经处理。
2) 黄铁矿型 FeS2纳米微球采用溶剂热法[26]合成: 在 20 mL 三乙醇胺中加入 8 mmol 硫粉, 剧烈搅拌使其充分溶解, 然后在搅拌条件下逐滴加入 40 mL 0.1 M FeSO4·7H2O 溶液, 磁力搅拌 30 分钟, 将混合溶液转移到具聚四氟乙烯内衬的 100 mL 不锈钢反应釜中, 200℃保温 20 小时, 自然冷却至室温,过滤并收集黑色沉淀, 用去离子水和无水乙醇多次洗涤, 80℃真空干燥 10 小时, 获得 FeS2样品。
3) 材料表征: 采用日本理学Rigaku D/max2400型 X 射线衍射仪对样品进行物相分析, Cu-Kα 辐射(λ=0.l5406 nm), 工作电压为 40 kV, 工作电流为 100 mA, 扫描范围为 20°~80°, 扫描速度 4°/min。通过Nova Nano SEM 430 (美国FEI 公司)扫描电镜观察样品形貌, 加速电压为 15 kV, 束流为 176 μA。采用ASAP2010 氮气吸附-脱附测试仪(美国 Micrometer公司)测试样品的 N2吸附-脱附, 测试前在 120°C 脱气 24 小时, 测试温度为-196°C, 采用多点吸附法测定比表面积, 利用非定域密度泛函理论[27]解析得到孔径分布。
4) 电极制备和电化学性能测试: 将制备的 FeS2样品、炭黑和聚四氟乙烯(60%)按 8:1:1 的质量比混合, 加入适量无水乙醇, 制备成浆料, 均匀地涂到泡沫镍集流体上, 覆盖面积约为 1 cm2, 100℃真空干燥 12 小时, 用油压机压制成电极片(5 MPa)。用CHI660E 电化学工作站, 测试材料在 3 种常见电解液(6 M KOH, 6 M NaOH 和1 M Na2SO4)中的电化学性能。以铂片为对电极, Hg/HgO 电极(碱性溶液)或Ag/AgCl 电极(中性溶液)为参比电极, 测试项目包括循环伏安(CV)、恒电流充放电(GCD)以及电化学交流阻抗(EIS)。根据恒电流充放电曲线, 材料的单电极质量比电容C(F/g)计算公式[23]如下:

式中,I为放电电流(A),Δt为放电时间(s),m为活性物质质量(g),ΔU为Δt时间内的电压变化(V)。
2 结果与讨论
2.1 FeS2 纳米微球的结构与形貌
图1为所合成FeS2样品的XRD谱图, 可见衍射峰峰形尖锐, 峰位显著, 说明样品具有较高的结晶 度。其衍射峰出现在2θ=28.26°, 32.79°, 36.76°,40.49°, 47.23°, 55.94°, 58.77°, 61.38°, 63.98°和78.70°,与黄铁矿型FeS2标准PDF卡片(JCPDSNo.42-1340)上的衍射峰出现位置[21]吻合, 对应的晶面为(111)、(200)、(210)、(211)、(220)、(311)、(222)、(023)、(321)和(420), 未检测到其他杂峰, 证明合成的产物是较为纯净的黄铁矿型FeS2, 属于立方晶系, 具有Pa-3空间点群结构, 晶格常数为a=b=c=0.54179 nm[21]。利用谢乐公式(式(2)), 计算得样品的平均晶粒尺寸约为17 nm。
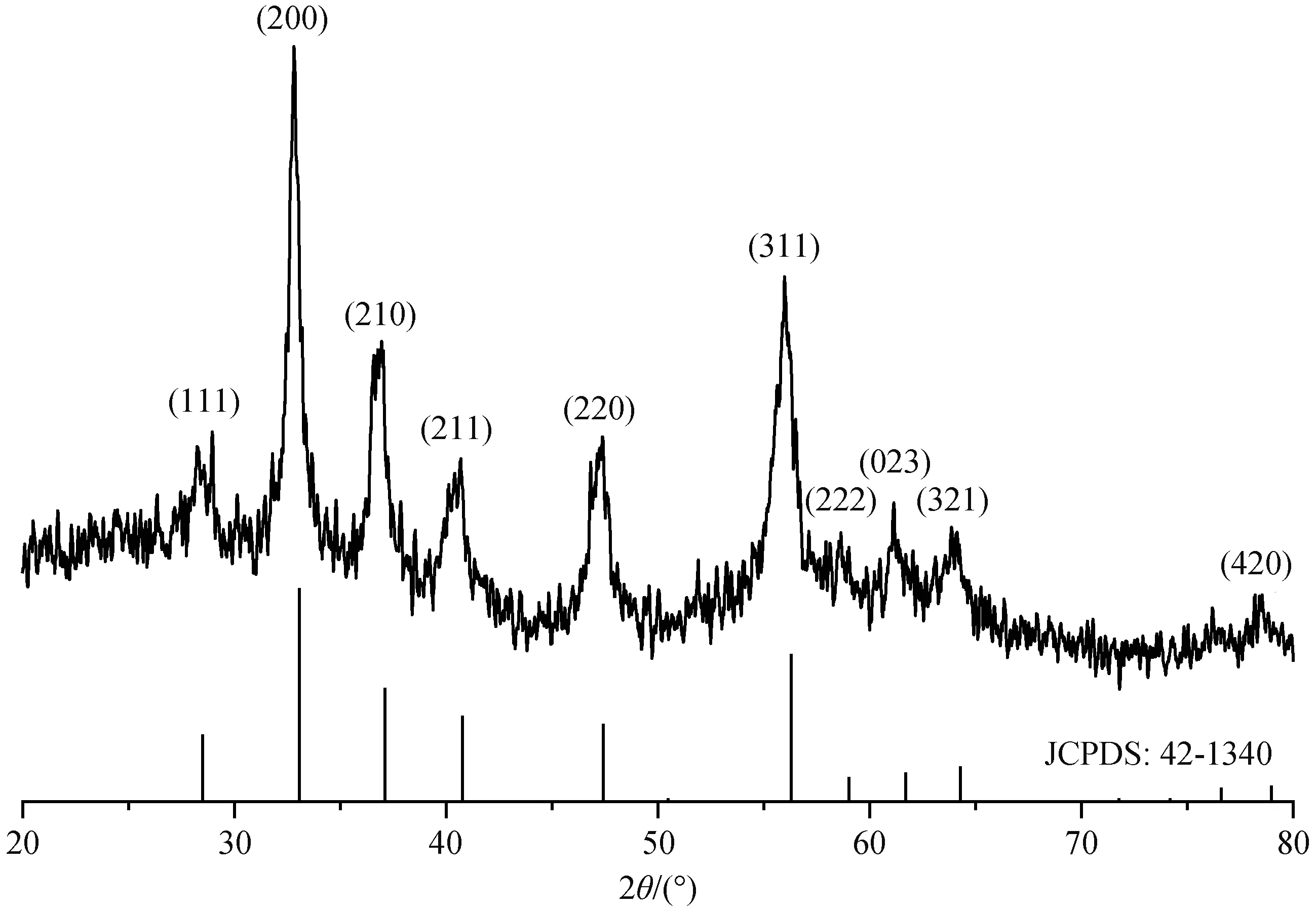
图1 FeS2 样品的XRD 谱图Fig. 1 X-Ray diffraction pattern of the synthesized pyrite FeS2

式中,D为晶粒平均尺寸,K为谢乐常数(一般为0.9),λ为X射线波长(0.154 nm),β为衍射峰半高宽,θ为对应的衍射角度。
通过场发射扫描电子显微镜(SEM)表征材料的形貌。从图2可以看出, 所制备的FeS2样品呈较均匀的球状, 平均粒径为300~600 nm, 球体之间相互堆叠, 形成孔洞, 部分发生团聚(图2(a))。放大后,可见球体表面光滑、部分球体之间相互粘连以及球体破裂处中空结构(图2(b))。黄铁矿型FeS2空心微球的演化过程与奥斯特瓦尔德成熟的形成机制[28]基本上一致, 前驱体在溶剂热条件下生成FeS2微晶, 随后微晶随机聚集, 使总界面能最小化, 形成球状结构。由于内部微晶形成于成核和生长的早期阶段, 晶粒较小, 在后续溶剂热过程中逐渐溶解而形成空腔, 壳层区域的微晶则进一步结晶, 形成空心球状结构(图2(c))。较小的粒径和丰富的孔结构有利于电极材料与电解液充分接触, 缩短电子与电解质离子的传输和扩散距离, 进而提高电极材料的利用率, 有利于其电化学性能的充分发挥[29-30]。

图2 FeS2 样品的SEM 形貌((a)和(b))及形成机理示意图(c)Fig. 2 SEM images ((a) and (b)) and schematic illustration of the formation (c) of the synthesized pyrite FeS2
图3显示合成FeS2样品的氮气吸附-脱附曲线和孔径分布。氮气吸附曲线属于Ⅱ型吸附等温线,在较低的相对压力(P/P0<0.8)下, 吸附等温线斜率较小, 上升缓慢, 表明有少量微孔和中孔存在。在较高的相对压力(P/P0>0.8)下, 等温线上升较快, 说明材料中毛细凝聚现象较严重, 有孔径较大的中大孔存在。孔径分布结果也表明材料以大于50 nm的大孔为主, 可能是由FeS2纳米微球相互堆叠形成的孔隙以及其内部的中空结构造成的。材料的比表面积为56.8 m2/g, 孔容为0.171 cm3/g, 较高的比表面积和孔容有利于电解液渗透到材料内部, 缩短电解质离子和电子的扩散距离, 减小电荷转移电阻, 提高材料的利用率。
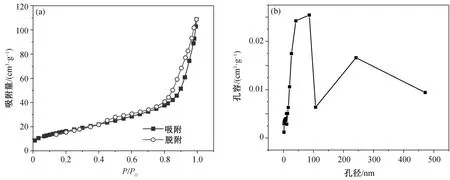
图3 FeS2 样品的氮气吸附-脱附等温线(a)及孔径分布(b)Fig. 3 N2 adsorption-desorption isotherms (a) and pore size distribution (b) of the synthesized pyrite FeS2
2.2 FeS2 纳米微球的电化学性能
为了进一步了解合成的FeS2纳米微球作为超级电容器电极材料的储能特性, 分别测试其在3种常见电解液(6 M KOH, 6 M NaOH和1 M Na2SO4)中的电化学性能, 图4显示样品在3种电解液中的循环伏安(CV)曲线。在两种碱性电解液中, 样品的CV曲线类似, 均在-0.65和-1.0 V附近出现明显的氧化峰(图4(a))和还原峰(图4(b)), 对应Fe2+与Fe3+之间的氧化还原反应[23]。其中, 电解液为KOH时,氧化峰和还原峰更加显著, 氧化峰与还原峰的峰形基本上对称, 表现出更优异的赝电容特征。随着扫描速率加大, CV曲线均发生一定程度的形变, 氧化峰向正电位方向移动, 还原峰向负电位方向移动。这是由于扫描速率增大时, 电解液离子与电极之间的有效相互作用降低, 极化增大, 导致氧化峰和还原峰逐渐发生偏移[23]。在Na2SO4电解液中, 样品的CV曲线接近矩形, 随着扫描速率增大, 曲线变形较小, 在-0.6~-0.8 V之间出现微弱的氧化还原峰, 表现出一定的赝电容特征(图4(c))。相对于两种碱性溶液, 合成的样品在Na2SO4电解液中的CV曲线具有不同的电压区间和氧化、还原峰位, 可能是由于不同的离子体系造成材料的析氢、析氧和氧化-还原电位发生变化[31-32]。对比3种电解液中FeS2样品在扫描速率为5 mV/s时的CV曲线(图4(d)), 可以看出, Na2SO4电解液中氧化峰和还原峰微弱, 曲线面积最小, 在两种碱性溶液中氧化峰和还原峰明显, 曲线面积显著增大。其中, 电解液为KOH时, 氧化峰和还原峰具有最大的电流响应, 曲线面积最大, 说明相对于另外两种电解液体系, KOH电解液中FeS2纳米微球的电化学性能显著提高。
图 5 显示不同电流密度下 FeS2纳米微球在 3 种电解液中的恒电流充放电(GCD)曲线。在两种碱性电解液中, GCD 曲线均出现充电、放电平台(图 5(a)和(b)), 与循环伏安曲线的氧化、还原峰相对应, 其中 KOH 电解液中的充电、放电平台更明显, 材料表现出更好的赝电容特征[33], 与循环伏安测试结果一致, 而 Na2SO4电解液中 GCD 曲线近似三角形,充电、放电平台不明显(图 5(c))。

图5 FeS2 样品在6 M KOH (a), 6 M NaOH (b)和1 M Na2SO4 (c)电解液中的恒电流充电、放电曲线以及不同电流密度下FeS2 在不同电解液中的比电容(d)Fig. 5 Galvanostatic charge/discharge curves for FeS2 taken in 6 M KOH (a), 6 M NaOH (b), and 1 M Na2SO4 (c)and specific capacitance of FeS2 in different electrolytes at different current densities (d)
根据式(1)计算样品在不同电流密度下的比电容, 结果如图 5(d)所示。随着电流密度增大, 3 种电解液中电极材料的比电容均逐渐减小。这是由于在低电流密度下, 电解液中的离子可以充分地进入电极内部, 并在其中移动, 提高了电极的利用率; 随着电流密度增大, 充电、放电只能在部分电极表面进行, 来不及充分地充电、放电, 导致活性物质利用率降低, 引起比电容下降[34]。在 KOH 电解液中,FeS2样品具有最高的比电容, 当电流密度为 2 A/g时, 比电容达 732.9 F/g, 同时表现出优异的倍率性能, 即使在 20 A/g 的大电流密度下, 比电容仍能达到 307.1 F/g, 容量保持率为 41.9%。优异的电化学性能可能得益于较大的比表面积和丰富的孔结构,缩短了电子和电解液离子运移距离, 提高了材料的利用率。然而, 在 NaOH 电解液中, FeS2样品的比电容显著降低, 当电流密度为 2 A/g 时, 比电容为285.8 F/g; 在 20 A/g 的大电流密度下, 比电容为 85.7 F/g。比电容的降低可能是电解液中离子摩尔电导率不同所致, K+的摩尔电导率为 73.5 cm2/(Ω·mol),Na+的摩尔电导率为 50.1 cm2/(Ω·mol), 迁移率高的K+在充电时可以自由迁移到电极与电解质的界面,放电时又回到电解液中, 因而在 KOH 电解液中, 电极材料表现出更优异的电化学性能[21]。FeS2样品在 Na2SO4电解液中表现出最低的比电容, 2 A/g 电流密度下仅为 63.5 F/g, 电流密度增大至 20 A/g 时,比电容降低至 20 F/g。原因可能是水溶液中 SO42-离子半径大, 阻碍了 Na+的流动, 此外, SO42-的摩尔电导率(159.6 cm2/(Ω·mol))也低于OH-(198 cm2/(Ω·mol)),从而降低了以 Na2SO4为电解液时电极材料的比电容[21]。
图 6 显示合成的 FeS2纳米微球在 3 种不同电解液中交流阻抗的 Nyquist 曲线及其等效电路图。在KOH 和 NaOH 电解液中, 样品的 Nyquist 曲线均包含一个半圆弧和具有一定斜率的直线, 高频区半圆弧与实轴的交点可以反映溶液电阻的大小, 半圆直径能体现活性材料与电解液的界面电荷转移电阻,反映材料在充电、放电时电荷转移的难易程度; 低频区阻抗曲线为一条具有一定斜率的直线, 表明存在由质子扩散引起的 Warburg 阻抗[34-35]。在 Na2SO4电解液中, 样品的 Nyquist 曲线出现两个半圆弧(图6(a)), 即从高频到低频, 出现两个容抗弧, 分别反映电化学体系中的电荷转移电阻和极化电阻[36]。
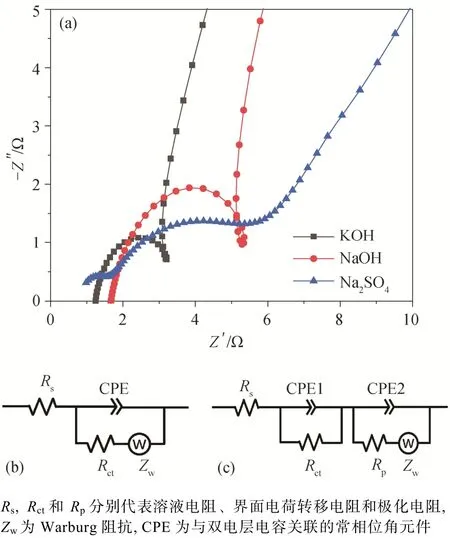
图 6 FeS2 样品在不同电解液中的 Nyquist 曲线(a)以及在KOH, NaOH (b)和 Na2SO4 (c)电解液中的等效电路图Fig. 6 Nyquist plots of FeS2 in different electrolytes (a) and equivalent circuit diagrams in KOH, NaOH (b) and Na2SO4 (c) electrolyte
通过等效电路图(图 6(b)和(c))拟合获得电阻值(表 1)。在两种碱性溶液中, 与 NaOH 电解液(Rs和Rct分别为 1.781 和 3.611 Ω)相比, KOH 电解液体系中Rs(1.355 Ω)和Rct(1.698 Ω)显著减小, 具有更低的电阻, 说明 K+较高的摩尔电导率减小了离子在充电、放电过程中的转移和扩散时间。在 Na2SO4电解液中, 体系具有最小的Rs(0.842 Ω)和Rct(0.595 Ω), 但Rp(4.269 Ω)显著增大, 导致总电阻最大, 这是 SO42-较大的离子半径和较低的摩尔电导率所致。因此, 在 3 种电解液体系中, 电阻的排序为Na2SO4>NaOH>KOH。

表1 FeS2 样品在不同电解液中的电阻Table 1 Resistance of FeS2 sample in different electrolytes
表 2 中, 将本文实验结果与文献报道的 FeS2电极材料进行比较。可以看出, 相对于前人的研究,本文制备的黄铁矿型 FeS2纳米微球在 KOH 电解液中的电化学性能突出, 可为 FeS2作为超级电容器电极材料提供新的思路: 通过对 FeS2的微观结构进行合理的设计, 能够有效地提高材料的电化学性能;寻找合适的电解液体系, 对 FeS2超级电容性能的发挥也至关重要。
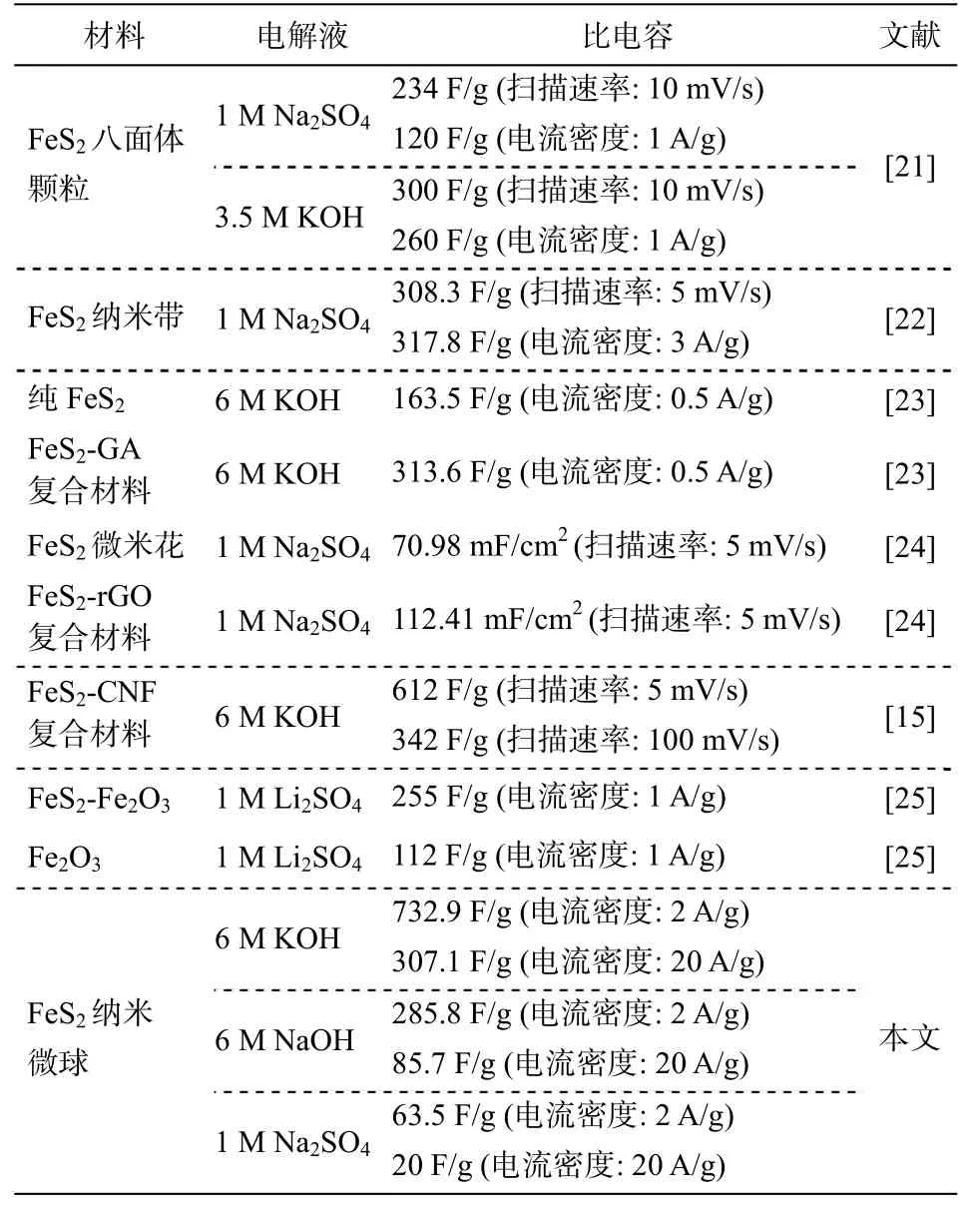
表2 不同FeS2 电极材料的比电容比较Table 2 Various FeS2 electrode materials with their specific capacitances
3 结论
本文采用溶剂热法, 成功地制备黄铁矿型 FeS2纳米微球。较小的粒径(300~600 nm)、相互堆叠形成的孔隙和球体内部的中空结构, 使得所制备的材料具有较大的比表面积和孔容(56.8 m2/g 和 0.171 m3/g), 有利于电子和电解质离子的快速运移。测试结果表明, FeS2纳米微球在 6 M KOH, 6 M NaOH 和1 M Na2SO4电解液中均表现出赝电容特征。电解液为 KOH 时, 具有最佳的电化学性能, 当电流密度为 2 A/g 时, 比电容为 732.9 F/g (在 NaOH 和 Na2SO4中分别为 285.8 和 63.5 F/g); 电流密度增大到 20 A/g时, 比电容仍达 307.1 F/g, 容量保持率为 41.9%, 是一种极具前景的超级电容器电极材料。

