DNA甲基化调控牛AQP1基因的胎盘特异性印记
刘晓倩,靳兰杰,董艳秋,李冬杰,张 萃,谷书凯,李世杰*
(1.河北农业大学生命科学学院, 保定 071000; 2.河北科技大学生物科学与工程学院, 石家庄 050018)
在哺乳动物细胞中,绝大多数位于常染色体上的基因在子代中表现为双等位基因表达,且亲本等位基因的表达水平相同。然而,一部分基因表现为只在母源染色体上表达或只在父源染色体上表达,此现象称为基因组印记[1]。根据亲本等位基因的表达状态,分为母源印记基因和父源印记基因。基因印记不仅调控胚胎和胎盘的生长,而且在胎儿出生后的生长,以及在大脑功能方面均有重要作用[2-3]。印记基因的表达紊乱还与癌症的发生和发展有关[4]。
水通道蛋白1(aquaporin 1,AQP1)基因编码质膜水运输蛋白[5],在小鼠(Musmusculus)6号染色体的Mest-Nap1l5印记区域内被鉴定为胎盘特异性的父源印记基因[6]。AQP1基因的表达与肿瘤的发生发展有关。AQP1基因表达上调会使细胞膜电位发生变化,并激活Wnt[7]、FAK[8]等一系列下游信号通路,从而促进细胞增殖及血管生成,影响肿瘤的发生发展[9]。AQP1基因的DNA甲基化调控与唾液腺腺样囊性癌、结肠癌等恶性肿瘤密切相关[10-11]。AQP1基因的缺失可以保护脑外伤,降低肿瘤生长[12]。AQP1基因在其他物种中的印记状态尚未被揭示,本研究首先对AQP1基因在牛(Bostaurus)中的印记状态进行分析。
调控印记的表观遗传修饰方式有多种,其中DNA甲基化最为重要,其中差异甲基化区(differentially methylated region, DMR)起调控作用,位于启动子区的DMR发生甲基化异常会直接导致印记基因出现双等位表达或沉默[13]。本研究应用亚硫酸氢盐测序法对牛AQP1基因启动子和第一个外显子区CpG岛在组织和胎盘中的DNA甲基化状态进行了分析,以揭示DNA甲基化修饰在调控AQP1基因印记表达中的作用机制。
1 材料与方法
1.1 试验材料
32头成年雌性荷斯坦奶牛组织样本取自河北省保定市当地屠宰场,屠宰后立即采集每个个体的组织样本(心、肝、脾、肺、肾、肌肉、脂肪)放入液氮中;15个自然分娩后的胎盘样本取自保定市某奶牛养殖场,并收集每个胎盘样本对应的母本血液和父本精子。所有样本-80 ℃保存备用。
1.2 试验方法
1.2.1 牛组织及胎盘的RNA提取及反转录 利用RNAios plus试剂盒(TaKaRa,中国)提取各组织及胎盘的总RNA;利用UEIrisⅡ RT-PCR System for First-Strand cDNA Synthesis (with dsDNase, US Everbright Inc, 美国)将RNA反转录为cDNA,置于-20 ℃冻存。
1.2.2 牛组织及胎盘的RT-PCR 通过NCBI(http://www.ncbi.nlm.nih.gov/)网站查找牛AQP1 的mRNA序列(NC_037331.1),在UCSC Genome Browser(http://genome.ucsc.edu/)Blat查找AQP1基因的DNA序列,利用Primer 5软件设计引物AQP1-2F和AQP1-R(表1),通过PCR扩增各组织及胎盘的cDNA。以GAPDH(Accession No.:BTU85042)为内参基因,设计引物Gap-F和Gap-R,扩增无内含子片段长度为375 bp。PCR反应体系(25 μL):10×LA Tap Buffer 2.5 μL,2.5 mmol·L-1dNTPs 2 μL,LA Taq DNA聚合酶0.1 μL,上、下游引物(10 μmol·L-1)各1 μL, 模板1 μL(50 ng),ddH2O 17.4 μL。反应条件:94 ℃ 预变性5 min;94 ℃变性30 s,44 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。扩增产物用1.5%琼脂糖凝胶电泳检测。
1.2.3 牛心组织及胎盘的DNA提取及SNP鉴定 利用DNA提取试剂盒(生工,上海)提取32头 荷斯坦奶牛心组织的DNA和15头荷斯坦奶牛胎盘的DNA。引物为AQP1-1F、AQP1-R(表1)通过PCR扩增技术扩增1 615 bp的DNA片段。PCR反应体系及条件同“1.2.2”,其中退火条件为52 ℃, 60 s。扩增产物用2.0%琼脂糖凝胶电泳检测,并对产物进行纯化回收及测序。查看测序结果,找到双峰的SNP位点即可确定杂合子个体。

表1 引物信息
1.2.4 牛杂合子个体和杂合子胎盘的等位基因表达及印记状态分析 以杂合子个体各组织(心、肝、脾、肺、肾、肌肉和脂肪)及胎盘cDNA为模板,利用跨内含子引物AQP1-2F、AQP1-R, PCR扩增包含SNP位点的717 bp片段。反应体系及条件同“1.2.2”,反应条件中退火的温度为52 ℃。对扩增产物进行回收测序。通过SNP位点处测序峰图,确定AQP1基因的等位基因表达状态。结合杂合子胎盘对应的父母基因型,确定AQP1基因的印记状态,若SNP位点表达与父本相同,则为父源表达母源印记;若SNP位点表达与母本相同,则为母源表达父源印记。
1.2.5 亚硫酸氢盐处理DNA模板及巢式PCR扩增 使用Zymo甲基化试剂盒对牛基因组DNA模板进行亚硫酸氢盐处理,从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中获取牛AQP1基因序列,分析基因启动子区富含CG的序列,利用MethPrimer在线软件对序列进行转换,即非CG位点的C均替换为T,并依据此序列设计甲基化特异的巢式PCR引物(表1)。巢式PCR外侧引物为M-F1、 M-R1,扩增片段长度为582 bp;内侧引物为M-F2、M-R2,扩增序列长度为471 bp,引物序列见表1。外侧引物PCR扩增体系及条件同“1.2.2”,反应条件中退火的温度为50.6 ℃。取1 μL PCR产物稀释30倍后作为内侧引物扩增的模板,PCR反应体系及条件同“1.2.2”,反应条件中退火的温度为49.9 ℃。将二次PCR产物进行胶回收,产物进行克隆测序。
1.2.6AQP1基因启动子DNA甲基化PCR产物克隆、测序 将pMD19-T载体(TaKaRa)与胶回收产物进行连接,转入大肠杆菌DH5α感受态细胞,加入500 μL LB液体培养基,在37 ℃摇床内150 r·min-1摇菌培养2 h。配制含有氨苄青霉素(100 mg·mL-1)的固体LB培养基,倒于培养皿中,向培养基中加入4 μL IPTG(200 ng·μL-1)和25 μL X-gal(20 mg·μL-1),取培养好的菌液200 μL, 均匀涂到培养基上,倒置于37 ℃恒温箱中,培养过夜。次日挑取白色单一阳性克隆置于加有氨苄青霉素的液体培养基中,37 ℃、200 r·min-1振荡培养12 h。
将培养好的菌液进行测序。将检测序列与转化后的DNA序列进行比较,分析甲基化状态,甲基化CpG位点的C无变化,而非甲基化CpG位点的C变成T。
2 结 果
2.1 AQP1基因在不同组织中的表达检测
用RT-PCR检测AQP1基因在牛7个组织中的表达情况。随机提取3头牛心、肝、脾、肺、肾、肌肉和脂肪组织的RNA及3个胎盘的RNA,反转录生成cDNA,相同组织cDNA混合为模板,用AQP1-2F和AQP1-R为引物,均获得1条长为717 bp的序列条带(图1A,图2A)。对扩增产物进行回收并测序,序列分析确定为AQP1基因外显子片段,表明AQP1基因在牛心、肝、脾、肺、肾、肌肉、脂肪组织和胎盘中均有较高的表达量。
2.2 AQP1基因在牛组织中的等位基因表达分析
2.2.1 牛组织中AQP1基因的SNP检测 以32头牛的基因组DNA为模板,扩增AQP1基因片段,引物为AQP1-1F和AQP1-R,得到1 615 bp的DNA片段,产物直接回收测序,分析测序峰图发现两个杂合SNPs(rs382748905、rs108948845)位点(图1B),分别位于扩增产物的786 bp(C/T)和1 033 bp (T/C)处。存在杂合SNP的个体称为杂合子个体,鉴定出的杂合子个体与纯合子个体比例为5∶27。鉴定的杂合子牛用于AQP1基因在牛组织的等位基因表达分析。
2.2.2AQP1基因在牛组织中的等位基因表达分析 对比杂合子牛的DNA水平和不同组织的转录水平SNP位点处测序峰图,确定AQP1基因在牛不同组织中的表达状态。结果显示,AQP1基因两个SNPs在7个被检测的牛组织中均为双峰(图1C),表明AQP1基因在被检测的组织中为双等位基因表达。
2.3 AQP1基因在牛胎盘中的等位基因表达分析
2.3.1 牛胎盘中AQP1基因的SNP检测 以15头牛胎盘的基因组DNA为模板,用2.2.1相同引物扩增AQP1基因片段,得到1 615 bp的DNA片段,产物直接回收测序,分析测序峰图发现1个杂合SNP(rs380460668)位点(图2B),位于扩增产物680 bp(T/C)处。存在杂合SNP的胎盘称为杂合子,鉴定出的杂合子与纯合子比例为1∶4。鉴定的3个杂合子牛胎盘用于AQP1基因在牛胎盘中的表达分析。
2.3.2AQP1基因在牛胎盘中的等位基因表达分析 对比杂合子牛胎盘在DNA水平和转录水平的SNP位点处测序峰图,确定AQP1基因在牛胎盘中的表达状态。结果显示,AQP1基因1个SNP在牛胎盘中SNP位点为单峰(C/T),即AQP1基因在牛胎盘中为单等位基因表达。同时检测杂合子胎盘对应的亲本基因型,结果显示,表达为C的杂合子胎盘对应的父本为T纯合,母本为C纯合;表达为T的杂合子胎盘对应的父本为C纯合,母本为T纯合(图2B)。因此确定,牛AQP1基因在胎盘中为母源等位基因表达。
2.4 AQP1等位基因特异的甲基化状态分析
通过利用亚硫酸氢盐测序法分析AQP1基因位于启动子和第一个外显子区的CpG岛在牛精子、胎盘、心脏和肝脏组织中的DNA甲基化状态,来确定DNA甲基化在AQP1基因印记表达中可能的作用。将杂合子牛组织 DNA(6号牛的心脏和肝脏DNA)、杂合子胎盘DNA(1、2号胎盘DNA)及对应精子DNA进行亚硫酸氢盐处理后作为甲基化模板,使用巢式PCR引物M-1F和M-1R (表1)扩增582 bp片段,扩增产物直接测序,发现1个杂合位点A/G(rs479118658),该位点用于区分等位基因的两条链(A链和G链)。用引物M-2F和M-2R扩增包含上述杂合位点的471 bp区域,包括15个CpG位点(图3A)。将扩增产物进行克隆测序。克隆测序结果显示,在双等位基因表达的杂合子牛心脏、肝脏组织中,两条亲本链(A链和G链)均呈现重甲基化状态;以2个单等位基因表达的杂合子牛胎盘为例,在单等位基因表达的杂合子牛胎盘中,两条亲本链(A链和G链)呈现出甲基化差异,A链为轻甲基化状态,G链为重甲基化状态;同时对应的父源等位基因(G链)精子中为重甲基化状态(图3B)。以上研究结果说明,DNA甲基化修饰参与调控牛AQP1基因的胎盘印记表达。
3 讨 论
目前,在人(Homosapiens)和小鼠中被鉴定的印记基因有150多个[14],而与人和小鼠相比,已在牛中被鉴定的印记基因数目较少。水通道蛋白(AQPs)是一种小的膜蛋白家族,对水和小的中性溶质在多种生物膜中的跨膜运输起促进作用[15]。其中,Aqp1基因编码的AQP1蛋白是该家族中第一个被发现的成员[12,16],是目前该家族中被主要研究的成员。AQP1是人体红细胞的主要水分通道,负责调节红细胞的水渗透性[17],并协助气体通过红细胞膜运输[18-19]。本研究应用RT-PCR方法分析AQP1基因在牛不同组织中的表达,发现AQP1基因在牛的心、肝、脾、肺、肾、肌肉和脂肪组织中广泛表达。而Aqp1基因在小鼠的肺[20]、肾[21]、回肠[22]、微血管和心的内皮细胞[23]中也均有表达。说明AQP1/Aqp1基因在不同组织的发育中有非常重要的作用。
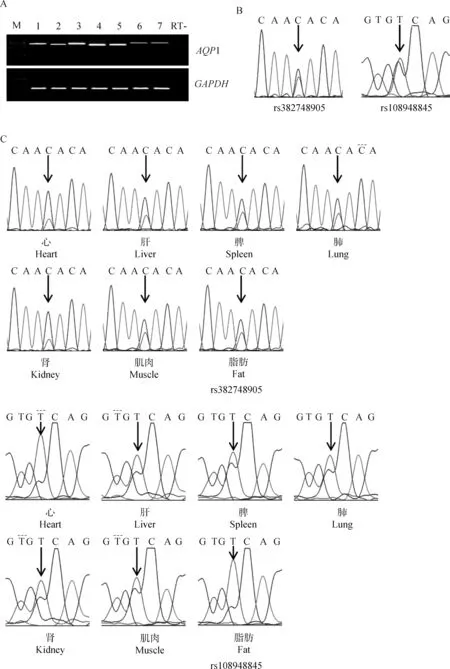
A. AQP1在牛被检测组织中的表达:1~7.心、肝、脾、肺、肾、肌肉和脂肪;M.DNA 相对分子质量标准(DL2000:2 000、1 000、 750、500、250、100 bp);RT-.阴性对照。B.牛AQP1基因SNPs的鉴定,箭头位置为SNPs位置。C.杂合子牛心、肝、脾、肺、肾、肌肉和脂肪的RT-PCR测序峰图,箭头位置为SNPs位置A.The expression levels of AQP1 in different tissues of cattle:1-7.RT-PCR products obtained from heart, liver, spleen, lung, kidney, muscle and fat;M. DNA marker(DL2000:2 000,1 000,750,500,250,100 bp);RT-. Negative control. B. Identification of SNPs in bovine AQP1 genes, the arrows point the position of SNPs. C. Sequence chromatograms of RT-PCR products obtained from 7 tissues of heterozygous cattle, including heart, liver, spleen, lung, kidney, muscle and fat, the arrows point the position of SNPs图1 牛AQP1基因在不同组织中的表达及印记状态Fig.1 Expression and imprinting status of AQP1 gene in different tissues of cattle

A.AQP1在牛胎盘中的表达:1~3.胎盘1、2、3; M. DNA相对分子质量标准(DL2000:2 000、1 000、750、500、250、100 bp);RT-.阴性对照。B. 牛胎盘基因组中AQP1基因SNPs的鉴定,及通过SNP位点对3个杂合子胎盘的gDNA、cDNA及父母源基因型进行对比,结果显示,AQP1基因为母源表达父源印记A.The expression levels of AQP1 in placenta of cattle: 1-3.RT-PCR products obtained from different placentas; M. DNA marker(DL2000:2 000,1 000,750,500,250,100 bp);RT-. Negative control. B. Identification of AQP1 gene SNPs in cattle placenta genome, and comparison of gDNA, cDNA and parental genotypes of 3 heterozygous placentas through SNP sites, results showed that AQP1 gene was the expression of maternal paternal imprinting图2 牛AQP1基因在胎盘中的表达及印记状态Fig.2 Expression and imprinting status of AQP1 gene in different placentas of cattle
胎盘对哺乳动物的发育至关重要,它参与了母体和胎儿之间气体、营养和废物的交换[24]。许多印记基因在胎盘中表达,在胎盘中它们合成控制细胞周期、细胞信号和血管化以及营养物质摄取、利用和储存的蛋白质[25],调控胚胎和胎盘的生长发育[26]。例如,Grb10调控胚胎和胎盘的重量[14],Phlda2抑制胎盘滋养层的发展,调节胎盘的营养需求[27]。胎盘印记基因的表达也可能作为未来反映健康状况的生物标志物,如婴儿神经发育和4岁时的骨骼健康[28-29]。母源等位基因表达的缺失会促进母体营养物质向胚胎的转移,从而抑制胎盘的生长,而父源等位基因表达的缺失则会促进胎盘生长发育[30-32]。在小鼠中,Aqp1基因被鉴定为母源等位基因表达、胎盘特异性的印记基因[6]。在Aqp1基因敲除的小鼠中,胚胎和胎盘都过度生长,说明Aqp1基因在胎盘发育中起抑制作用[6]。本研究发现,牛的AQP1基因在心脏等组织中为双等位基因表达,而在胎盘中呈现为母源等位基因表达,这与Aqp1在小鼠为胎盘特异性印记的结果一致,说明AQP1基因在胎盘的生长发育中发挥重要作用。

A. 牛AQP1基因的基因结构及启动子和第一个外显子区CpG位点位置。CpG岛横跨第1个外显子并包含15个CpG位点;箭头为转录方向,黑方框为外显子,黑点为CpG位点。B. CpG岛甲基化分析。胎盘在CpG岛发现甲基化差异区,组织在CpG岛未发现甲基化差异区,且精子为重甲基化;白圈为非甲基化状态,黑圈为甲基化状态A. Gene structure and CpG location of bovine AQP1.The CpG island spans exon 1 and contains 15 CpG sites; The arrow is the direction of transcription, the black boxes are exons, the black spots are CpG sites. B. Methylation analysis of CpG islands. The CpG islands from placenta show differentially methylated region; The tissues show no differentially methylated region, and hyper-methylation status in sperm. The white circle is the non-methylated status, the black circle is the methy-lation status图3 AQP1基因结构及启动子区CpG岛甲基化状态Fig.3 AQP1 gene structure and methylation status of CpG islands in its promoter in bovine
DNA甲基化是哺乳动物基因组DNA上的一种主要的表观遗传修饰,其主要发生在富含有CpG二核苷酸的区域,亦称为CpG岛[33]。通常发生在基因启动子和第一个外显子区域的甲基化,通过直接抑制转录因子的结合,或通过与甲基化-CpG结合蛋白(methyl-CpG binding Proteins)相结合形成异染色质,从而抑制基因的表达[34-35]。在小鼠中,Aqp1基因启动子区的甲基化调控其在不同组织中的表达[6]。此外,位于基因启动子区的差异甲基化区(DMR)还是调控基因组印记的一种主要方式。例如,在牛的印记基因ZNF597[36]和AXL[37]的启动子区均发现了甲基化差异区。本研究发现,在AQP1印记表达的胎盘中AQP1基因的启动子和第一个 外显子区域存在DMR,而在AQP1双等位基因表达的心脏、肝脏组织中缺少此DMR,说明DNA甲基化参与调控AQP1基因的胎盘特异性印记表达。
4 结 论
AQP1基因在牛中为胎盘特异性单等位基因表达的父源印记基因,胎盘中位于AQP1基因启动子和第一个外显子区CpG岛的DMR调控该基因的父源印记表达。AQP1基因在牛中被检测的7个组织中为双等位基因表达。本研究关于牛AQP1基因印记状态和CpG岛甲基化状态的试验结果,可为深入探讨牛AQP1基因功能和印记相关的分子机理提供参考依据。

