sCLU蛋白、S100B和NSE在早产儿脑损伤早期诊断中的应用价值
张 泓 李 慧 李 军 施元美 殷小平
无创、敏感的生物标志物在发育期脑损伤的早期诊断、预后评估中的作用是目前国内外研究的热点。丛生蛋白(Clusterin,CLU )是一种多功能的异二聚体糖蛋白,最近已在儿科临床中被用作多种疾病的早期诊断的生物标记物[1-3],其在脑神经细胞死亡调节中的作用已引起学者们的关注。CLU外周可检测到的是60-kDa糖化前体分泌CLU (s CLU)。有研究表明sCLU的分泌增加对缺血引起的脑损伤有很好的保护作用[4],据此推断检测早产儿脑损伤(Brain Injury in Premature Infants,BIPI)患儿血清sCLU的水平对BIPI的早期诊断及预后评估具有潜在的临床价值。本研究通过动态检测BIPI患儿的血清sCLU、S100钙结合蛋白B(S100B)及神经元特异性烯醇化酶(NSE)水平变化,分析其在BIPI早期诊断中的临床应用价值。
1 资料与方法
1.1 研究对象和分组
2018-08—2020-10本院新生儿科病房住院的胎龄28-34周的早产儿98例作为研究对象,其中男63例,女35例;胎龄28-34周,平均胎龄31.8±1.5周,胎龄28-32周41例,32—34 周57例;出生体重 850—2 760g,平均1 650±389g,其中 <1 500g 31例,≥ 1 500g 67例。按照2012版《早产儿脑损伤诊断与专家共识》的诊断标准[5],以生后4—7天的头颅B超和(或)MRI扫描结果,将早产儿分为脑损伤组48例和无脑损伤组(对照组)50例。脑损伤组中出血性脑损伤22例,缺血性脑损伤26例;轻度脑损伤31例,重度脑损伤17例;剖宫产26例;自然分娩22例;早产因素:妊娠高血压11例,胎盘早剥6例,胎膜早破25例,不明原因早产6例;出生后有新生儿呼吸窘迫综合征(NRDS)35例;围产期窒息史21例;使用经鼻持续气道正压通气(nCPAP)/ 机械通气39例。对照组中剖宫产24例,自然分娩26例;早产因素:妊娠高血压18例,胎盘早剥3例,胎膜早破21例,不明原因早产8例;早产儿出生后有NRDS 15例;围产期窒息史19例;出生后使用nCPAP/ 机械通气29例。排除标准:(1)严重先天性畸形、遗传代谢性紊乱所致脑损害、低血糖脑病、胆红素脑病、中枢神经系统感染等特定中枢神经系统疾病;(2)颅脑 B 超或 MRI 检查提示单纯脑室稍扩大。本研究获得家长书面知情同意及医院伦理委员会批准。两组早产儿基本情况差异均无统计学意义(P>0.05)。见表1。

表1 两组患儿一般资料比较
1.2 观察指标和方法
血样采集及血清标志物测定:于出生后1h、12h、3天采集静脉血3ml,离心分离血清,并将血清置于-80℃冰箱保存。采用ELISA 法测定血清sCLU、S100B 蛋白、NSE浓度,sCLU试剂盒和S100B蛋白试剂盒由云克隆公司提供,NSE试剂盒由上海蓝基生物科技有限公司提供,严格按说明书进行操作。所有早产儿入院3天内均无如输血、换血、抗凝溶栓等影响主要观察指标的相关治疗。
1.3 统计学处理

2 结 果
2.1 两组早产儿血清sCLU、S100B和NSE水平比较
sCLU 水平:脑损伤组患儿出生后1h 和12h sCLU 水平均高于对照组,差异有统计学意义(P均<0.01);两组出生后第3天 sCLU 水平差异无统计学意义(P>0.05)。对照组出生后1h、12h 和 3天 sCLU水平差异无统计学意义(P>0.05)。脑损伤组出生后3天内sCLU水平差异有统计学意义(P<0.01),与出生后1h 比较,出生后 12h sCLU 水平升高(t=-3.85,P<0.01),出生后 3天 sCLU 水平降低(t=6.25,P<0.01);与出生后 12h 比较,出生后 3天 sCLU 水平显著降低(t=8.13,P<0.01)。见表2。
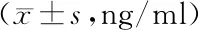
表2 两组早产儿sCLU蛋白水平的比较
S100B水平:脑损伤组患儿出生后1h 和12h S100B水平均高于对照组,差异有统计学意义(P均<0.01);两组出生后第3天S100B水平差异无统计学意义(P>0.05)。对照组出生后1h、12h 和 3天S100B水平差异无统计学意义(P>0.05)。脑损伤组出生后3天内S100B水平差异有统计学意义(P<0.01),与出生后1h 比较,出生后 12h S100B水平差异无统计学意义(P>0.05),出生后 3天S100B水平明显降低(t=10.60,P<0.01);与出生后 12h 比较,出生后3天 S100B水平降低(t=9.18,P<0.01)。见表3。
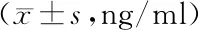
表3 两组早产儿 S100B 蛋白水平比较
NSE水平:脑损伤组患儿出生后1h、12h、3天NSE水平均高于对照组,差异有统计学意义(P均<0.01)。对照组出生后1h、12h 和 3天NSE水平差异无统计学意义(P>0.05)。脑损伤组出生后3天内NSE水平差异有统计学意义(P<0.01),与出生后1h 比较,出生后 12h和3天 NSE水平升高(t=-5.85、9.30,P<0.01);与出生后 12h 比较,出生后3天NSE水平差异无统计学意义(t=2.01,P>0.05)。见表4。

表4 两组早产儿NSE水平的比较
2.2 各指标对BIPI诊断价值ROC曲线
单项指标检测显示,出生后1h的S100B截断值为5.82ng/ml检测的特异度最高,为96.20%,AUC值为0.886。出生后12h的sCLU截断值为0.56ng/ml时敏感度最高,为81.20%,AUC值为0.894,出生后12h时联合(sCLU+NSE)比其它各单项指标以及联合sCLU+S100B的敏感度和特异度更好,敏感度和特异度分别达到91.60%,97.10%,AUC值也最大,为0.926。见图1、表5、表6和表7。

图1 各指标对BIPI诊断价值的ROC曲线分析图

表5 出生后1h各指标对BIPI的诊断价值

表6 出生后12h各指标对BIPI的诊断价值

表7 出生后3天各指标对BIPI的诊断价值
3 讨 论
随着围产医学技术的进步,早产儿存活率得到显著提高,但早产儿相关并发症的发生率仍然较高,脑损伤作为早产儿常见并发症,严重影响着早产儿生存质量[6]。法国一项多中心研究表明,胎龄< 33周、极低出生体重的早产儿有10%—14%会发生脑性瘫痪,40%—50%会出现认知缺陷、行为/心理障碍、癫癎和视听障碍,导致这些问题的脑白质损伤发生率高达75%[7]。这些问题将会严重影响患儿的生存质量,给家庭和社会带来沉重的负担。
早期诊断、早期干预治疗是降低BIPI发生的关键所在,然而新生儿脑损伤的临床表现较为隐匿,目前评估新生儿脑损伤风险的方法具有内在的局限性。临床神经检查如GMs应用过程复杂,结果分析较困难,不易掌握,其可靠性不高[8]。脑部MRI的预测能力有其局限性,它对弥漫性脑白质损伤及微小坏死灶的敏感性低,还需要较为复杂的设施及解决噪音问题,不能作为临床评价脑发育的常规指标。常规和振幅整合脑电图也提供了有用的预测信息,但与MRI一样,它们需要专门的设备和专业解读知识[9]。故当临床症状和监测参数发生明显变化时,往往已错过最佳治疗时机[10]。
随着分子生物学等技术在医学中的广泛应用,人们对脑损伤的病理机制认识不断加深,一些反映脑损伤的生物学标志物被陆续发现并受到关注,对指导治疗及改善预后非常关键。CLU是一种高度保守的,普遍存在的异源二聚体硫酸化糖蛋白,该蛋白广泛表达于机体多种组织中,发挥促细胞聚集、组织修复、补体抑制、调节细胞凋亡等多种功能[11]。sCLU作为新近发现的一种新型外周生物标记蛋白,最近已经在儿科临床中被用作多种疾病的早期诊断和治疗评估的生物标记物,包括小儿狼疮肾病[1]、手足口病[2]、儿童克罗恩病(Crohn Disease)[3]和B细胞急性淋巴细胞白血病等。
以往文献的数据表明[4],CLU是一种细胞保护伴侣蛋白,其浓度可随应激的反应而增加,如促凋亡损伤、缺血缺氧、氧化应激、蛋白毒性等病理状态。有研究发现[12]血清CLU浓度的升高与缺血性中风独立相关,并可能作为周围生物标志物,以帮助临床评估缺血性中风及其严重程度。
有研究发现在缺血性卒中的动物模型中,神经元和星形胶质细胞在缺血性损伤后早期CLU表达呈高水平[4]。但目前尚无关于BIPI的这方面的研究报道。本次研究发现发生BIPI出生后1h sCLU水平升高,12h达到峰值,显著高于对照组。从ROC曲线中也可以进一步看到,sCLU对诊断脑损伤的灵敏度和特异性较好。推测其机理,BIPI患者可因能量物质缺乏而使钠离子与钙离子的跨膜浓度梯度恢复机制无法运作,过度钙离子内流可致细胞内磷脂酶与蛋白酶激活而改变线粒体的新陈代谢,再经过三羧酸循环而使酶底物减少导致线粒体中分子氧下降,触发自由基的形成导致线粒体膜与线粒体DNA损伤,使神经细胞恢复ATP水平受损,出现局部高能磷酸耗尽而引发神经细胞凋亡[13],此过程可诱导sCLU代偿性上调而实现抗神经细胞凋亡,保护神经功能。Pereira等[14]描述了CLU对细胞凋亡的保护分子机制;认为CLU可以通过调节几种细胞内途径来直接或间接地影响细胞凋亡。这些途径包括:胰岛素生长因子1(IGF-1)途径、KU70/BCL-2相关X蛋白(BAX)途径、肿瘤坏死因子-α(TNF-α)途径、细胞死亡的BCL-2拮抗剂(BAD)途径和有丝分裂原激活蛋白激酶(MAPK)途径。因而可尝试将sCLU作为BIPI的诊断标记物。
S100B蛋白是S100蛋白家族的成员之一,主要富集于中枢神经系统的星形胶质细胞和垂体前叶细胞,存在于多种体液中,如脑脊液、血、尿、羊水、唾液及奶中[15],脑脊液中表达最高,与新生儿脑损伤的范围及预后密切相关。据报道,S100B蛋白可能发挥双重作用,低剂量时有益,高剂量时有害,原因可能为高水平的S100B蛋白导致星形胶质细胞释放有神经毒性的NO。动物模型显示,缺氧缺血1h后S100B蛋白的表达即显著增加[16];而剥夺氧气、葡萄糖或血清等模拟其他脑损伤的细胞模型中,星形胶质细胞亦释放大量S100B蛋白,提示S100B蛋白是不同脑损伤的有效生物学标志物。Gazzolo等[15]报道了发生新生儿缺氧缺血性脑病(HIE)的新生儿的外周血S100B蛋白水平在出生后6h达到高峰,24h逐渐下降。出生后2h S100B蛋白水平达到8.5ng/ml时对脑损伤的预测的敏感度为71%,特异度为90%,且早于临床、实验室或超声诊断之前。金越等[17]研究证实,动态监测脑损伤早产儿脐血及尿S-100B蛋白水平,可作为脑损伤早期预测的敏感标志物。本研究也表明脑损伤早产儿S100B蛋白表达水平于生后1h,12h显著高于对照组,到生后3天下降,生后1h的S100B蛋白水平达到5.82ng/ml时对脑损伤预测的敏感度和特异性度好,分别为68.90%和96.20%,结果与文献结果[17]相符。因此S100B蛋白也可以作为早产儿脑损伤的早期标记物,为临床诊断提供帮助。
NSE是一种糖酵解酶,主要存在于神经元及神经内分泌细胞的胞质中。相关研究发现,脑脊液及血液中NSE 的水平与围生期窒息和脑损伤相关。邱洁[10]研究表明,脑脊液及血液中NSE的水平与HIE相关,当神经元受损时,胞质中的NSE迅速释放入脑脊液中,导致NSE的水平增高;在血脑屏障发育不成熟或受损的情况下,脑脊液中的 NSE进入血液中,导致血液中NSE水平也随之升高,其水平可反映神经元死亡的程度,尽早了解脑损伤程度[18]。目前NSE作为足月儿脑损伤的生物学标记物在临床上已广泛使用。本研究发现脑损伤组患儿NSE表达水平于生后1—12h水平开始上升,到生后3天达到峰值,显著高于对照组,生后3天NSE水平达到40.16ng/ml时对脑损伤预测的敏感性和特异性较好,分别为70.20%和90.60%,结果与文献结果[19]相符。因此NSE水平对早产儿脑损伤的诊断存在意义,尤其是出生后3天。
有研究发现S100B蛋白在血中的半衰期短,不足1h,导致在外周血中的检测浓度不稳定,故最近新生儿抗脑损伤国际协助组的一项多国联合研究尝试采用检测唾液S100B预测新生儿脑损伤,检测结果仍然是偏差太大,只好采用中位数法反映S100B浓度的大致范围[15]。另外,NSE也存在于血小板及红细胞上,所以NSE水平亦与溶血程度相关。另外新生儿感染性、脑出血等疾病同样表现为 NSE 升高。因此临床上单纯应用血清 NSE或S100B进行评估尚存在不足之处[20]。另外在研究过程中我们也发现刚出生的早产儿尤其是极低出生体重儿,出生后早期生命体征常不平稳,采血困难,易造成溶血发生,且易受母体因素影响。而生后3天采血时检测指标的浓度都已明显下降,与对照组差异不显著,对临床指导价值不大。所以选择生后12h这个节点来检测对早产儿脑损伤进行评估,临床上可操作性更大。
为了提高诊断的敏感度和特异度,本文尝试将sCLU分别与S100B及NSE联合检测后进行比较.发现出生后12h sCLU与NSE联合检测AUC、敏感度、特异度均最大(0.926, 91.60%、 97.10%),考虑可能与sCLU检测受临床辅助设备如呼吸机等的影响更小,有助于减少因辅助治疗而对诊断结果造成的影响。因此sCLU、NSE联合检测对早产儿脑损伤具有较好的诊断价值。
综上所述,血液中sCLU、S100B及NSE水平检测对BIPI的诊断具有一定的价值, 尤其将出生后12h sCLU和NSE进行联合检测,对BIPI的诊断价值较好。本研究尚存在一些不足之处,针对不同类型及不同严重程度脑损伤未进一步分组研究,受时间和样本量所限,也未来得及对患儿认知发育水平进行的远期随访,希望将来能纳入更多的样本量分析sCLU 与患儿脑瘫发生情况及其相关性,评估sCLU预测远期临床结局的临床价值。
◀

