ER阳性以及HER2阴性转移性乳腺癌患者应用哌柏西利联合内分泌治疗的真实世界研究
韩 颖,严 颖,宛凤玲,邸立军
乳腺癌中60%~70%为雌激素受体(estrogen receptor,ER)阳性乳腺癌,其肿瘤细胞的增殖和存活依赖雌激素信号的激活,因此内分泌治疗是此类型乳腺癌的主要治疗方法[1-2]。周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)是参与细胞周期调节的关键激酶,其活性增强可导致细胞增殖失控,而后者是肿瘤的基本特征[3]。CDK4/6 可与周期蛋白D1(cyclin D1,CCND1)形成复合物,通过诱导Rb 蛋白磷酸化,促进细胞通过G1/S 期限制点,诱导细胞增殖。此外,雌激素可通过ER 介导的信号转导途径激活CCND1 基因转录,半数以上的乳腺癌组织中都存在CCND1 过表达[4-5]。CDK4/6 抑制剂哌柏西利联合内分泌治疗的PALOMA 系列研究[6-8]奠定了该疗法在ER 阳性以及人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性的转移性乳腺癌(metastatic breast cancer,MBC)中的地位。其中,PALOMA-2 Ⅲ期临床研究[6]是首个将ER阳性MBC 患者的中位无进展生存(progressionfree survival,PFS)期延长至超过2 年的Ⅲ期临床研究,该研究显示哌柏西利联合来曲唑组的中位PFS 期为24.8 个月,对照组仅为14.5 个月(风险比为0.58,P<0.001)。
迄今为止,尚未见有关中国MBC 患者接受哌柏西利联合内分泌治疗的真实世界研究。本研究通过描述真实世界中45例接受哌柏西利联合内分泌治疗的ER 阳性以及HER2 阴性MBC 患者的治疗经过,旨在探讨中国MBC 患者接受哌柏西利联合内分泌治疗的治疗模式、耐受性和疗效。
1 资料与方法
1.1 临床资料
研究对象为2018 年10 月—2019 年12 月在北京大学肿瘤医院接受哌柏西利联合内分泌治疗的ER 阳性以及HER2 阴性MBC 患者,排除无完整临床或病理资料的患者以及在本院就诊后短期失访的患者。查阅所有入组患者的病史,收集人口统计学、肿瘤组织形态学和生物特征、既往史以及治疗情况等资料。
1.2 治疗方法
入组患者接受哌柏西利联合内分泌治疗。哌柏西利的推荐起始剂量为125 mg(1 次/d),连续治疗21 d 后,停药7 d(即3/1 给药方案),28 d 为1 个治疗周期。部分老年患者以及美国东部肿瘤协作组体能状态(Eastern Collaborative Oncology Group Performance Status,ECOG PS)评分≥1分、多发骨转移和基础骨髓功能较差的患者接受哌柏西利100 或75 mg 起始剂量治疗。
1.3 治疗模式及治疗耐受性评估
哌柏西利联合内分泌治疗的治疗模式以治疗线数表示。治疗线数的定义是乳腺癌转移阶段接受哌柏西利联合内分泌治疗的线数。同时,采用标准剂量强度(dose intensity,DI)、实际DI 和相对DI 评估治疗的完成情况。治疗耐受性评估方面,计算所有入组患者因药物相关不良反应而导致药物减量和治疗延迟的发生率。
1.4 随访以及疗效和安全性评估
随访截至2020 年1 月31 日。所有入组患者于治疗开始前以及每2 个治疗周期接受影像学检查(CT 或MRI)以评价疗效,每个治疗周期前接受实验室检查(包括血常规和肝肾功能)和心电图检查以评价治疗的安全性。
疗效评价标准采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1 版,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。临床获益率(clinical benefit rate,CBR)为获得CR、PR 和SD 的病例数占可评价病例数的百分比。由于随访时间较短,未达到中位PFS 期,因此本研究仅分析入组患者的疗效。
不良反应采用美国国立癌症研究所通用不良事件术语标准(National Cancer Institute-Common Terminology Criteria for Adverse Events,NCI-CTCAE)5.0 版进行评估。
1.5 统计学方法
应用SPSS 20.0 软件进行统计学分析。对连续变量采用两独立样本t检验,对分类变量采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征
本研究共入组45例有完整的临床、病理和治疗资料的ER 阳性以及HER2 阴性MBC 患者。45例患者的中位年龄为61 岁(范围:31~85岁),其中19例(42.2%)的年龄≥65 岁。中位体质指数(body mass index,BMI)为23.2(范围:16.8~29.7),根据中国成人超重和肥胖症预防控制指南[9],28例(62.2%)属于正常,12例(26.7%)属于超重,3例(6.7%)属于肥胖。35例(77.8%)的ECOG PS 评分为0 分,10例(22.2%)≥1 分。38例(84.4%)的ER 和孕激素受体(progesterone receptor,PR)均为阳性,7例(15.6%)仅ER阳性。34例(75.6%)的ER 阳性表达率≥50%,11例(24.4%)为10%~<50%。28例(62.2%)的Ki-67 增殖指数为15%~30%,8例(17.8%)<15%,4例(8.9%)>30%。4例(8.9%)为单纯性骨转移,31例(68.9%)有内脏转移,25例(55.6%)有肺转移,15例(33.3%)有肝转移。45例患者均有≥2 个部位的转移灶。
根据哌柏西利的起始剂量,分为125 mg(12例)、100 mg(29例)和75 mg 起始剂量组(4例)。3组患者除ECOG PS 评分(P=0.020)和ER阳性表达率(P=0.027)以外,其余临床特征的差异均无统计学意义(P>0.05,表1)。
2.2 治疗模式及治疗耐受性
45例患者中,21例(46.7%)接受一线内分泌治疗,9例(20.0%)接受二线内分泌治疗,15例(33.3%)接受三线及以上内分泌治疗;11例(24.4%)接受哌柏西利联合氟维司群治疗,34例(75.6%)接受哌柏西利联合芳香化酶抑制剂治疗(表1)。
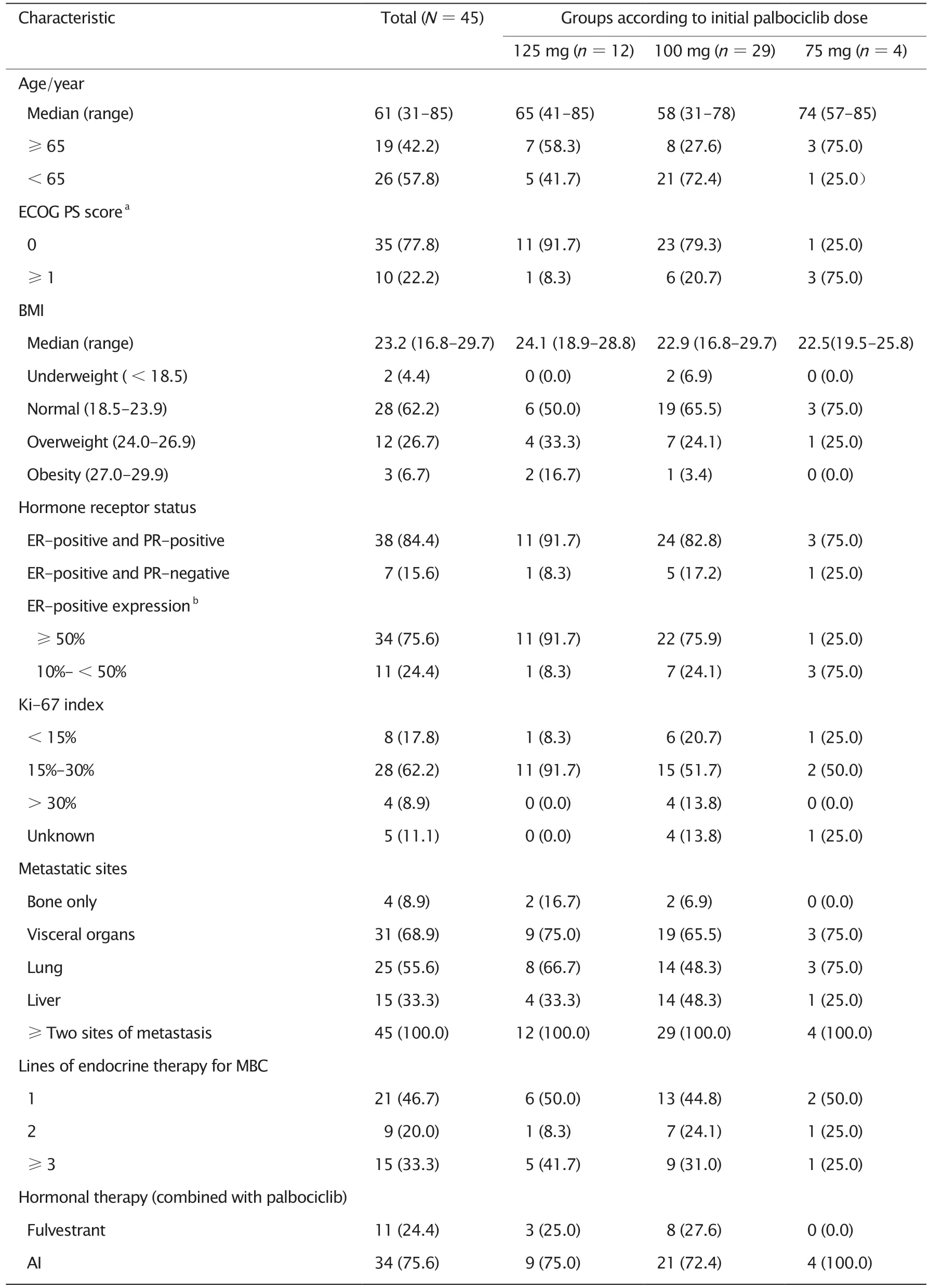
表1 45例ER 阳性以及HER2 阴性MBC 患者的临床和病理特征Table 1 Clinical and pathological characteristics of patients with ER-positive and HER2-negative MBC[n(%)]
45例患者的中位治疗周期数为5 个周期(范围:2~15 个周期)。哌柏西利起始剂量125 mg组的标准DI 为每周656.25 mg,实 际DI 为每周525.00±22.85 mg(范 围:393.75~656.25 mg),中位RDI 为83.39%(范围:63.33%~100.00%);100 mg组的标准DI为每周525.00 mg,实际DI 为每周466.03±11.93 mg(范围:393.25~525.00 mg),中位RDI为91.13%(范 围:75.00%~100.00%);75 mg组的标准DI 为每周393.75 mg,实际DI 为每周393.75±0.00 mg,中位RDI 为100.00%(表2)。
45例患者中有25例(55.6%)因治疗相关不良反应而进行哌柏西利减量,其中125 mg组10例(83.3%),100 mg组15例(51.7%),75 mg组0例(0.0%),见表2。在延迟哌柏西利用药方面,45例患者中有21例(46.7%)出现延迟用药(延迟用药的中位时间为7 d),其中125 mg组7例(58.3%),100 mg组14例(48.3%),75 mg组0例(0.0%),见表2。

表2 45例ER 阳性以及HER2 阴性MBC 患者接受哌柏西利联合内分泌治疗的完成情况Table 2 Exposure to palbociclib combined with endocrine therapy in 45 patients with ER-positive and HER2-negative MBC
2.3 疗效评价结果
截至2020 年1 月31 日,中位随访时间为6.4 个月,由于随访时间尚短,未达到中位PFS期,因此仅对疗效进行分析。7例(15.6%)达到PR,24例(53.3%)达到SD,CBR 为68.9%。哌柏西利起始剂量125 mg组中4例(33.3%)达到PR,4例(33.3%)达到SD,CBR 为66.7%;100 mg组中1例(3.4%)达到PR,18例(62.1%)达到SD,CBR 为65.5%;75 mg组中2例(50.0%)达到PR,2例(50.0%)达到SD,CBR为100.0%。125 mg组与100 mg组的CBR 差异无统计学意义(P=0.944),见表3。
在接受一线内分泌治疗的21例患者中,4例(19.0%)达到PR,13例(61.9%)达到SD,CBR 为81.0%(表3)。接受一线内分泌治疗的21例患者的CBR 高于全组45例患者,但差异无统计学意义(P=0.305)。

表3 45例ER 阳性以及HER2 阴性MBC 患者接受哌柏西利联合内分泌治疗的疗效Table 3 Response of 45 patients with ER-positive and HER2-negative MBC receiving palbociclib combined with endocrine therapy[n (%),N =45]
2.4 不良反应
主要的血液学不良反应为Ⅲ/Ⅳ度中性粒细胞减少(35例,77.8%)和Ⅲ/Ⅳ度白细胞减少(20例,44.4%),但粒细胞减少性发热的发生率较低(3例,6.7%)。3例粒细胞减少性发热患者的年龄均>65 岁,其中2例年龄>80 岁;2例伴多发骨转移,但未接受骨转移灶放疗。贫血及血小板减少发生率较低。哌柏西利起始剂量125 mg组与100 mg组的Ⅲ/Ⅳ度中性粒细胞减少发生率(83.3%vs82.8%,P=0.965)和Ⅲ/Ⅳ度白细胞减少发生率(58.3%vs41.4%,P=0.509)的差异均无统计学意义,见表4。
哌柏西利联合内分泌治疗相关非血液学不良反应较少,主要为疲乏、皮疹和口腔黏膜溃疡(表4)。5例(11.1%)患者出现疲乏,其中哌柏西利起始剂量125 mg组中的1例患者由于不能耐受疲乏而进行哌柏西利减量。3例(6.7%)患者出现皮疹。2例(4.4%)患者出现口腔黏膜溃疡。
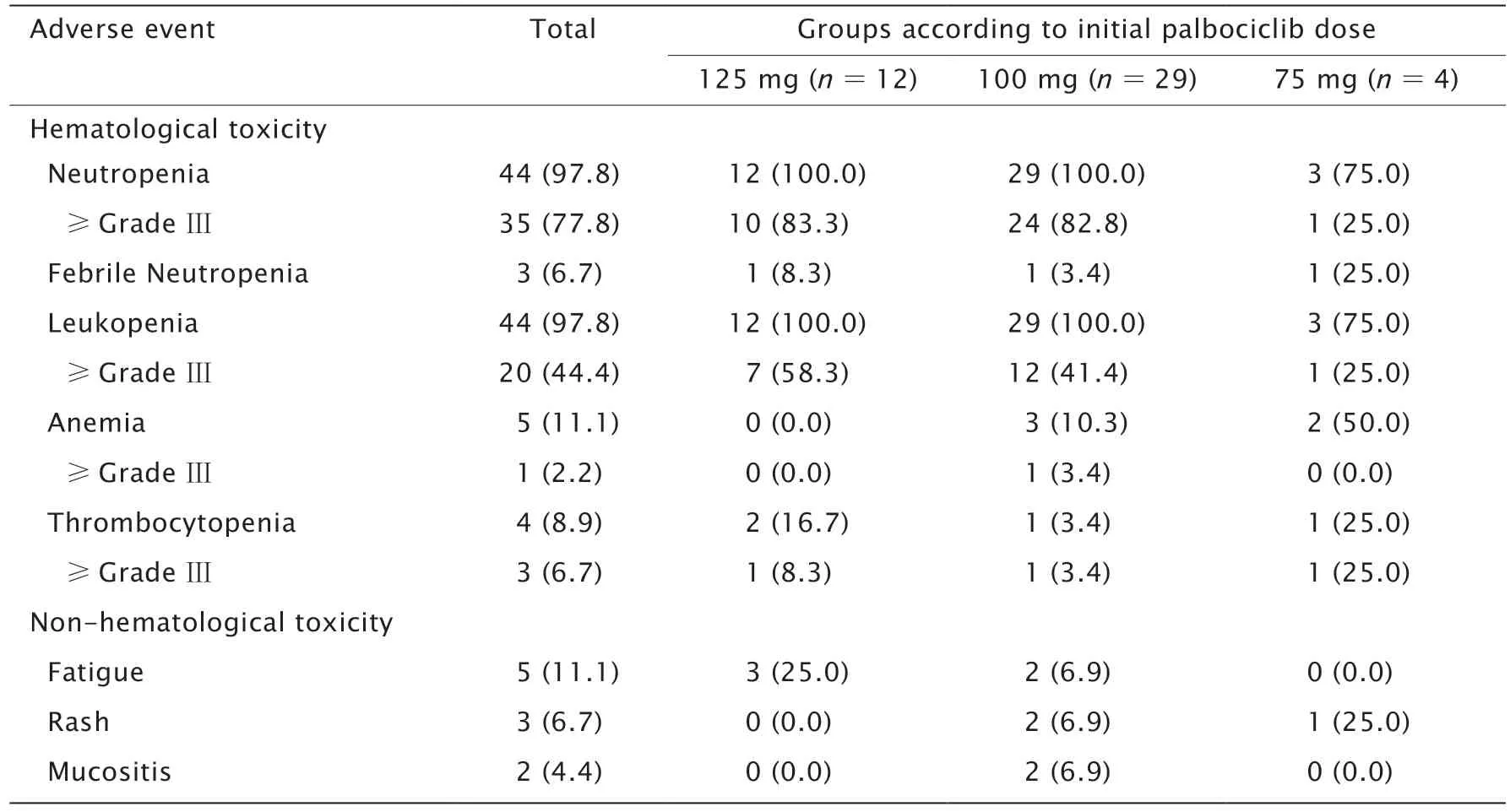
表4 45例ER 阳性以及HER2 阴性MBC 患者接受哌柏西利联合内分泌治疗的不良反应Table 4 Adverse events in 45 patients with ER-positive and HER2-negative MBC receiving palbociclib combined with endocrine therapy[n (%),N =45]
3 讨论
哌柏西利作为首个应用于中国MBC 患者的CDK4/6 抑制剂,在临床上的使用时间已超过1年。PALOMA 系列研究[6-8]和Young-PEARL 研究[10]确立了哌柏西利在ER 阳性以及HER2 阴性MBC 一线和二线治疗中的地位。在安全性方面,哌柏西利联合内分泌治疗的严重不良事件发生率较低,Ⅲ度及以上的常见不良反应为中性粒细胞减少。因哌柏西利相关不良反应导致停药的发生率很低。哌柏西利引起中性粒细胞减少的主要原因是细胞周期停滞,但是由于中性粒细胞的前体细胞依然保存增殖活性,因此在停药后的1周内,中性粒细胞前体细胞能够再次增殖而使中性粒细胞数得以恢复[11]。鉴于中性粒细胞减少的高发生率,临床上部分患者接受起始剂量哌柏西利减量治疗。减量后,哌柏西利联合内分泌治疗是否会导致疗效的下降?是否能像第二代ALK酪氨酸激酶抑制剂塞瑞替尼[12]那样,可以通过药物减量以及给药方式的改变来降低胃肠不良反应的发生率和严重程度,从而降低药物减量和延迟用药的发生率,提高中位剂量强度,达到减量不减效的结果?因此,有必要开展真实世界观察性临床研究以探讨中国MBC 患者接受哌柏西利联合内分泌治疗的治疗模式、耐受性和疗效。
与通常的新药真实世界使用情况[13]一致的是,在ER 阳性以及HER2 阴性的MBC 患者中,哌柏西利联合内分泌治疗的治疗模式和治疗耐受性存在明显的异质性。本研究纳入的MBC 患者大多存在不良预后的相关因素(如内脏转移、二线及二线以上内分泌治疗)。12例(26.7%)患者按照中国国家药品监督管理局推荐的125 mg 哌柏西利起始剂量开始哌柏西利联合内分泌治疗。随访期间,大部分患者能够耐受联合治疗。全组45例患者中,7例(15.6%)达到PR,24例(53.3%)达到SD,CBR 为68.9%;哌柏西利起始剂量125 mg组与100 mg组的CBR 差异无统计学意义(P=0.944)。并且,以哌柏西利联合内分泌治疗作为一线内分泌治疗的21例患者的CBR 高于全组45例患者,以哌柏西利联合内分泌治疗作为晚期乳腺癌初始一线内分泌治疗的患者的CBR 明显高于全组患者(81.0%vs68.9%)。PALOMA-2[14]和PALOMA-3[15-16]研究显示,由于药物不良反应导致的哌柏西利减量并未影响总人群的PFS。随后,PALOMA-2 研究进一步针对入组的日本人群进行亚组分析,结果显示46例患者中有62.5%的患者由于药物不良反应而进行哌柏西利减量,将哌柏西利由125 mg 减量至100 mg甚至75 mg 并未对PFS 产生影响[17]。
与PALOMA 系列研究[6-8]的结果相比,本研究中Ⅲ/Ⅳ度中性粒细胞减少(77.8%)似乎更高。然而,PALOMA-2 研究随后针对95例亚洲患者进行的亚组分析的结果显示,亚洲人群的中性粒细胞减少发生率确实明显高于非亚洲人群(95.4%vs76.8%)[18]。进一步针对日本入组患者开展亚组分析的结果显示,46例患者的中性粒细胞减少发生率为93.8%,其中Ⅲ/Ⅳ度中性粒细胞减少发生率高达87.5%[17]。韩国的研究[19]也同样得到了相似的Ⅲ/Ⅳ度中性粒细胞减少发生率。由此可见,亚洲人群使用哌柏西利联合内分泌治疗的中性粒细胞减少发生率确实高于西方人群。然而,哌柏西利起始剂量125 mg组与100 mg组的Ⅲ/Ⅳ度中性粒细胞减少发生率的差异无统计学意义(83.3%vs82.8%,P=0.965)。为何减少药物的起始剂量却没有减少不良反应发生率以及降低其严重程度?这是因为在观察药物的安全性时,应同时考虑药物的起始剂量和维持剂量。在哌柏西利起始剂量125 mg组的12例患者中,10例进行了药物减量,甚至有2例进行了2次药物减量。全组45例患者中,最终仅1例维 持125 mg/d,23例为100 mg/d,21例为75 mg/d。
在治疗耐受性方面,本研究结果显示哌柏西利125 mg 起始剂量组的中位RDI 为83.39%,100 mg组的中位RDI 为91.13%,而75 mg组的中位RDI 为100.00%。在由于治疗相关不良反应而导致药物减量及延迟用药方面,125 mg组中83.3%的患者进行了哌柏西利药物减量,58.3%的患者出现延迟用药,而100 mg组中仅有51.7%的患者进行了哌柏西利药物减量,48.3%的患者出现延迟用药。由此可见,100 mg组的哌柏西利联合内分泌治疗的完成情况及治疗耐受性均更好。
综上所述,哌柏西利联合内分泌治疗的疗效肯定,并且一线治疗的效果更好。联合治疗的主要不良反应为Ⅲ/ Ⅳ度中性粒细胞减少。100 mg 哌柏西利起始剂量组的延迟用药发生率低于125 mg组,并且中位DI 提高,疗效无明显降低。本研究为中国MBC 患者提供了哌柏西利联合内分泌治疗的治疗模式和治疗耐受性的真实世界临床数据。对于一般状态良好的中青年MBC 患者,建议选择125 mg 哌柏西利起始剂量治疗;而对于老年和(或)ECOG PS 评分较高的MBC 患者,建议选择100 mg 哌柏西利起始剂量治疗,能够在不影响疗效的前提下,减少药物相关不良反应,提高治疗的依从性和耐受性,改善生活质量。随着哌柏西利批准上市后用药人数的逐渐增多,今后有待开展更大样本量的真实世界研究以及进行长期的随访,以进一步证实哌柏西利联合内分泌治疗的疗效。