使用一次性硬膜外麻醉导管进行无创小鼠气管插管的方法建立
赵聪慧王 妍周 禹袁晓红*
(1.首都医科大学附属北京口腔医院病理科,北京 100050;2.山西医科大学第一医院,太原 030001;3.山西医科大学肝病与器官移植研究所,太原 030001;4.中国医学科学院药物研究所,北京 100050)
肺疾病为常见的呼吸系统疾病,极大损害了人类健康,对社会造成劳动力和医疗资源损失。通过构建动物肺部疾病模型,可以直观研究疾病发病机制,动态演变以及评估药物治疗效果。由于小鼠肺部疾病模型造模指向性强,需要直接将造模药物均匀输送到肺组织中。因此包括哮喘模型[1],肺纤维化模型[2],急性肺组织损伤模型[3],病毒感染模型[4]等肺部疾病模型均使用气管插管法造模。小鼠体型较小,呼吸道狭窄,不易发现气管入口。雾化吸入是常用的方法之一,操作简便,可批量处理。但是,此方法存在药品消耗大,每只动物吸入剂量不可控等缺点。滴鼻法操作简便,但是药物部分进入食道,造成不同动物之间实际给药剂量差异。并且,研究表明经口鼻吸入法造模效果不及气管插管法[5]。目前为止,多种小鼠气管插管技术已被报道,可以归类为“有创法”、“无创直接法”和“无创辅助法”,这些方法各有优势,但仍存在不足。有创小鼠气管插管技术虽然经过优化将动物损伤降到最低,但是仍不利于小鼠长期生存和多次给药[6-8];无创辅助法通过使用辅助工具,例如使用光源[9-12]或者光源和纤维引导丝组合[13],从而直接可视化小鼠气管入口并将插管引入气管。但是,由于小鼠气管狭窄,入口仍然不便直接观察,且对于实验器材获取和实验人员经验技术要求较高;无创直接法也称为“盲插法”,此方法不使用任何辅助,直接经小鼠口腔插入气管,操作最为简便,但手法难以掌握,并且成功插入与否难以把控。
综合目前已经报道的小鼠气管插管技术,同时参考大鼠气管插管技术,结合实际在构建小鼠肺部疾病模型经验,我们建立了一套操作简单,成本低廉,重复性好,对操作要求较低的小鼠气管插管方法。并总结出本方法训练方法。本方法立足于无创“盲插”法,组装包括一次性硬膜外麻醉导管,1 mL注射器,10μL移液器枪头在内的常见实验耗材作为气管插管工具,并总结出插入气管的判断依据。使用本方法给药,过程舒缓程度可控,一名操作人员即可快速完成实验。本方法将有助于小鼠肺部疾病模型的研究。
1 材料和方法
1.1 实验动物
SPF级C57BL/6小鼠,雌性,20只,6周龄,体重18~22 g。购于北京华阜康生物科技有限公司[SCXK(京)2019-0023],于中国医学科学院药物研究所动物房中饲养[SYXK(京)2019-0023],光照黑暗交替照明(12 h/12 h),自由饮水,进食,温度22℃左右,相对湿度50%左右。本实验已通过中国医学科学院药物研究所动物伦理委员会审批批准(00005199),实验过程中遵循3R原则并对动物给予人道主义关怀。
1.2 主要试剂与仪器
1%戊巴比妥钠;台盼蓝染液;1 mL注射器(BD);胰岛素注射针(BD);一次性硬膜外麻醉导管;10μL移液器枪头;缝合线;移液器架;眼科剪;眼科镊。
1.3 实验方法
1.3.1 小鼠气管插管简易装置制作
小鼠气管插管简易装置组成如图1A所示,一次性硬膜外麻醉导管1支,10μL移液器枪头若干,1 mL注射器一支,胰岛素注射针1支。首先将硬膜外麻醉导管软管对折,从中间剪开,插管时使用其中一半即可,将其中一端侧面开口剪去(硬膜外麻醉导管的一端为侧面开口),改为顶端开口。将处理好的软管与进药装置组合,并旋紧螺丝扣。使用胰岛素注射针吸取给定剂量药物(此处为台盼蓝染液或PBS),将其通过进药装置注入软管内。需要说明的是,使用的胰岛素注射针与硬膜外麻醉导管的进药口必须紧密对接,并且该注射器没有死腔,有利于精确控制给药剂量。建议每次只吸取1只小鼠的剂量。将药物注入导管完毕后,使用1 mL注射器将针头弃去不用,将注射器调整至最大量程处,与进药口紧密对接,此处注射器当作“气筒”使用。小心调节注射器,观察软管中液平面,将其控制在距离软管出口处3~5 cm左右位置,以便于观察。将软管出口处套入10μL移液器枪头内,以液体不外露为准,如图1B所示。气管插管装置和药物准备完成。

图1 小鼠气管插管简易装置Note.A,Tools for tracheal intubation.B,Assembled tracheal intubation tools for mice.Figure 1 Simple tracheal intubation tools for mice
1.3.2 实验动物准备
1%戊巴比妥钠深度麻醉小鼠,麻醉过浅在插管时会产生呕吐反射,不利于找到气管位置。小鼠以使用镊子夹住四肢无反应,双眼湿润,呼吸规律且较为深长为佳。使用缝合线,将小鼠悬挂于移液器架上。
1.3.3 小鼠气管插管过程
使用缝合线将小鼠悬空挂于移液器架上,高度以操作人员舒适为准。使用眼科镊小心将小鼠舌头拔出。如图2所示,左手大拇指放在小鼠颈前部,指肚紧贴小鼠颈部(重要),其余手指置于小鼠后颈部固定小鼠,以免摇晃。右手手持套入软管的移液器枪头,沿小鼠下颚,抵住小鼠舌头缓缓插入小鼠口中,在抵达小鼠会厌部时,会感受到阻力,这是小鼠会厌软骨所造成,此时不可用蛮力向下,以免伤及小鼠。将枪头稍稍回撤,而后将枪头下端向小鼠颈部腹侧反方向向下一小段距离(此时操作员面对小鼠,小鼠颈部腹侧正对操作员脸部),而后转向颈部腹侧表皮方向轻轻挑一下,同时将枪头向下,目的为挑过会厌软骨将枪头送入小鼠气管。当感觉枪头越过阻碍后,将枪头抵住左手拇指肚,轻柔地上下摩擦,注意动作轻柔。此时如果插入气管,应感觉到移液器枪头与气管软骨摩擦“一楞一楞”的感觉,这个感觉就是成功插入小鼠气道的判断依据,同时也是本技术的重点,如果插入食道则左手拇指肚感受到平滑感。此时观察软管中的液面,如果插入气管中,液面应该波动并向小鼠方向移动。当成功插入气管后,左手把住枪头,右手持注射器,缓慢推进,直至软管内液体全部进入后继续打入0.5 mL刻度的气体,迅速拔掉枪头。

图2 小鼠气管插管手法Figure 2 Schematic diagrams of tracheal intubation by epidural anesthesia catheter
小鼠悬挂30 s后即可取下。若插管成功,小鼠呼吸应该从麻醉的深长呼吸状态变为短促呼吸状态,此状态会维持数分钟,直至渐渐变为规律的深长呼吸,此时呼吸声音明显增加。
1.3.4 注意事项
(1)小鼠麻醉程度要控制得当,麻醉浅小鼠会出现挣扎情况,麻醉过深则容易窒息死亡;(2)给药体积控制在每只小鼠30~50μL,少于30μL不利于药物均匀分布,多于50μL则容易造成小鼠窒息死亡;(3)插管的深度不宜过深,应控制在气管中上部分,不宜过度接近气管分支部分,以免造成药物偏向一侧肺组织;(4)气管插管过程中,由于小鼠个体差异和状态不同,不同小鼠插管的难易程度略有不同,建议连续2~3次插管不成功(遇到阻力,回撤再向下为一次)将小鼠取下休息一段时间,并且过程一定要轻柔,以免损伤小鼠或者造成窒息;(5)插管成功的依据是左手拇指有“一楞一楞”的感觉,因此应保持左手拇指的位置正确和敏感性,少部分情况即使成功插入气管,软管中液面的波动亦不明显;(6)此方法虽然简单,但是需要操作人员有一定的练习,可采用先将小鼠解剖,完全暴露小鼠颈部组织结构,体会枪头插入的位置和程度;(7)我们使用的是10μL移液器枪头,这个部分可以换做任何可以与导管头接合的器具,以使用顺手为目的,原则是足够细,并且不会伤及小鼠;(8)推入液体时速度应保持中速和稳定,确定将液体全部推入后,应继续进气0.5 mL左右,以保证液体进入肺组织深部。有文章提出,补气有助于滴注物扩散,防止动物窒息,但由于小鼠肺总容量小,补气量为0.6~0.8 mL[14]。
1.4 统计学方法
实验数据采用GraphPad Prism 8.0进行统计分析,计数数据采用Two-way ANOVA检验,P<0.05、P<0.01以及P<0.001为差异有统计学意义。
2 结果
如图3所示,通过气管插管给予小鼠台盼蓝染液,可见小鼠肺组织均匀蓝染,同时胃中没有蓝色,证明染液均匀分布于肺组织中。通过气管插管给予PBS组小鼠,在麻醉剂作用失效后,存活情况良好,无小鼠死亡。证明上述操作安全可靠。使用上文所述小鼠气管插管方法,我们已经完成多种、多次小鼠肺部疾病模型造模,包括IL-33诱导的小鼠哮喘模型,博来霉素诱导的小鼠肺纤维化模型,以及LPS引发的急性肺损伤模型。对于气管插管造模的成功率,我们以博来霉素诱导的肺纤维化为例,如图4所示。相比于对照组,模型组小鼠体重有显著下降,并且数据变异度小,证明模型发病率高,造模方法稳定。如图5A所示,使用此方法构建博来霉素诱导的肺纤维化模型28 d后,安乐死小鼠取肺组织,进行病理学分析,HE染色显示对照组小鼠肺组织肺泡结构清晰,肺泡间无杂质,无炎性细胞浸润,模型组小鼠肺泡组织结构消失,原本肺泡组织被大量细胞外基质填充,可见炎性细胞浸润。Masson染色显示相比对照组,模型组小鼠肺组织着色显著。同时如图5B所示,免疫组化染色表明,肺纤维化标志αSMA、Collagen I和Vimentin在模型组显著表达增高。综上,病理分析表明小鼠肺纤维化模型成功。
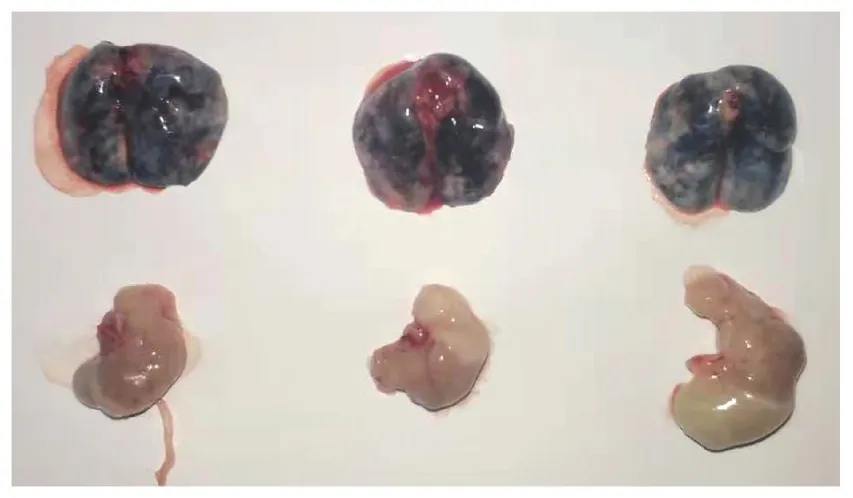
图3 气管插管给予小鼠台盼蓝染液后,肺组织和胃染色情况Figure 3 Trypan blue staining of mouse lung and stomach after intratracheal intubation
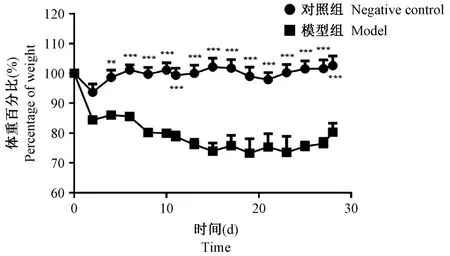
图4 经气管插管使用博来霉素小鼠肺纤维化造模后小鼠体重变化统计(n=7)Note.Compared with the control group,**P<0.01,***P<0.001.Figure 4 Body weights(%)of animals after bleomycin intratracheal intubating
小鼠气管插管过程中,由于个别小鼠较为敏感或者手法问题,会出现小鼠因窒息死亡现象。具体表现为,小鼠眼球突出眼眶,出现身体蜷曲张口深大呼吸等呼吸困难表征,此为小鼠窒息前兆,如无此现象小鼠不会窒息死亡。通过手法逐渐熟练和给与的液体量减少,小鼠死亡现象显著下降。
3 讨论
小鼠肺部疾病模型需要将造模药物直接并且均匀输送到肺组织中,口服,静脉/腹腔/皮下注射等造模方式不能完全满足需求。张晓晔等[15]比较经尾静脉和经气管进行小鼠肺纤维化造模,结果表明动物肺纤维化程度尾静脉造模组低于气管造模组(但未见统计学差异),且小鼠肺组织病变部位二者存在显著差异。由于小鼠体积较小,口腔空间狭窄,导致难以准确找到气管开口位置。因此掌握成熟、稳定的气管插管技术就显得尤为重要。
由于大鼠也常被用于构建肺部疾病模型,因此大鼠的气管插管方法也可参考[16-17]。已报道的各类方法可分为“有创性插管”,“使用辅助工具无创性插管”和“无创性直接插管”(也被称作“盲插”)。有创性插管采用暴露部分气管,将药物注射入动物气管内。此方法经过多次改良,力求尽可能减少对动物损伤,但是依旧易导致动物死亡,并且不利于多次干预。使用辅助工具无创性插管的改进在于使用光源,或光源与体试镜,导引丝结合,在无创条件下将气管入口可视化,提高插管成功率。有报道分别使用小鼠和大鼠比较了经口直视插管组和经颈透照直视插管的优劣,认为经颈透照直视插管可靠性更佳[18-19]。使用辅助工具无创性插管准确性高,对动物伤害小,但是仍有不足。一方面对于操作人员技术要求较高或者需要两人一起操作,另一方面需要购买或自制相关设备。相比之下“盲插”具有成本低廉,上手较快等优点。但是,此方法具有无法准确判定是否进入气管,插管手法难以掌握这两大缺点。王凯等[20]在比较不同方法建立大鼠间质性肺炎模型中摸索出一套切实可用的大鼠气管“盲插”手法。但是提及的“轻微阻力”和“摩擦感”两个插入气管的特征,并不能准确判定工具进入气管。而且小鼠相比于大鼠,由于体积更小,气管更加狭窄,不利于插管。因此有必要改进“盲插”法以更好的适应小鼠实验。
本文立足于“盲插”法,使用硬膜外麻醉导管,移液器枪头,注射器等常用实验耗材,并通过手指的感觉确定进入气管,给药过程可控制速度,且药物可均匀分布到肺组织中。器材选用方面,已报道的方法多使用滞留针,穿刺针和移液器枪头等。相比于铁质针头,移液器枪头不易损伤组织。通过比较不同气管插管方法造小鼠肺纤维化模型的情况,提出插管深度对药物分散和造模效果直接相关[21]。10μL移液器枪头可满足进入气管一定深度。连接硬膜外麻醉导管后,可将推注使用的移液器放置于合适位置,有助于控制推注过程。本方法操作手法需要一定的练习,可先在解剖条件下观察插管时枪头在小鼠咽喉部的位置,记住在何处有阻力,如何避开会厌软骨隔挡。在熟练掌握手法后,每只小鼠插管给药时间可控制在1~2 min内,并且在50μL以内的给药体积小鼠被直接呛死的比例小于10%。使用本方法,我们已经建立了IL-33诱导的小鼠哮喘模型,LPS诱导的小鼠急性肺损伤模型,博来霉素诱导的小鼠肺纤维化模型。模型成功率接近100%,并且出模率稳定。通过更换所使用的工具,以相同的判定方式和手法,本方法也可适用于大鼠气管插管给药。
综上,我们在无创无可视辅助工具的条件下,经过改良和创新,建立了一套成本低廉,原料易得,上手容易,并且高效,稳定的小鼠气管插管方法,此方法将有助于更多小鼠肺组织疾病模型研究。

