R32与R1234yf可燃性对比及燃烧抑制研究
石玉琦 杨 昭 吕子建 武晓昆
(1 天津大学 中低温热能高效利用教育部重点实验室 天津 300350;2 格力空调设备及系统运行节能国家重点实验室 珠海 519070)
制冷剂的演变已经历三代更替,并开始进入第四代制冷剂的研究和推广使用阶段[1]。经过上一代制冷剂发展,已基本解决卤代烃类制冷剂臭氧层破坏问题,并开始进行高温室效应制冷剂的替代研究。当前制冷剂替代方面主要是政策和经济博弈,并通过政府间合作,签署了蒙特利尔公约的基加利修正案[2],在未来30年逐步消减HFC类制冷剂。
为了追求更低的温室效应潜能(GWP)特性,新型制冷剂的提出往往趋向于采用烷烃类自然工质或低F/H原子比的烷烃取代合成制冷剂。进一步通过引入碳-碳双键可降低其释放到大气中后的寿命,从而降低GWP。低F/H的低碳原子取代烷烃或烯烃多具有可燃性,单一物质在标准的测量环境下,可燃性强度与GWP大小通常具有负相关性。为了减小低GWP纯工质可燃性,可以添加一定量的无溴、低氟阻燃剂或灭火剂,使其满足可燃性制冷剂安全使用相关规范。
阻燃研究需要以燃烧学、热力学、传热学、流体力学为基础。在阻燃剂的开发方面,通常以材料自身的改性作为研究基础和目标。热塑性高聚物在工业和生产生活中大量使用,添加阻燃剂能够抑制其在加工和使用过程中的可燃性,提高安全性能。但阻燃剂的添加和不当使用会使原始材料性能受到剧烈影响,或加工使用过程带来污染物释放。传统的阻燃剂是针对固体材料特别是塑料等高聚物提出的,包括有机磷/氮膨胀吸热型阻燃剂[3]、卤素和多元醇等液化阻断型阻燃剂[4]、硼化物[5]和钼化物惰性气体阻断型阻燃剂、卤代烃自由基捕捉性阻燃剂。在固体阻燃过程中通常采用多种手段协同进行阻燃,而由于制冷剂主要以液体和气体在系统中存在,阻燃手段大幅受限,一般只能采用低碳卤代烃自由基捕捉阻燃。
现有制冷系统多采用的可燃性制冷剂包含NH3、C3H8、R600a、R32、R1234yf等,在制冷系统中以气态和液态形式存在,针对固体材料提出的无机类阻燃方法难以在制冷系统中应用。氨作为工业用制冷剂,具有使用场景的特殊性,而其余有机类制冷剂使用广泛,阻燃需求旺盛,通过添加不同类型的低碳卤代烃,在满足环保要求的条件下可大大降低其使用风险、拓展使用范围。本文从燃烧动力学机理进行对比研究,采用已经加以验证的燃烧反应机理,对比饱和氟代烷烃R32与不饱和氟代烯烃R1234yf两种制冷剂的可燃性,通过对低点火能量条件下临界燃烧时点火延迟特性、反应物的消耗、自由基的生成与湮灭情况,提出燃烧反应路径中相似组分混合时一种新的可燃制冷剂之间互混的阻燃方法。
1 制冷剂燃烧动力学机理
为了尝试降低制冷剂可燃性,需要对制冷剂燃烧基本特性进行燃烧动力学研究。在一定温度和压力条件下,包含主要由碳、氢原子组成的制冷剂多具有可燃性,现有燃料也多为碳氢化合物。在制冷剂可燃性研究方面,学者们主要针对烷烃、烯烃及其替代物展开研究工作,其中饱和的氟代烷烃和不饱和的氟代烯烃类制冷剂进行燃烧的机理模型是在烷烃和烯烃燃烧反应的基础上建立起来的,主要包括以下模型:
1)GRI-Mech 3.0模型[6]:主要针对包含氟代烷烃C3以下可燃物高温条件下的氧化反应;
2)NIST开发的C1-C2类HFC模型[7]:主要针对含有HFC灭火剂的低碳原子数氢氟烃可燃物的氧化反应;
3)C3类HFC模型[8]:主要针对七氟丙烷开发的氟代烷烃,用于火焰惰化机理氧化反应模型,也包含含溴的一类物质,特别是2-BTP(2-溴,3,3,3-氟丙烷)的反应机理开发;
4)氟代烯烃热解和氧化模型[9]:主要针对近几年逐步成为低GWP的几种HFO制冷剂开发的反应模型,包含R1234yf、R1234ze(E)为代表的四氟丙烯和R1243zf为代表的三氟丙烯。
从上述燃烧反应机理模型可以看出,当前模型主要针对含3个碳原子以下的反应机理进行开发。含有3个碳原子的烷烃、烯烃或氟代烃燃烧机理动力学反应方程有1 000种以上,以及上百种反应物。对模型的简化需要针对不同的优化目标,结合实际精度需求进行,如火焰传播速度、火焰类型和火焰结构。目前仍没有普遍适用各种实际条件的,统一的制冷剂可燃性大小的度量标准,气体可燃物浓度上下限宽度、点火条件、测试条件等均对实际制冷剂燃烧情况有较大的影响,但还需着重研究一些事故中流动、传热和传质结合紧密的关键参数,对其进行理论分析和实验研究。表1所示为按照ASHRAE34标准给定的几种分类为A2L的弱可燃制冷剂的基础物性,这些物性是研究燃烧反应动力的基础。

表1 几种可燃性制冷剂热物性数据Tab.1 Thermal properties of some flammable refrigerants
2 制冷剂燃烧建模
含氟制冷剂与烃类物质燃烧反应不同之处在于,含氟制冷剂热分解后首先产生的HF与OH·结合生成水,对该活跃的自由基起到消耗作用,是切断或阻碍链式反应产生大量热的重要步骤之一。含氟比例较高的制冷剂如果在湿度较高条件下点燃,则抑制了该自由基的消耗反应,促进了可能发生的燃烧反应。为研究含氟制冷剂燃烧情况,本研究使用Chemkin Pro 17.0,利用零维的Closed Homogeneous模型对低点火条件下反应物消耗、自由基生成和湮灭、温度、压力变化等模拟;利用一维的PSR(perfectly-stirred reactor)反应器模型对燃烧速度等模拟,参考R.J.Kee等[13-14]模型。采用0.1 L反应器,不考虑热量损失,初始充注气体与反应气体具有相同的组成,气体温度与壁面温度相同。R32和R1234yf的基础反应基于近期文献中获得的反应机理模型[15]。
2.1 饱和烷烃取代物R32
现有模型中使用的基本反应的速率参数具有Arrhenius形式:
k=ATne-E/(RT)
(1)
式中:A为指前因子或阿伦尼乌斯常数;T为绝对温度;n为温度指数;E为反应活化能;R为气体常数。基于R32类烷烃取代物的几种反应如表2所示,进行计算反应路径分析。

表2 R32的几种主要反应速度系数[15]Tab.2 Arrhenius parameters for the main reactions of R32[15]
自由基H、O、OH和F从R32分子中夺取H的速率列于表2。扩展的Arrhenius速率表达式,以在较宽的温度范围内提供速率常数。通过类比CH3+O2→ CH2O + OH和CF2+ O2→ CF2O + O 的速率常数估算CHF2+ O2→ CF2O + OH和CHF + O2→ CHFO + O 的反应速度常数。
CHF2+ CHF2→ CHF=CF2+ H 的速率表达式来自于D.R.Burgess JR.等[16]的较早的从头算过渡态和RRKM计算,利用从头算过渡态和RRKM计算得出的CHF + H2O → CH2O + HF 的速率表达。该反应是CHF的主要分解途径,也是HO2形成的主要途径(CH2O + OH → CHO + H2O,然后是CHO + O2→ CO + HO2)。该反应对热效应低,在燃烧前期中很大程度上是建立稳态浓度的通道。对于反应R(CHF2、CF2、CHF)+ X(H,O,OH,F),反应速率通常非常快,并且除了提供完全燃烧的途径外,对燃烧化学的贡献很小。类似地,涉及CHFO、CF2O和CFO的反应对火焰传播的变化影响可忽略不计。
2.2 不饱和烯烃类取代物R1234yf
表3所示为R1234yf分解反应的Arrhenius速率参数,学者们已在较多研究中进行了相关动力学模型的开发。该模型构建的主要假设是,通过向双键中添加自由基形成的中间物种快速分解为假定的一组饱和产物。通过相似反应和经验结构-反应关系的类比,估算新反应的相关速率常数。对于自由基消耗CF3CHCH2(R1243zf),假定主要途径是自由基加成并进一步消除CF3自由基(CF3CHCH2+ H → CF3+ C2H4,CF3CHCH2+ OH → CF3+ CH3CHO)。该反应与丙烯燃烧模型类似,同时假设与CF3CCH2·自由基形成相比,CF3CHCH·自由基的形成相对较少。

表3 R1234yf的几种主要反应速度系数[15,17]Tab.3 Arrhenius parameters for the main reactions of R1234yf[15,17]
计算起始分解反应和氢、氧、氢氧自由基的加成反应和用于燃烧平衡计算和层流火焰。V.I.Babushok等[17]对四氟丙烯与不同氧气摩尔分数XO2,OX的混合物条件火焰速度进行计算。相对应的初始气体成分,温度(298 K)和压力(101 kPa),求解质量,组分和能量守恒。采用如下假设:包括等压、绝热、稳定、平面、一维、层流,并忽略了辐射和Dufour效应,但包括热扩散。分子扩散用多组分传输方程建模。对应于自由传播火焰的边界条件是指定的入口组分,质量通量和温度(298 K)。
通过对R1234yf基于充分与空气预混绝热燃烧器模拟,采用低点火温度(1 000 K)进行点火,此时相对于实际点火源为常规打火机等火焰的点火能量,压力为101.325 kPa。模拟时间为20 s,绝热燃烧器体积为0.1 L,如图1所示。得到R1234yf在反应器中温度快速上升时间延迟到达至11.4 s,在11.867 s时达到最高温度为2 479 K。前面11.4 s温升缓慢,是R1234yf缓慢分解过程,快速放热反应较少发生。图2所示为R1234yf超压情况。由图2可知,压力在11.89 s时达到高压力位,之后趋于稳定,此后可达307.15 kPa,已经达到判断燃爆的标准。考虑到实际过程中无法完全实现绝热,R1234yf实际测量的超压较容易达到燃烧的超压标准(1.3倍初始压力),但极有可能低于爆炸压力判断标准。
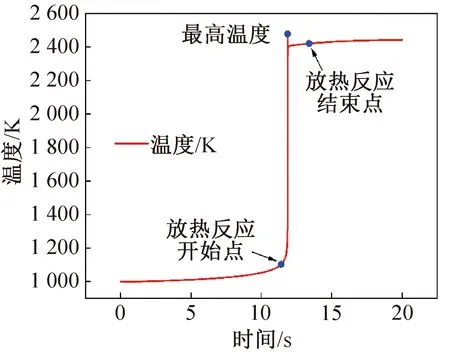
图1 R1234yf点火延迟Fig.1 Ignition delay of R1234yf
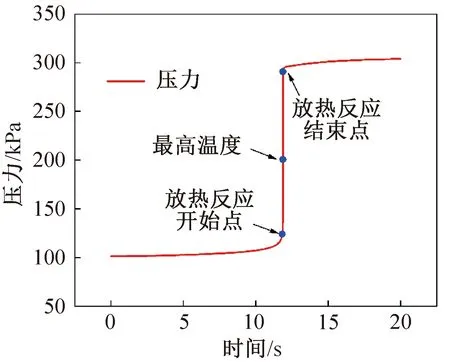
图2 R1234yf超压情况Fig.2 Overpressure of R1234yf
图3和图4分别为采用零维的Closed Homogeneous模型对低点火条件下反应物消耗、自由基生成和湮灭变化等模拟结果,为显示更加清晰,图3和图4的纵坐标采用对数坐标形式。图3所示为R1234yf消耗情况,0~11.76 s的反应过程分子摩尔分数降低十分缓慢,分解速度接近常数,而后摩尔分数开始迅速下降,R1234yf迅速消耗。图4所示为H和OH自由基组分变化。通过对自由基OH组分的分析可知,主要的放热反应发生在约11.5 s及以后,OH组分迅速上升,达到峰值后迅速被消耗,此过程为主要的热效应过程。主体部分在11.706~11.935 s之间,约230 ms。
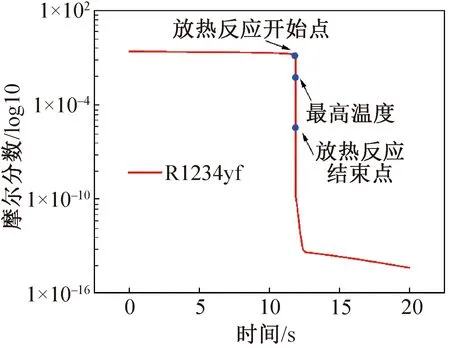
图3 R1234yf分子消耗情况Fig.3 Mole fraction of R1234yf with time

图4 H和OH自由基组分变化Fig.4 Mole fraction of H and OH with time
通过上述计算结果和分析可知,主要的放热反应发生之前,R1234yf有较长的时间处于热分解过程。通过在相近分解时间阶段产生相近分解产物有望有效抑制热分解,进一步通过借鉴内燃机中常见的调节点火延迟的添加甲醇组分固化OH组分,可有效抑制放热反应的发生。
3 反应路径分析与阻燃探讨
通常认为实验获得的燃烧速度更具有准确性。但实验在控制条件方面往往难以达到理论情况。如球形定容装置中,当量比为0.9~1.4时,R32/空气火焰燃烧速度的测量结果,采用光学薄辐射模型计算获得的实验燃烧速度比绝热模型获得的燃烧速度大17%[18],这通常被解释为实验温度和压力条件外推到常温和常压造成的,此外,热辐射、火焰拉伸等也会造成燃烧速度与绝热模型的差异,改进实验条件十分困难,但改进理论模型相对容易,并可在任意操作参数条件下获得较一致的结果,与反应容器等外部条件无关。
通过对R32/空气、R1234yf/空气的混合物分别进行的绝热火焰温度和火焰传播速度模拟反应可行性的判断,如图5和图6所示。由反应趋势可知,上述简化的反应能够满足等压、绝热、稳定、平面、一维、层流条件下混合物绝热火焰温度和火焰传播速度的变化趋势,具体一维稳态条件火焰传播速度与实验过程获得的火焰传播速度进行系数折算过程未在本工作中体现,因为反应路径与该折算无关。
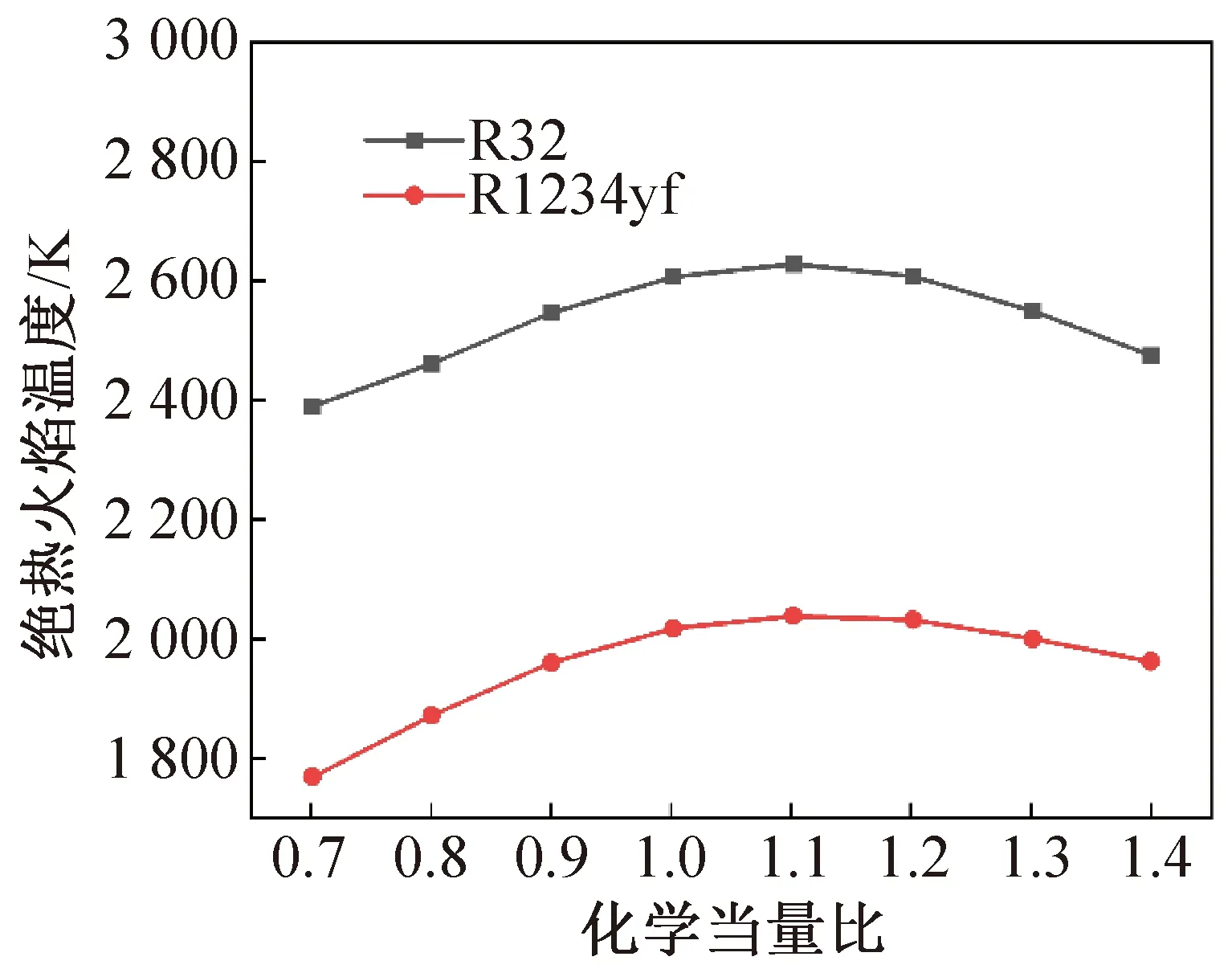
图5 等压绝热火焰温度Fig.5 Adiabatic flame temperature at constant pressure

图6 火焰传播速度Fig.6 Laminar flame speed
天津大学杨昭教授团队已基于量子化学计算的能量势垒理论分析和实验方法进行了R1234ze(E)反应路径的详细研究,其反应与R1234yf具有很高的可比拟性。与烷烃裂解和与氧气反应机理不同,HFO类物质的反应机理更加复杂,同时存在氟代烯烃裂解、双键的加成或夺取反应、与自由基的加成或夺取反应,较R32热解过程增加了双键的作用,机理可能的路径较多,其中一种较高可能性的反应路径分析如图7所示。与团队前期研究R1234ze(E)[19]相似,反应过程的中间体较多,但反应速度快,分解终了基团以CF3为主。反应路径过程如果能采用传统高效率火焰抑制元素如Cl和Br,可以快速清扫O、H和HO自由基,但这些元素往往受到极其严格的环保法律法规限制。因此可以认为,CF3基团分解产物的低碳、高F/H比烷烃类取代物,在热分解的过程中增加了CF3反应浓度,同时该反应平衡常数受温度影响大,低温下效果更加显著,同样可以降低氟代烯烃类制冷剂可燃性。如在R1234yf和R1234ze(E)等制冷工质中增加少量的R32(中等GWP)或R23(高GWP)也有降低可燃性的效果。该阻燃效果在已有研究中有所体现,R32可以减慢R1234yf在2 600~2 800 K时的热解速度[20]。

图7 R1234yf反应消耗路径Fig.7 Reaction pathways for R1234yf
对比分析R32和R1234yf两类可燃性制冷剂,低碳、低F/H比的一类制冷剂可燃性通常较强,比燃烧热值也相对较高,均表现在绝热燃烧温度和火焰传播速度方面。两者在高效率阻燃方面均需采用传统但不环保的含氯或含溴灭火剂协助,而在一定程度上降低可燃性方面,则可采用提高F/H比率的方法。此外,通过反应路径的研究,采取提高分解过程产生高稳定性自由基的反应物作为阻燃剂也有望成为一种降低可燃性的手段,包括原本可燃性更强工质的添加。
在R32中仅添加摩尔分数为10%的R1234yf,当量比为1时的燃烧平衡温度可下降87.5 ℃,如图8所示,R1234yf占比在初始影响较大;与之相似,当R1234yf达到可燃燃烧极限时(室温和常压下0.289 kg/m3,摩尔分数约为6.1%),R32摩尔分数为5% 的R1234yf和R32混合物的燃烧平衡温度可下降21.0 ℃,混合物可燃性进一步降低。绝热燃烧温度尽管无法反应实际可燃物的燃烧风险,但作为总体能量大小的度量,在大量文献中仍然作为不同燃料燃烧能力的对比标准之一,通过上述分析可知,掺入较低摩尔分数具有相似分子结构的低可燃性物质可一定程度上降低整体可燃性。

图8 R1234yf与R32互混平衡燃烧温度的影响Fig.8 Flame temperature at different mixture ratio
与图3和图4进行的均质反应模型具有相同的反应参数和操作参数,添加摩尔分数为10%的R32对R1234yf的燃烧情况进行对比,图9和图10分别为添加R32后初始反应的消耗和自由基的产生情况。特别值得注意的是,点火延迟受到影响较大,降至6.760 s。同时,OH自由基的摩尔分数得到大幅降低,最大摩尔分数从0.37%降至0.33%,降低约10.8%,较高的自由基摩尔分数降低对燃烧过程热量释放具有较大的抑制作用,因此,通过增加其他结构相似的阻燃剂,特别是含卤素的阻燃剂,可以进一步实现更高效燃烧阻抑。例如,如果不考虑CF3I的ODP不为零的环境影响(实际平流层ODP为零),添加CF3I进一步增大对自由基的消耗,通过添加当前研究热门的纳米制冷剂,如氢氧化铝、氧化锑等固体分散物,有望对燃烧反应过程的热量阻断、协同阻燃起到重要的作用。
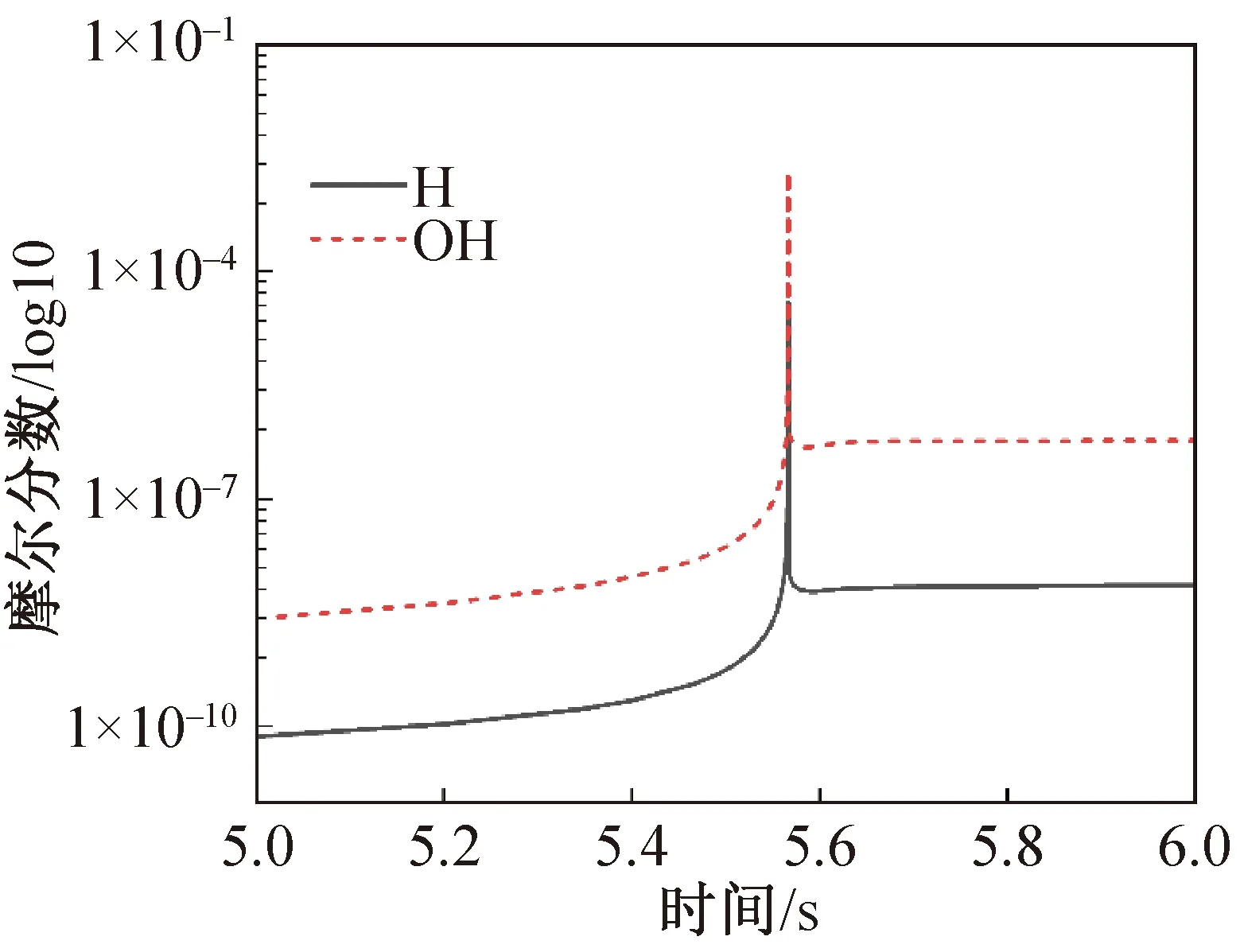
图10 添加摩尔分数10%R32的R1234yf自由H和OH摩尔分数变化Fig.10 H and OH mole fraction of R1234yf and R32 mixture (10% R32 in reactant)
4 结论
本文通过对比研究以R32为代表的饱和烷烃类可燃制冷剂和以R1234yf为代表的不饱和烯烃类可燃性制冷剂在化学动力学上的相似性和相互作用,根据已有文献的燃烧反应模型,对两种物质在空气中的燃烧反应过程进行了一维模拟研究,得到如下结论:
1)两类含氟烃类制冷剂燃烧反应满足烷烃和烯烃类物质模型,其中R1234yf在进行分解的过程中间产物多,而进一步的反应与饱和类烷烃分解产物接近。
2)通过消耗反应物的分析,燃烧反应化学平衡受到分解产物摩尔分数的影响,通过添加近似分解产物的制冷剂,会带来抑制后续放热反应的阻燃效果,R32中添加摩尔分数为10%的R1234yf时,平衡温度可下降87.5 ℃;R1234yf中添加R32的摩尔分数为5%时,混合物的平衡温度可下降21.0 ℃。
3)通过对反应过程自由基的生成与湮灭进行分析,在添加更高可燃性组分的低碳烷烃或氟代烷烃后,混合物初始热分解过程可能缩短,以平衡温度所表征的可燃性低于其任意纯组分。

