森林脑炎病毒单克隆抗体的研制及抗原定量双抗体夹心E L I SA检测方法的建立和应用
吴月,韩顺子,唐剑光,张秀霞,吴晓娟,孙宏亮,曹玉锋,常军亮,邹勇
长春生物制品研究所有限责任公司,吉林 长春 130012
森林脑炎又称蜱传脑炎(tick-borne encephalitis,TBE),是由森林脑炎病毒(tick-borne encephalitis virus,TBEV)引起的以侵袭中枢神经系统为主的一种自然疫源性疾病[1]。TBEV包含3种结构蛋白(C、prM、E),其中E蛋白是病毒最主要的结构蛋白,能够诱导产生保护性抗体[2-3],参与宿主的保护性免疫应答[4-6]。接种森林脑炎疫苗是预防TBE的最有效手段。
TBEV抗原含量是森林脑炎疫苗原液检定的主要指标之一[7]。在疫苗生产过程中,需对不同阶段病毒抗原含量进行监测。目前,国内尚未见商品化TBEV抗原ELISA检测试剂盒上市。本研究用灭活纯化TBEV“森张”株免疫BALB/c小鼠,采用杂交瘤细胞融合技术筛选抗TBEV单克隆抗体杂交瘤细胞株,制备抗TBEV单克隆抗体,并建立单克隆抗体双抗体夹心ELISA病毒抗原定量检测方法,为森林脑炎疫苗生产过程中TBEV抗原含量检测及疫苗原液检定提供一种快速简便的病毒抗原定量方法。
1 材料与方法
1.1 细胞株及病毒株 小鼠骨髓瘤细胞NS-1株由长春生物制品研究所有限责任公司(以下简称长春公司)生物技术研究室保存;TBEV“森张”株灭活纯化全病毒由长春公司疫苗三室提供。
1.2 实验动物 SPF级BALB/c小鼠,雌性,6~8周龄,体重16~18 g,由长春公司实验动物中心提供,动物许可证号:SCXK(吉)-2017-0005。
1.3 疫苗原液、标准品及工艺过程相关蛋白 TBEV灭活疫苗原液(批号:Y201909、Y201915、Y201916、Y201917、Y201918)、TBEV疫苗标准品(10.0μg/mL)及PHK细胞培养上清均由长春公司疫苗三室提供。
1.4 主要试剂及仪器 RPMI1640培养基(cat:3187-0074)购自美国Gibco公司;新生牛血清及胎牛血清购自武汉三利生物技术有限公司;人血白蛋白为成都蓉生药业有限公司产品;弗氏佐剂(cat:F5881、F5506)、PEG4000(cat:95904)、HAT(cat:H0262)、HT(cat:H0137)、3,3′,5,5′-四甲基联苯胺(TMB)(cat:87748)和降植烷(cat:T2280-2)购自美国Sigma公司;硝酸纤维素膜(NC膜)(cat:10600001)、nProtein A SepharoseTM4FastFlow(cat:17-5280-01)和ÄKTA purifierTMUPC 100购自美国GE公司;AP标记山羊抗小鼠IgG(cat:BL021A)购自北京兰杰柯科技有限公司;Goat Anti-Mouse IgG/HRP(cat:bs-0296G-HRP)购自北京博奥森生物技术有限公司;BCIP/NBT底物显色试剂盒(cat:PR1100)购自北京索莱宝科技有限公司;HRP快速标记试剂盒(cat:EL0156)购自湖州英创生物技术有限公司;Folin-酚试剂购自北京鼎国昌盛生物技术有限责任公司;酶标仪(iMarkTM)购自美国BIO-RAD公司。
1.5 杂交瘤细胞株的制备 以TBEV灭活纯化全病毒作为免疫原经皮下免疫小鼠,50μg/只,初次免疫使用弗氏完全佐剂,间隔7 d,再次免疫使用弗氏不完全佐剂,基础免疫共免疫4次。融合前3 d,经尾静脉加强免疫,100μg/只。采用PEG4000化学法进行细胞融合。间接ELISA法检测融合杂交瘤细胞培养上清效价,有限稀释法对阳性杂交瘤细胞进行克隆,细胞株经反复冻存、复苏及连续传代培养,通过检测细胞培养上清抗体效价,验证杂交瘤细胞株的稳定性。
1.6 单克隆抗体的制备及纯化 采用小鼠体内诱生法制备单抗腹水。接种杂交瘤细胞前1周,经小鼠腹腔注射降植烷,0.5 mL/只;1周后经小鼠腹腔注射杂交瘤细胞悬液,0.2 mL/只,逐天观察小鼠腹部,待小鼠腹部出现明显涨大后,引流采集腹水。单抗腹水经50%饱和硫酸铵沉淀、除盐后,采用nProtein A SepharoseTM4FastFlow亲和层析法进行纯化,12%SDSPAGE分析抗体蛋白纯度,Lowry法测定抗体蛋白浓度。
1.7 单克隆抗体的鉴定
1.7.1 特异性 采用Western blot法。将TBEV全病毒抗原进行还原性SDS-PAGE后,转印至NC膜,以制备的单抗为一抗、AP标记山羊抗小鼠IgG为二抗进行孵育,加BCIP/NBT底物显色后,分析抗体反应特异性。
1.7.2 相对亲和力 采用间接ELISA法。将4株纯化单抗从2mg/mL开始进行2倍系列稀释,以2.0μg/mL TBEV抗原包被酶标板,分别测定系列稀释的单抗的A450值,以与包被抗原出现50%结合时单抗的蛋白浓度为该株单抗的相对亲和力[8-9]。
1.8 双抗体夹心EL I S A检测方法的建立
1.8.1 抗体配对 采用叠加ELISA法[10]。以0.25μg/mL TBEV抗原包被酶标板,分别测定单株饱和单抗及两两组合后的单抗的吸光度值,并按下式计算叠加系数(additivity index,A.I)。
A.I(%)=[(A1+A2)/2 A(1+2)-1]×100%
式中A1、A2和A(1+2)分别为第1、第2和两个组合在一起的单抗在ELISA试验中测得的A450值,当A.I>40%时认为两株单抗识别不同的抗原位点,即选为配对抗体,用于本方法的建立。
1.8.2 方法的建立 采用棋盘滴定法。将包被抗体按照5、10、20μg/mL包被酶标板,按1∶800、1∶1 600、1∶3 200、1∶6 400稀释酶标抗体,检测20倍稀释标准品及阴性对照(样品稀释液:含2%BSA的PBS溶液),以阳性值(P)/阴性值(N)为最大值时所对应的包被抗体浓度和酶标抗体稀释倍数作为最佳工作浓度,优化包被条件和封闭条件,建立双抗体夹心ELISA检测方法。
1.9 方法的验证
1.9.1 最低检测限 取2倍系列稀释的TBEV抗原标准品,用建立的方法进行定量检测,以阴性对照孔A450值的2.1倍作为Cut-off值,大于Cut-off值判为阳性,确定最低检测限,即方法的敏感度。
1.9.2 线性相关性 将TBEV抗原标准品2倍系列稀释,共6个稀释度,用建立的方法进行3次重复检测;分别以标准品蛋白浓度为横坐标,A450平均值为纵坐标建立线性回归方程,并计算相关系数(R2)。
1.9.3 特异性 采用建立的方法检测TBEV灭活疫苗生产过程中可能存在杂质和使用的主要原辅料(新生牛血清、PHK细胞培养上清、人血清白蛋白),以TBEV疫苗原液作为阳性对照,验证方法的特异性。
1.9.4 准确性 取Y201909批TBEV灭活疫苗原液500μL,加入相同体积、浓度分别为10、5、2.5μg/mL的TBEV抗原标准品,使标准品浓度分别为5、2.5、1.25μg/mL,用建立的方法定量测定3份样品中TBEV标准抗原浓度,重复测定3次,按下式计算TBEV标准抗原回收率,验证方法的准确性。
标准抗原回收率(%)=(待回收样本测定浓度-基础样本测定浓度)/加入浓度×100%
1.9.5 精密性 配制3个不同浓度TBEV抗原标准品:8.0、3.0和1.0μg/mL,用建立的方法分别检测3个浓度样品中TBEV抗原含量,每个浓度检测10个复孔,重复检测3次,分别计算试验内、试验间抗原浓度平均值(Mean)、标准差(SD)及试验内和试验间变异系数(CV),验证方法的精密性。
1.9.6 适用性 采用建立的方法检测本公司生产的5批TBEV灭活疫苗原液(批号:Y201909、Y201915、Y201916、Y201917、Y201918)中TBEV抗原含量,每次检测均将疫苗原液2倍系列稀释。
1.10 数据分析 应用EXCEL 2016软件计算样本的Mean、SD、回收率、CV值以及进行线性回归分析。
2 结果
2.1 单克隆抗体的制备 共制备4株抗TBEV单抗杂交瘤细胞株:5F5、2G12、5E1及2H9,细胞株经反复冻存、复苏3次及连续培养3个月,培养上清ELISA效价均在104~105,腹水效价为106~107,见表1。

表1 单克隆抗体的效价Tab.1 Titers of mAbs
2.2 单克隆抗体的鉴定
2.2.1 纯度及浓度 12%SDS-PAGE分析显示,纯化抗体纯度>95%,见图1。经Lowry法测定,纯化单抗5F5、2G12、5E1、2H9的浓度分别为5.3、7.2、4.5、6.1 mg/mL。

图1 纯化单抗的SDS-PAGE分析Fig.1 SDS-PAGE profile of purified mAb
2.2.2 特异性 Western blot分析显示,4株单抗均与TBEV包膜E蛋白产生了特异性反应,见图2。

图2 4株单抗的Western blot鉴定Fig.2 Western blotting of four mAbs
2.2.3 相对亲和力 ELISA结果显示,4株单抗的相对亲和能力:2G12>5F5>2H9>5E1,见图3。
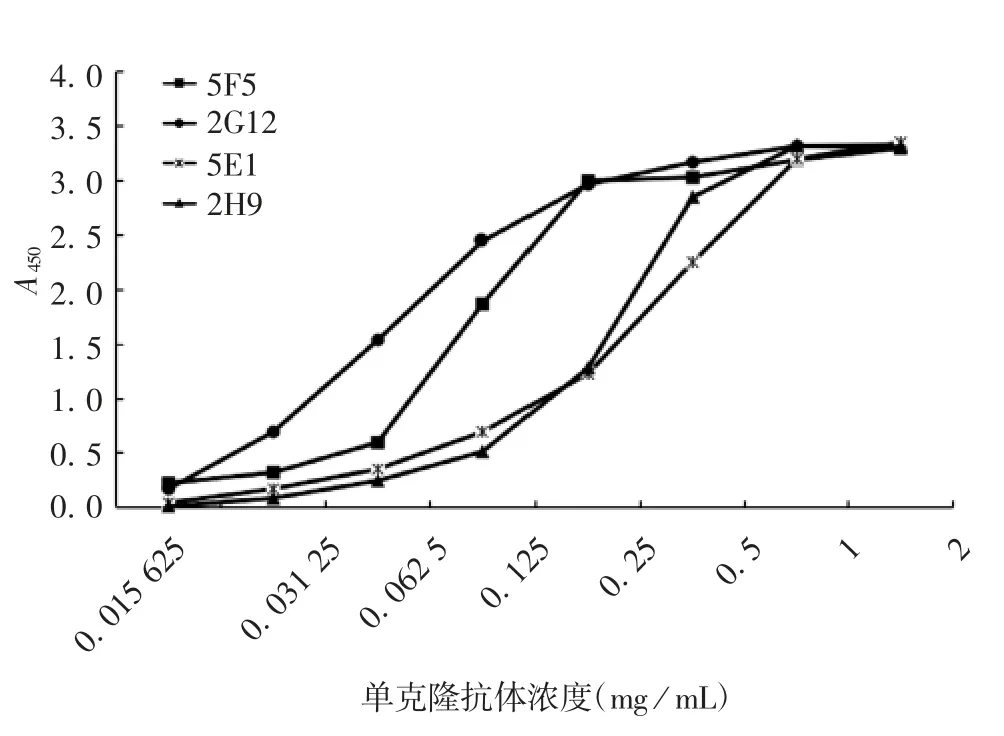
图3 4株单抗的相对亲和力Fig.3 Relative affinity of four mAbs
2.3 双抗体夹心EL I S A检测方法的建立 采用叠加ELISA法,首先确定5F5与2G12作为最佳配对抗体,用于检测方法的建立,见表2。根据棋盘滴定法检测结果,包被抗体浓度为10μg/mL,酶标抗体稀释度为1∶3 200时,P/N值最大,见表3。确定5F5作为包被抗体,最佳包被浓度为10μg/mL;2G12作为酶标抗体,最佳工作浓度为1∶3 200。通过条件优化,确定抗体包被条件为:2~8℃过夜(大于24 h);3%小牛血清白蛋白2~8℃封闭过夜(大于16 h);检测温度37℃,检测时间1 h。
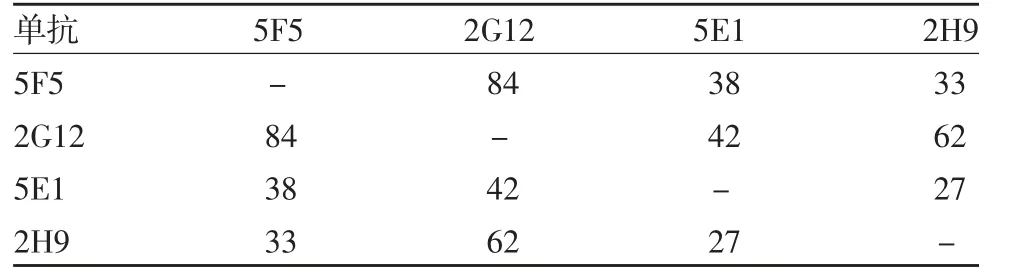
表2 4株单抗的A.I(%)Tab.2 A.I of four mAbs(%)
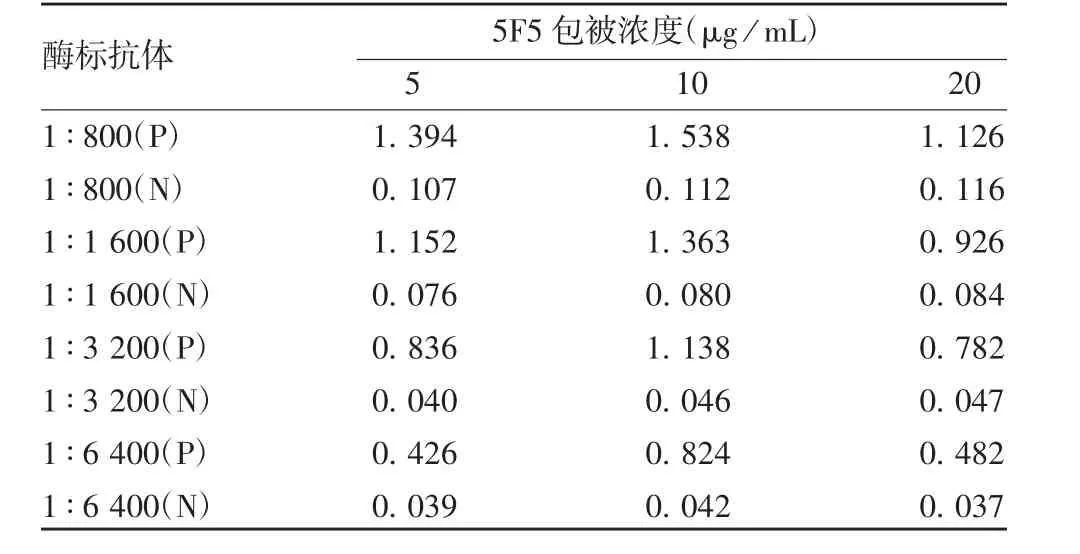
表3 抗体最佳工作浓度的选择(A450)Tab.3 Optimization of working concentration of antibody(A450)
2.4 方法的验证
2.4.1 最低检测限 标准品稀释至1 024倍时,A450值为0.109,大于Cut-off值,结果为阳性,此时抗原含量为0.009 8μg/mL,初步确定该方法的最低检测限为0.009 8μg/mL,见表4。
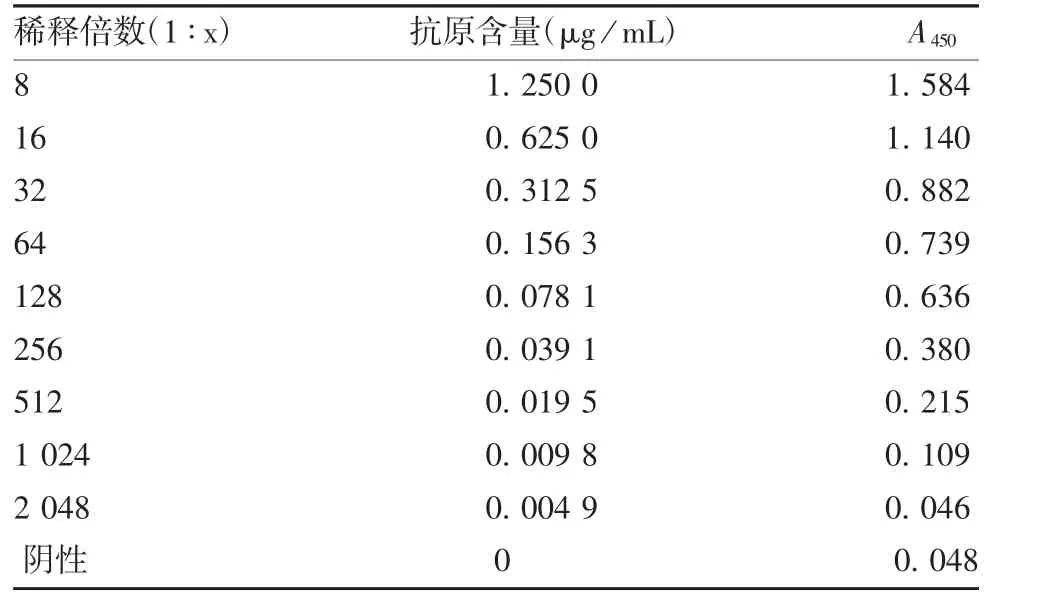
表4 最低检测限验证结果Tab.4 Verification for minimum detection limit
2.4.2 线性相关性 检测6个稀释度TBEV抗原标准品的线性回归方程为y=0.706 x+0.646 3,R2=0.994 3。当TBEV抗原标准品蛋白浓度在0.078 1~2.5μg/mL之间时,标准品蛋白浓度与A450值具有良好的线性关系,见图4。

图4 线性相关性验证Fig.4 Verification for linear correlation
2.4.3 特异性 采用建立的方法能特异性检测出TBEV灭活疫苗,而与疫苗生产过程中可能存在的杂质和使用的主要原辅料无交叉反应,见图5。表明该方法特异性良好。
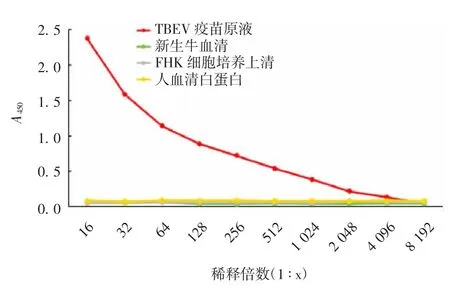
图5 特异性验证Fig.5 Verification for specificity
2.4.4 准确性 采用建立的方法检测3种不同浓度TBEV抗原标准品的加样回收率在96.2%~109.2%之间,见表5。表明该方法准确性良好。
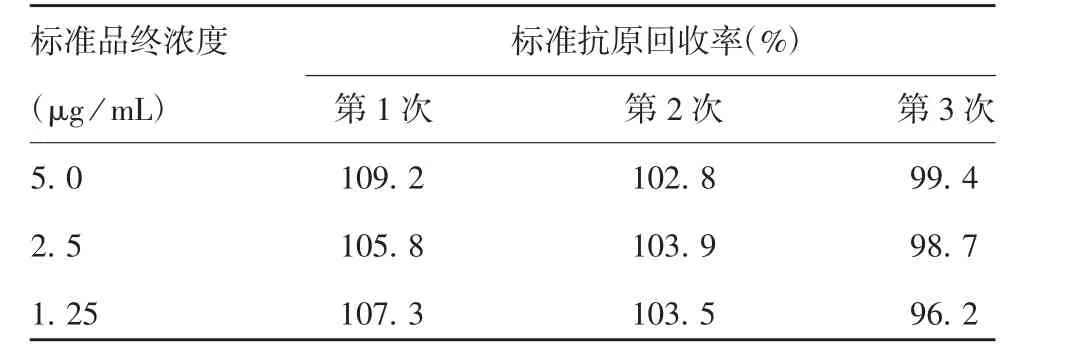
表5 准确性验证Tab.5 Verification for accuracy
2.4.5 精密性 采用建立的方法检测3个浓度的TBEV抗原标准品,试验内CV在7.37%~8.40%之间,试验间CV在8.66%~9.38%之间,见表6。表明该方法精密性良好。

表6 试验内与试验间精密性验证Tab.6 Verification for precisions in intra-and inter-assays
2.4.6 适用性 采用建立的方法检测5批TBEV灭活疫苗原液,A450值与疫苗稀释度呈良好的剂量依赖关系,见图6。表明该方法适用性良好。

图6 5批TBEV灭活疫苗原液抗原含量检测结果Fig.6 Determination results of antigen content of five batches bulks of inactivated TBEV vaccine
3 讨论
TBE是林区常见和多发的传染性疾病,人群普遍易感[1,11],并呈明显的区域性和季节流行性。东北地区是我国TBE主要自然疫源地,另外,云南和新疆代表我国西南、西北疑似自然疫源地,根据血清流行病学调查,也存在既往TBEV感染的报道[12]。TBEV为嗜神经包膜病毒,可侵犯中枢神经系统导致病变[13]。TBEV包含3个结构蛋白以及7个非结构蛋白[14-15]。E蛋白是病毒主要毒力和抗原位点,参与病毒与宿主细胞受体结合,刺激机体产生中和抗体,决定着病毒的细胞噬性,是疫苗主要的保护性位点;另外,E蛋白也是TBEV特异性诊断抗原,用于病毒的特异性鉴定和疾病诊断[16-17]。
目前,在临床上尚无有效的抗病毒治疗手段,主要通过对症治疗,缓解症状等措施治疗TBE疾病;在流行区域,高发人群进行疫苗接种是预防TBE最有效的手段,可显著降低感染率和发病率[18-19]。
在TBEV灭活疫苗生产过程中,检测病毒滴度和有效抗原含量是保证疫苗有效性的重要环节;TBEV E蛋白是诱导保护性中和抗体的主要蛋白,即疫苗最有效的保护性抗原,理论上检测E蛋白含量可间接评价疫苗的保护性。现有疫苗的免疫原性检测,是通过动物免疫和攻毒实验计算免疫保护性指数进行疫苗评价[7],需在特殊环境下操作活病毒,存在安全风险,且疫苗检测周期长,亟待建立一种简便、有效、快速的检测方法用于疫苗生产过程抗原含量检测。
本研究采用小鼠杂交瘤融合技术,以“森张”株灭活全病毒为免疫原,制备TBEV特异性单抗,经Western blot鉴定,制备的单抗均与TBEV包膜E蛋白发生特异性反应,经抗体配对、相对亲和力测定等,利用选出的单抗建立了双抗体夹心ELISA抗原定量检测方法。经方法的验证,确定建立的ELISA法具有较高的敏感度、特异性、精密性和线性相关性。利用建立的方法检测5批TBEV灭活疫苗原液,抗原含量与吸光度值呈剂量依赖相关性,表明所建立的方法具有良好的适用性。本方法可特异性检测TBEV包膜E蛋白,应用于生产过程中病毒抗原含量监测。虽然目前本方法尚不能简单代替疫苗效力检测,但随着对单抗研究如中和特性等研究的深入,以及与动物实验大量数据统计比对,存在替代动物实验检测疫苗免疫保护性的可能。
综上所述,本实验成功制备了抗TBEV单克隆抗体,其特异性针对病毒保护性包膜E蛋白;并在此基础上建立了TBEV双抗体夹心ELISA抗原检测方法,经初步适用性研究,可用于TBEV疫苗生产过程中病毒抗原含量检测。

