化学平衡隔板问题求解策略
边永平
(河北省丰宁县第一中学 068350)
一、隔板居中类求解策略
由于隔板居于容器正中,说明隔板两则压强相等,由于隔板两侧的空间容积相等,根据阿伏加德罗定律可知,两侧气体的物质的量也相等,这是解决问题的出发点,而确定取值范围则常采用极限法.
例1现有一反应容器(容积固定),中间隔板可自由移动,两侧均为可逆反应(如图1所示).起始加入量如下:A、B和C均为4.0mol、D为6.5mol、F为2.0mol,设E为xmol.当x在一定范围内变化时,可以通过调节温度使两侧反应均达到平衡,使隔板正好位于反应器的正中.
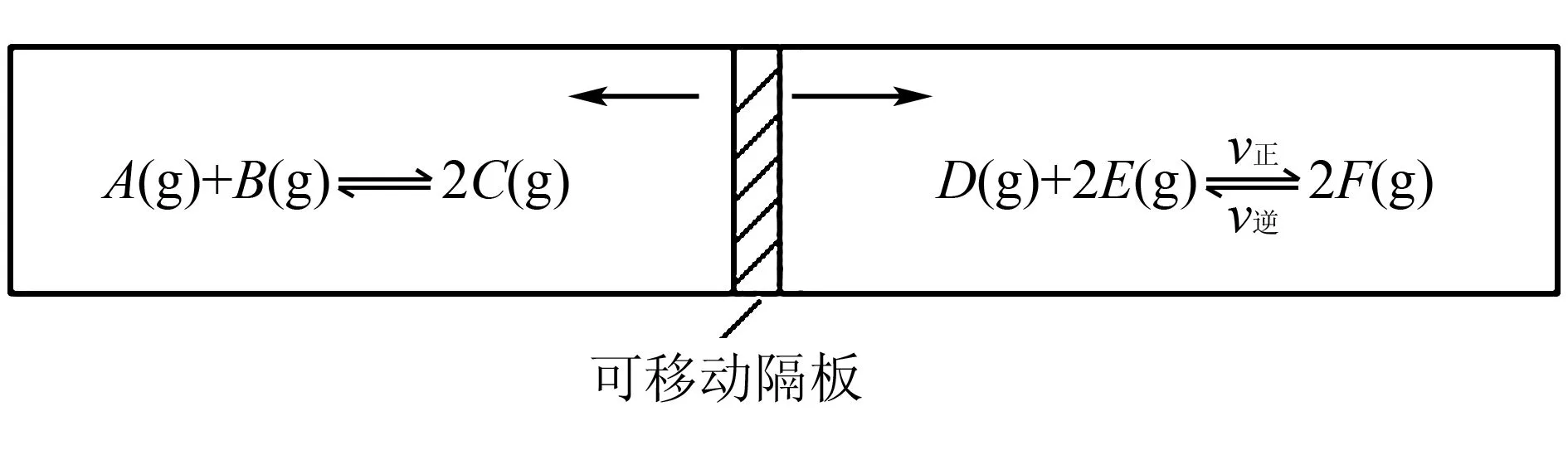
图1
请填写以下空白:
(1)若x=4.5,则右侧反应在开始时向____(填“正反应”或“逆反应”)方向进行.要使起始反应维持向该方向进行,则x的最大取值应小于____.
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?____(填“相等”、“不相等”或“不能确定”).其理由是____.
解析由题意知,图1中容器两侧的反应都达平衡时,隔板处于正中间,此时隔板两侧的压强相等,由阿伏加德罗定律知,此时隔板两侧气体的总物质的量必然相等.


(1)若x=4.5时,则右侧开始时气体总物质的量为13mol,而平衡时要变成12mol,只能向正反应应进行.
设右侧反应达平衡时,消耗D为amol,则起始与平衡时各气体的物质的量的关系为:

起始(mol) 6.5x2.0
反应(mol)a2a2a
平衡(mol) 6.5-ax-2a2.0+2a
由于可逆反应的特点是反应不能进行到底,即有x-2a>0,再有平衡时气体总量为12mol,即有(6.5-a)+(x-2a)+(2.0+2a)=12,两式联立,可得:x<7.0 .
(2)当x的值分别为4.5和5.0时,欲使反应都达到平衡状态且满足反应混合物总物质的量为12mol,反应均需要向正向进行,而且两种情况下反应向正向进行的程度必然不同.由题意知,这是通过调节反应器的温度来实现的,换言之,x的值分别为4.5和5.0时,两种情况达到平衡对应的温度是不同的.
由于左侧反应也是在两种不同的温度下达到平衡,因此平衡时A的物质的量也不相等.
参考答案:略
二、隔板偏于一侧类求解策略
根据阿伏加德罗定律,推算出同温同压下,气体物质的量之比等于体积比,从而确定出两侧最终平衡时气体的物质的量.

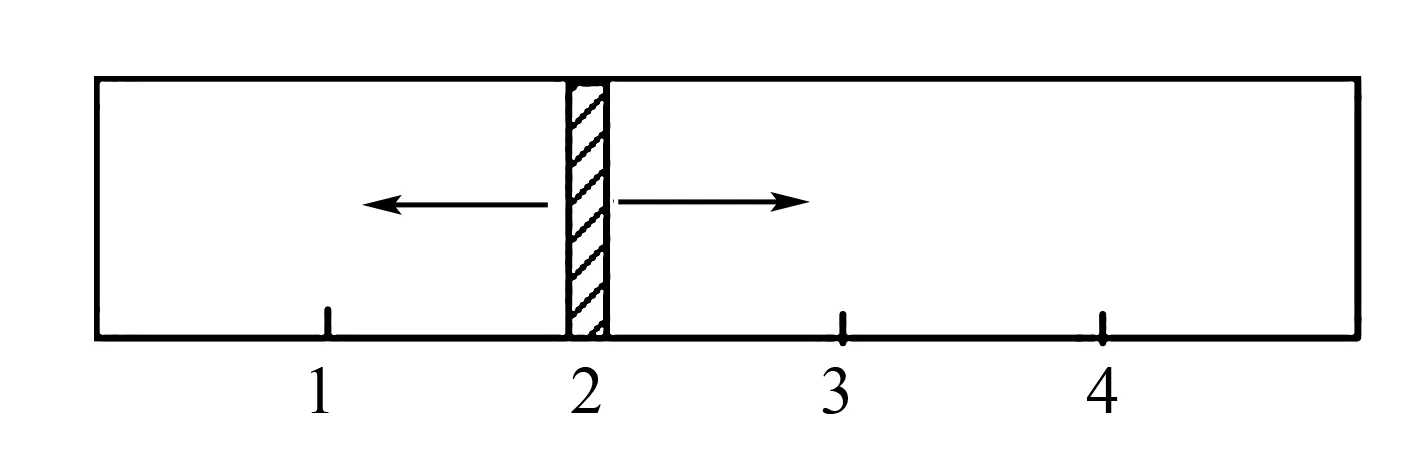
图2
(1)x=1.5,则左侧反应开始时向____(填“正反应”或“逆反应”)方向进行.欲使起始反应维持向该方向进行,则x的取值范围是____.
(2)若x=2,则左侧反应在起始时向____(填“正反应”或“逆反应”)方向进行.平衡时混合气中SO2所占的体积分数为____.欲使起始反应维持向该方向进行,则x的最大值应小于____.
解析分析两反应式可知,右侧容器内气体体积维持不变,始终为9mol;为使平衡时隔板停于位置2,依阿伏加德罗定律可知,平衡后左侧容器内混合气物质的量总和为9×2/3=6mol.
(1)若x=1.5,则初始时n总=1.5+3.25+1=5.75mol<6mol,即需要使反应向气体体积增大的方向移动,即向逆反应方向进行.
若要使反应维持向逆反应方向进行,需有:x+3.25+1<6,即x<1.75;
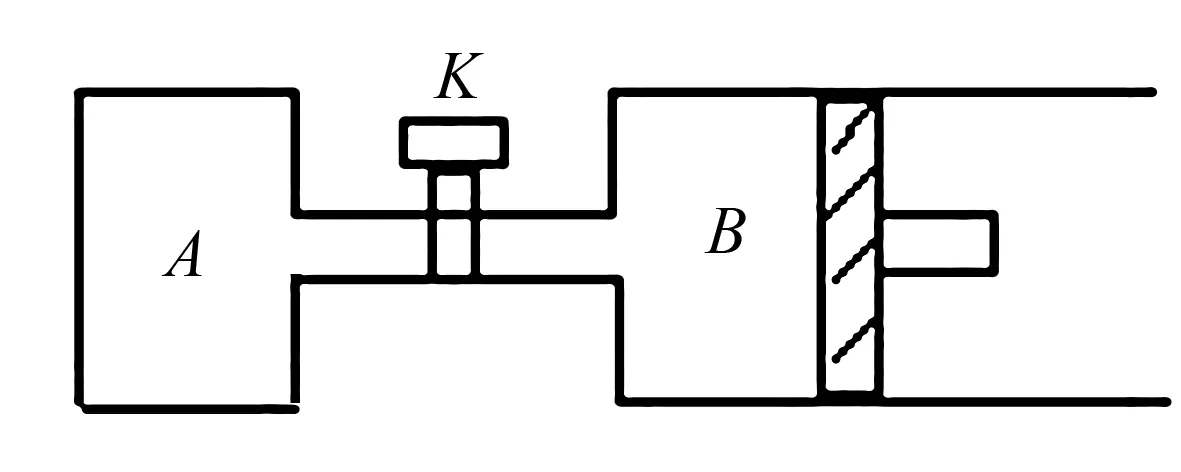
若令1mol SO3完全反应,则可求出x的最小值:x+3.25+1+0.5>6,即x>1.25,故x的取值范围为:1.25 (2)若x=2(不在1.25~1.75之间),2+3.25+1=6.25>6,故起始时应向着气体体积减小的方向进行,即正反应方向. 设平衡时SO2转化了amol,则 起始 2 3.25 1 转化a0.5aa 平衡 (2-a) (3.25-0.5a) (1+a) 则平衡时n总=(2-a)+(3.25-0.5a)+(1+a)=6 解得a=0.5mol,n(SO2)=2mol-0.5mol=1.5mol,所占体积分数为(1.5/6)×100%=25% 若要维持反应向正反应方向进行,则需要要讨论: 若3.25mol O2完全转化,则需SO26.5mol,完全转化后物质的量减少3.25mol,则n(混合气)=6.5+3.25+1-3.25=7.5≠6,不合题意. 若xmol SO2完全转化,则耗去O20.5xmol,完全转化后物质的量减少0.5xmol,则n(混合气)=x+3.25+1-0.5x=6, 得x=3.5mol, 即x<3.5mol 参考答案:见解析过程. 不带隔板的一侧为恒容条件,带有隔板的一侧为恒压条件. 图3 请回答; (1)A中W和B中Z的物质的量比较:n(W)A____n(Z)B(填>、<或=). (2)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为____(用含a的代数式表示,连通管中气体体积不计). 解析(1)设A中平衡时,n(W)=xmol,则n(Z)=0.5xmol,设B中平衡时体积为2aL, 即相当于两个A容器, 当B中平衡后,n(Z)=xmol,此时再给B加压,压至0.8aL,则会使平衡正移,将使n(Z)大于xmol,即有:n(W)A (2)打开K后,A、B可看成一个整体,则此时的容器与原来B容器同温同压,依V(新)/V(B)=(1+2)/2,得:V(新)=1.2aL,则B部分的体积应为0.2aL. 参考答案:见解析过程.
三、隔板自由移动类求解策略