分类例析中和反应考题的多变性
山东省枣庄市市中区永安镇中学 陈 丽 277100
中和反应是发生在酸、碱之间的一类反应,是初中化学学习的重点之一,它将酸碱知识融为一体,综合性强,能有效考查学生的基础知识和基本技能,因此在中考中常考不衰且题型多变.现将近年来有关中和反应的中考题分类例析如下.
类型一:考基本概念
例1 (2020.枣庄)推理是学习化学的重要思维方法,下列推理中合理的是().
A.有机物一定含有碳元素,所以含有碳元素的物质一定是有机物
B.溶液是均一稳定的液体,所以均一稳定的液体都是溶液
C.碱性溶液能使酚酞试液变红色,所以能使酚酞试液变红色的溶液显碱性
D.中和反应一定能生成盐和水,所以生成盐和水的反应一定是中和反应
解析:有机物一定含有碳元素,但是含有碳元素的物质不一定是有机物,如二氧化碳含碳元素,但是属于无机物,故A 错误;溶液是均一稳定的液体,但是均一稳定的液体不一定都是溶液,如水是均一、稳定的液体,但是不属于溶液,故B 错误;碱性溶液能使酚酞试液变红色,所以能使酚酞试液变红色的溶液显碱性,说法正确,故C 选项符合题意;中和反应一定能生成盐和水,但是生成盐和水的反应不一定是中和反应,如氢氧化钠和二氧化碳反应生成碳酸钠和水,虽然生成物是盐和水,但反应物不是酸和碱,故D错误.
点评:中和反应是酸和碱作用生成盐和水的反应.判断中和反应必须注意两点:反应物为酸和碱,生成物为盐和水,只有同时满足这两点的反应才是中和反应.生成盐和水的反应类型很多,如酸和某些金属氧化物的反应、碱和某些非金属氧化物的反应,它们都不是中和反应.抓住概念中的关键词和关键点,理解概念的内涵和外延,学会多角度、全方位思考分析问题是正确答题推理题的关键.
类型二:考反应实质
例2 (2020.泰安)将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下. 下列说法不正确的是( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶液的总质量不变
C.反应后溶液呈中性
D.反应前后元素种类不变
解析:图1 表示了中和反应的实质. 由图可知,反应前的阴离子是氯离子和氢氧根离子,阳离子是氢离子和钠离子,反应时,由于氢离子和氢氧根离子结合成了水分子使反应后阴阳离子的数目都减少,故A 错误;两种溶液反应后生成可溶性的氯化钠和水,根据质量守恒定律,反应前后溶液的总质量不变,故B 正确;氢氧化钠溶液与稀盐酸恰好完全反应时,氢离子和氢氧根离子全部结合生成水分子,溶液中没有多余的氢离子或氢氧根离子,所以此时溶液呈中性,故C 正确;由质量守恒定律可知,化学反应前后元素的种类不变,故D 选项正确.答案:A
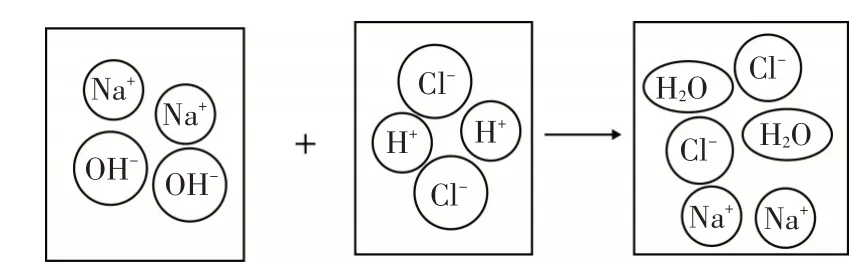
图1
点评:宏观和微观相联系是化学独特的思维方式,宏观辨识与微观探析是化学学科的核心素养之一,因此以构建微粒模型的方式将宏观和微观相联系的考题是中考的热点之一.将宏观反应与微观实质相结合,仔细观察示意图,认真分析反应前后微粒种类的变化,并正确应用质量守恒定律是解答此题的关键.
类型三:考实际应用
例3 (1)(2020.青岛)蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),为了减轻痒痛,可以在被叮咬处涂抹( )
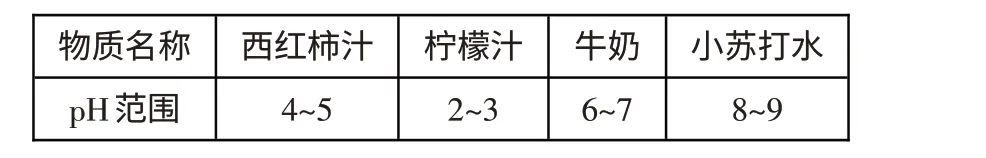
A.西红柿汁 B.柠檬汁
C.牛奶 D.小苏打水
(2)(2020.铜仁)如饮食不当,胃会分泌出大量胃酸,服用含有下列哪种物质的药物可以中和过多胃酸,写出反应的化学方程式___________.
A.NaOH B.Na2CO3C.Al(OH)3
(3)(2020.常州)下列常用来改良酸性土壤的物质是( )
A.熟石灰 B.硫酸 C.烧碱 D.食盐
解析:(1)蚊虫叮咬时释放出的液体中含有蚁酸(显酸性)导致皮肤痒痛,应涂抹碱性的物质,让其与蚁酸发生中和反应而减轻症状. 小苏打水pH>7,显碱性,故选D;(2)胃酸中的酸是盐酸,要中和过多胃酸,应选择能与盐酸反应、且无毒、无腐蚀性的碱性物质,显然应选氢氧化铝,发生中和反应的化学方程式为Al(OH)3+3HCl═AlCl3+3H2O;(3)要改良酸性土壤,根据中和反应的原理应选择碱性物质.硫酸是酸性,食盐是中性,均不符合要求,烧碱是氢氧化钠,但碱性太强且有强烈的腐蚀性,也不适用,熟石灰的主要成分是氢氧化钙,碱性适中、微溶于水且来源广泛,常用来改良酸性土壤.
点评:随着新课程改革的不断深入,中考试题的立意越来越重视联系社会、生产和生活实际,以此引导学生关注人类社会,强化知识的认知价值和社会价值[1],体现化学这门科学既源于生活、社会,又服务于生活、社会的时代主题,从而更好的体现“从生活走进化学,从化学走向社会”的课改新理念.
类型四:考图像
例4 (2020.滨州)某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图2 所 示. 下 列 说 法正确的是( )
A.图2中c点所示溶液呈碱性
B. 图2 中a 点所示溶液中,含有的溶质是K2SO4和H2SO4
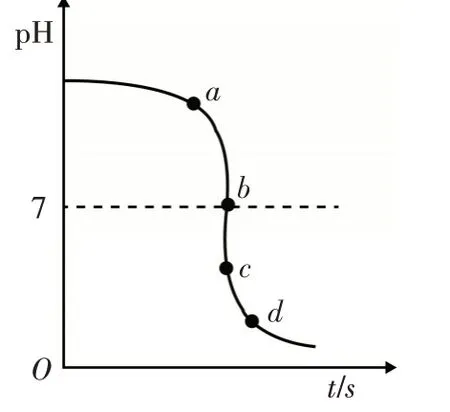
图2
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
解析:解图像题的核心或关键是要仔细观察,弄清图像所表达的内容及内涵,对图像中曲线的整体走势作合理理解,并弄清特殊的点的含义:如曲线的起点、拐点、交点、终点等.分析图像可知,c 点时溶液的pH 小于7,溶液显酸性,故A项错误;a点时溶液的pH 大于7,溶液显碱性,说明氢氧化钾过量,此时溶液中的溶质为KOH 和K2SO4,故B 项错误;从曲线的走势上分析,溶液的pH 是从大于7到等于7再到小于7,可知原溶液显碱性,然后不断的加入酸性溶液使pH 减小,说明是把稀硫酸滴加到氢氧化钾溶液中,故C项错误;b 点是曲线的拐点,pH 为7,代表中和反应恰好完成,该点以后继续滴加稀硫酸就不再发生化学变化,故由c 点到d 点的变化过程中没有发生化学反应,D选项正确.
点评:化学试题中常运用图像信息表示化学反应过程或相关的变化规律,称之为图像题. 图像题包含着丰富的信息知识,能直观形象、简明清晰地体现化学知识的本质,在中考中出现的频率很高. 通过读图识图,有利于考查学生分析处理图表数据的能力、提炼和应用信息的能力,又能考查学生对知识的综合理解和运用能力,所以对考生来说既是重点,也是难点,应予以重视.认真读图识图,准确把握曲线的起点、拐点、终点、交点及曲线的变化趋势,灵活运用所学知识,是正确解答曲线题的关键.
类型五:考物质的鉴别
例6 (2020.天水(略有改动))下列各组物质的溶液,不用其他试剂,无法将其一一区别的是( )
A.CuSO4NaCl NH4Cl Ba(OH)2
B.H2SO4NaOH Na2SO4FeCl3
C.BaCl2Na2SO4Na2CO3NaNO3
D.HCl H2SO4BaCl2K2CO3
解析:不用其他试剂将组内物质一一鉴别,首先考虑特征现象法,即通过观察(如颜色)找到突破口,然后利用已鉴别出的物质作为试剂,将剩余的物质逐一鉴别;若还有一两种物质不能鉴别开,还可以借助生成物继续鉴别. 若特征现象法不能鉴别,可以利用两两混合法,即将组内物质进行两两混合,若反应现象各不相同便可加以区分.
A 组:特征观察法. 观察,只有CuSO4溶液是蓝色,其余都是无色. 首先鉴别出CuSO4,然后把CuSO4作为已知试剂,依次鉴别出另外三种物质.鉴别的顺序是CuSO4(蓝色)→Ba(OH)2(能与CuSO4反应生成沉淀)→NH4Cl(能与Ba(OH)2反应放出有刺激性气味的气体)→NaCl;
B 组:特征现象法.FeCl3溶液为黄色,直接鉴别出来,然后将它与其它三种溶液分别混合,则能鉴别出NaOH,不能鉴别的是H2SO4和Na2SO4,但H2SO4可与Fe(OH)3发生中和反应而使沉淀溶解,但Na2SO4不能,从而将其一一鉴别.
C 组:两两混合法. 混合时出现的现象列表表示:
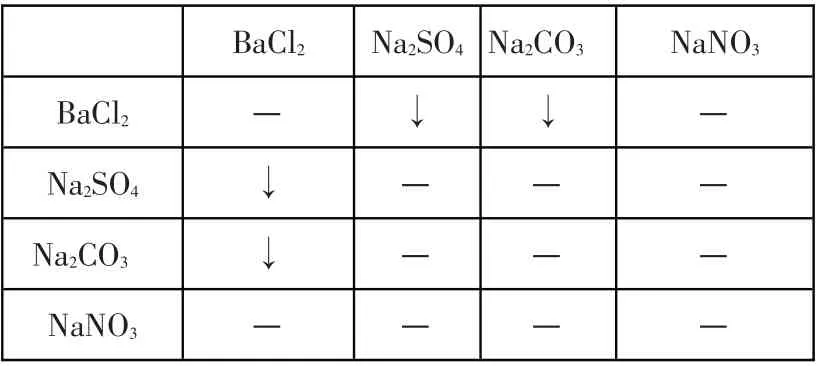
(注:“—”代表无现象,“↑”代表反应生成气体,“↓”代表反应生成沉淀.下同)
根据表中所示,不用其他试剂,只能鉴别 出BaCl2和NaNO3,不 能 鉴 别Na2SO4和Na2CO3;
D 组:两两混合法. 混合时出现的现象列表表示:
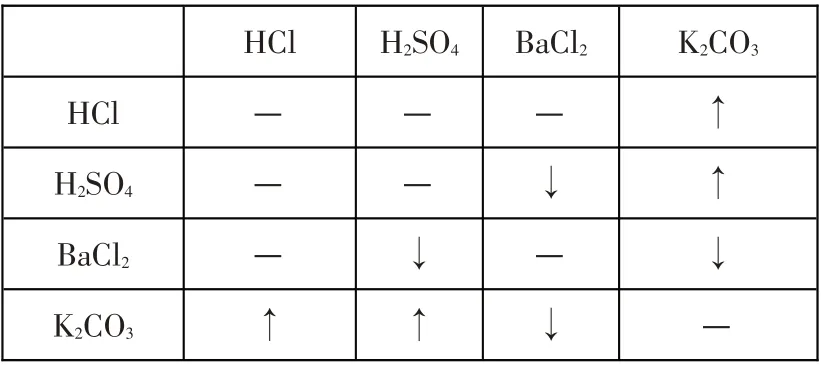
______________HCl H2SO4______BaCl2__________K2CO3___________HCl___H2SO4___BaCl2___K2CO3—_______—_______↑_______—______—↓______↑______—________↓—________↓________↑_____↑↓_____—_____
根据表中所示,四种物质两两混合时现象各不相同,故不用其他试剂可以将其一一鉴别;
点评:鉴别题是中考化学试题中一种常见题型,能较好地考查学生对元素及化合物相关知识的掌握情况,也能很好地考查学生分析推理能力、严密思维能力和实践创新能力.掌握物质鉴别的一般方法,理解酸、碱、盐相互关系,熟练判断酸、碱、盐之间能否反应,记住特殊的反应现象是解题的关键.
类型六:考反应顺序
例6 (2020·宁波)某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图3所示.下列说法错误的是( )
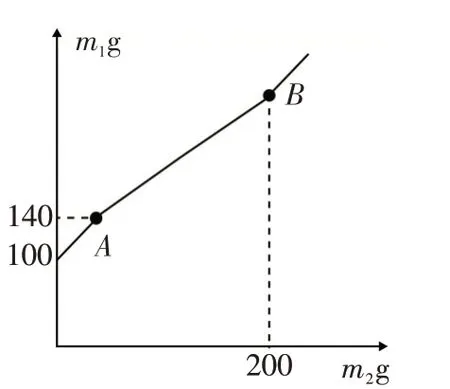
图3
A.反应至A 点时,所加NaOH 溶液的质量为40g
B.反应至A 点时,溶液中的溶质有CuCl2和NaCl
C.反应至B 点时,锥形瓶内溶液的质量为280.4g
D.反应至B 点时,锥形瓶内溶液中NaCl的质量为23.4g
解析:向盐酸和氯化铜的混合液中加入氢氧化钠溶液时发生两个反应:氢氧化钠与盐酸发生中和反应生成氯化钠和水,氢氧化钠与氯化铜反应生成氯化钠和氢氧化铜沉淀.但氢氧化铜也能和盐酸发生中和反应而不能共存,所以加入的氢氧化钠只有先把盐酸消耗完才能跟氯化铜反应,即氢氧化钠溶液优先与稀盐酸发生中和反应,之后再与氯化铜反应形成氢氧化铜沉淀.分析图像中曲线分段情况可知,A 点表示氢氧化钠与稀盐酸恰好完全反应,B 点表示氢氧化钠与氯化铜恰好完全反应.根据质量守恒定律,结合图中数据可知,反应至A 点时加入氢氧化钠溶液的质量为140g-100g=40g,故A 选项正确;反应至A 点时,溶液中稀盐酸恰好完全反应,氯化铜没有反应,所以溶液中的溶质有CuCl2和NaCl,故B 选项正确;由图象可知,反应至B 点时,与氯化铜反应的氢氧化钠溶液的质量为:200g-40g=160g.
设此反应生成的氢氧化铜的质量为x,生成的氯化钠的质量为y,根据化学方程式列式计算:
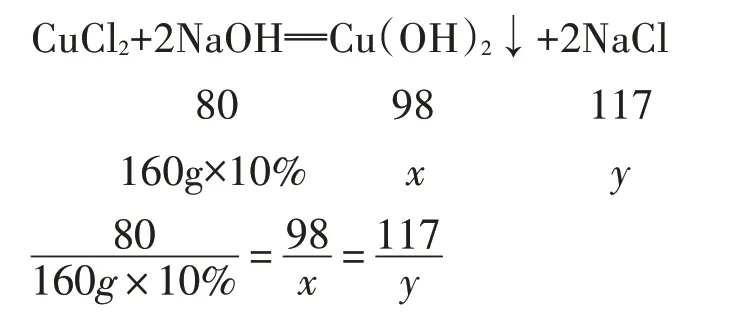
解得:x=19.6g,y=23.4g
此时锥形瓶内溶液的质量为:100g+200g-19.6g=280.4g,故C 选 项 正 确;设40g10%氢氧化钠溶液与盐酸反应生成的氯化钠的质量为z,则

点评:本题的中和反应发生在混合溶液中,涉及到反应顺序、图像和数据的分析判断、化学方程式和溶质质量分数的计算等,将多个知识点融为一体,综合性强,难度较大. 解题的关键是先判断反应的顺序,确定特殊点的含义,进而根据两段反应及图中有关数据进行计算,做出判断.
类型七:考计算
例7 (2018菏泽)黑豆是传统的养生食材,九度米醋大多用于醋泡蛋或醋泡黑豆,用九度米醋泡黑豆可以用来预防高血压,糖尿病等,还有美容护肤、杀菌等功效. 小明为判断家中的9°米醋含酸量是否合格,拟配制一定质量分数的氢氧化钠溶液进行测定. 产品部分信息如图4 所示,请回答相关问题:

图4
(1)配 制100g 质量分数为4%的氢氧化钠溶液需要水____mL(水的密度为1g/cm3).
(2)若9°米醋中的酸均看成醋酸(CH3COOH),醋酸与氢氧化钠反应方程式为:CH3COOH+NaOH=CH3COONa+H2O,小明取10mL9°米醋,加入4%的氢氧化钠溶液12g 恰好完全反应. 请通过计算判断该产品含酸量是否合格.(写出计算过程)
解析:(1)配制100g质量分数为4%的氢氧化钠溶液需要氢氧化钠的质量:100g×4%=4g,所以需要水的体积为:(100g-4g)/1g/cm3=96ml;
(2)NaOH 质 量 为12g×4%=0.48g,设10mL食醋中醋酸的质量为x

所以100ml 样品中含醋酸的质量为0.72 克×10=7.2g,产品标注中醋酸的含量至少为9.00g/100mL,该产品含酸量不合格.
点评:此题借助标签提供的信息,考查了中和反应、化学方程式的计算、溶液的稀释等知识,这类试题具有形象直观、简明清晰、概括性强、知识面广、综合性强等特点,不仅考查学生对信息提取和加工能力,还能使学生在用所学知识解决实际问题的同时,感受到身边处处有化学[1],从而增强学习化学的乐趣.解题的关键是仔细研读标签提供的信息,准确进行化学方程式的计算,灵活运用标签提供的信息进行判断是否合格.
类型八:考实验探究
例8 (2020.泰州)酸碱中和反应是初中阶段重要的一类反应,请你参与探究.
【实验探究Ⅰ】在50 mL 一定浓度的氢氧化钠溶液中滴加50 mL 一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度___,由此现象小李同学得出两者能发生反应的结论. 通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50 mL 一定浓度的盐酸与50 mL 蒸馏水混合,测量溶液温度的变化.
②50 mL 一定浓度的氢氧化钠溶液与50 mL蒸馏水混合,测量溶液温度的变化.
③50 mL 一定浓度的盐酸与50 mL 一定浓度的氢氧化钠溶液混合,测量溶液温度的变化.
用数字化实验技术测得3 个实验,溶液温度随时间变化的关系如图5所示.
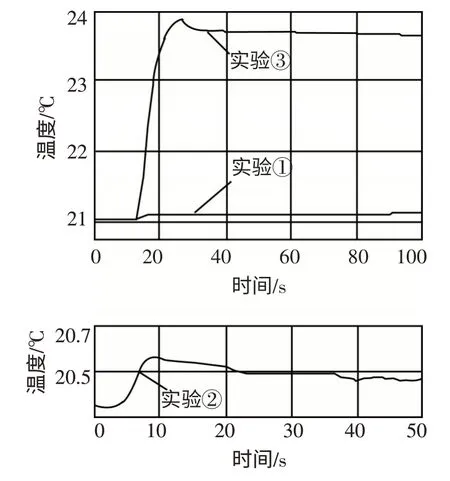
图5
(1)由图可知,盐酸、氢氧化钠溶液稀释时均____(填“放热”或“吸热”),但它们稀释时温度的变化量远_____两溶液混合时温度的变化量.
(2)从微观角度分析,此中和反应的温度变化主要是由于____(填离子符号)两种离子发生反应放出热量的缘故.
【实验探究Ⅱ】
(1)在50mL 一定浓度的氢氧化钠溶液中滴加2~3 滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应.该反应的化学方程式为_____.
(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色.同学们对红色溶液中溶质的成分(酚酞除外)进行再探究.
查阅资料:酚酞在pH<8.2 的溶液中呈无色,在8.2 作出猜想:猜想一:NaCl 猜想二:Na⁃Cl、NaOH 猜想三:NaCl、NaOH和Na2CO3 同学们讨论后一致认为猜想___是错误的,理由是___. 实验验证:取样,滴加___,无气泡产生,猜想三错误. 原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在_____范围内,溶液的颜色变红. 总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色___(填“一定”或“不一定”)变红. 解析:中和反应是放热反应,所以向氢氧化钠溶液中滴加盐酸,由于酸碱中和放出热量而使溶液的温度升高;仔细观察图示,发现盐酸、氢氧化钠溶液稀释时温度的变化曲线都是上升的,因此可知它们的溶液稀释时均放出热量,但曲线上升的程度是不同的,实验③上升的幅度最大,实验①和②上升的幅度较小,由此可知盐酸、氢氧化钠溶液稀释时温度的变化量远小于两溶液混合反应时温度的变化量;中和反应放热的原因是酸中的氢离子(能量较高)和碱中的氢氧根离子(能量较高)结合生成水分子(能量较低)的缘故;盐酸和氢氧化钠反应生成氯化钠和水,化学方程式为NaOH+HCl=NaCl+H2O;由质量守恒定律可知,化学反应前后元素的种类不变,盐酸和氢氧化钠中只含氢、氧、氯、钠四种元素,不含碳元素,反应后不会生成碳酸钠,所以猜想三是错误的;进一步排除碳酸钠的存在,可以利用碳酸钠能与酸发生反应放出气体的性质进行实验,但由于氢氧化钠的存在,所以必须加入足量的酸溶液,若无气泡产生,才能判断猜想三错误;根据资料“酚酞在pH<8.2 的溶液中呈无色,在8.2 点评:此题围绕盐酸和氢氧化钠的中和反应放热情况和实验过程中的“意外”情况展开探究,展示了比较完整的科学探究过程:猜想、验证、结论、反思,不仅考查了学生的思维能力、读图、识图及获取、使用信息的能力,也增进了学生对科学探究的理解,发展了科学探究能力,更突出了新课改理念,激励学生勇于探究、敢于质疑、大胆创新.

