miR-141介导NF-κB信号通路对卵巢癌紫杉醇敏感性的影响及机制研究
洪琴 王治洁 陆杲川 李旭红 林岚 王丹
卵巢癌是女性癌症死亡的第五大原因,也是妇科癌症死亡的主要原因[1]。由于卵巢癌早期相关的症状不明显,超过70%的病例被诊断出时已为晚期转移阶段,且5年生存率约为30%[2]。卵巢癌的主要治疗方法是手术切除可见肿瘤,随后进行化疗辅助,如紫杉醇和顺铂等药物[3]。多数卵巢癌患者对紫杉醇产生耐药性导致复发,然而紫杉醇耐药的分子机制目前尚不完全清楚。微小RNA(microRNA,miRNA)是一种内源性非编码小RNA,通过抑制靶基因mRNA稳定性或翻译实现多种生物学功能[4]。越来越多的证据表明异常表达的miRNA在化疗药物抵抗性或药物敏感性中发挥重要作用[5,6]。最近在卵巢癌细胞中紫杉醇抗性相关差异miRNA中发现miR-141,提示miR-141参与卵巢癌细胞的紫杉醇敏感性[7]。研究表明,NF-κB信号通路的激活参与多种化疗药物如紫杉醇、长春新碱、多柔比星等耐药过程[8]。据报道,miR-141的下调通过激活前列腺癌中的NF-κB信号传导促进骨转移[9],提示miR-141可能介导NF-κB信号通路的激活发挥功能。本实验探讨miR-141是否介导NF-κB信号通路影响卵巢癌细胞紫杉醇敏感性,以期为卵巢癌的紫杉醇耐药性机制研究提供实验依据。
1 材料与方法
1.1 材料 人卵巢癌细胞株SKOV3(中国科学院上海生命科学学院细胞库);紫杉醇注射液(北京康平源医药有限公司);PRIM-1640培养基、胎牛血清(美国Gibco公司);胰蛋白酶(杭州四季青生物工程材料有限公司);MTT(美国Sigma公司);FITC-AnnexinⅤ/PI细胞凋亡检测试剂盒(日本TaKaRa公司);miR-141抑制物及无关序列(上海吉玛制药技术有限公司);Lipofectamine 2000(美国Invitogen公司);NF-κB信号通路特异性抑制剂QNZ(美国Selleck Chemicals公司);RNA提取试剂盒、反转录试剂盒、荧光定量PCR检测试剂盒(北京康为世纪生物科技有限公司);BCA蛋白浓度检测试剂盒(碧云天生物技术研究所);p-P65抗体、p-IκBα抗体、P65抗体、IκBα抗体及二抗(美国CST公司);PVDF膜(美国Abcam公司);ECL化学发光检测试剂(美国Thermo Fisher公司)。
1.2 细胞培养和分组 人卵巢癌细胞SKOV3培养于含10%胎牛血清的PRIM-1640培养基中,放置在5%CO2、37℃培养箱内,每天观察细胞生长状态,待细胞贴壁生长汇合度达>80%时,以胰蛋白酶消化传代,取处于对数生长期的SKOV3接种于6孔板中,分别将0、10、50、100、500、1 000 ng/ml紫杉醇注射液添加到细胞培养板中,置37℃培养箱继续培养48 h,进行转染实验。实验分为,anti-miR-141组细胞转染miR-141抑制物,NC组细胞转染无关序列,Blank组细胞不做转染处理。转染操作参照Lipofectamine 2000转染试剂说明书进行,转染后继续培养48 h,收集各组细胞。
1.3 荧光定量PCR检测各组卵巢癌SKOV3细胞中miR-141的表达水平 分别收集转染48 h后Blank组、NC组和anti-miR-141组SKOV3细胞,采用RNA提取试剂盒提取细胞中总RNA,使用反转录试剂盒合成cDNA,以实时荧光定量PCR试剂盒进行PCR扩增,扩增条件为:95℃预变性5 min,95℃变性10 s,60℃退火30 s,72℃延伸20 s,共40个循环。分析溶解曲线和熔炼曲线,得出Ct值,采用2-ΔΔCt法计算各组SKOV3细胞中miR-141相对表达水平。
1.4 MTT实验检测各组卵巢癌SKOV3细胞增殖能力 分别将Blank组、NC组和anti-miR-141组SKOV3细胞接种于96孔板中,继续培养,待细胞汇合度达80%时,在每孔细胞中添加浓度为5 mg/ml的MTT溶液20 μl,继续培养4 h,取出细胞培养板,再在每孔细胞中加入二甲基亚砜150 μl,于震荡仪上振荡10 min,在酶标仪上,选择570 nm波长测定每孔细胞OD值,实验重复3次,计算各组细胞增殖抑制率,细胞增殖抑制率=(1-试验组OD值/对照组OD值)×100%。
1.5 流式细胞仪检测吗啡对细胞凋亡的影响 收集上述各组SKOV3细胞,以预冷的PBS洗涤细胞2次,离心,收集约1×106个细胞,以结合缓冲液100 μl重悬细胞,加入5 μl FITC-AnnexinⅤ混匀,再加入5 μl PI染液混匀,室温下避光反应30 min,使用流式细胞仪检测,统计各组细胞凋亡率。
1.6 Western blot检测各组SKOV3细胞中蛋白表达水平 选择100 ng/ml的紫杉醇干预Blank组、NC组和anti-miR-141组SKOV3细胞,同时使用NF-κB信号通路特异性抑制剂QNZ干预anti-miR-141组SKOV3细胞,分别加入蛋白裂解液提取各组细胞中总蛋白。BCA法测定蛋白浓度,取等量蛋白样品上样,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳结束后将凝胶上的蛋白转移至PVDF膜上,封闭1 h后,加入一抗4℃杂交过夜,p-P65一抗1∶500稀释,p-IκBα一抗1∶500稀释,P65一抗1∶800稀释,IκBα一抗1∶800稀释,PBST洗涤3次后,加入1∶3 000稀释的二抗室温杂交2 h。PBST洗涤3次后,采用ECL化学发光,以β-actin为内参,采用Image J软件对各条带灰度值进行分析,计算目的蛋白相对表达水平。
1.7 NF-κB信号通路抑制剂对SKOV3细胞对紫杉醇敏的感性的影响 选择100 ng/ml的紫杉醇和NF-κB信号通路特异性抑制剂QNZ同时干预anti-miR-141组SKOV3细胞,MTT法检测SKOV3细胞增殖抑制率,方法同1.4。流式细胞仪检测SKOV3细胞凋亡率,方法同1.5。
1.8 统计学分析 应用SPSS 21.0统计软件,2组间差异比较采用t检验,多组间差异比较采用单因素方差分析,2组差异比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 在SKOV3细胞中转染miR-141抑制物对miR-141表达水平的影响 将miR-141抑制物转染至人卵巢癌SKOV3细胞中,与Blank组和NC组比较,anti-miR-141组SKOV3细胞中miR-141表达水平明显降低,差异有统计学意义(P<0.05)。Blank组与NC组比较,miR-141表达水平差异无统计学意义(P>0.05)。表明在卵巢癌SKOV3中转染miR-141抑制物能够抑制miR-141的表达。见表1。

表1 转染48 h 后qRT-PCR 检测3 组SKOV3细胞中miR-141 表达水平
2.2 抑制SKOV3细胞中miR-141的表达对细胞增殖能力的影响 MTT实验检测3组细胞增殖抑制率,结果显示,与Blank组和NC组比较,anti-miR-141组细胞增殖抑制率明显升高,差异有统计学意义(P<0.05)。Blank组与NC组比较增殖抑制率改变差异无统计学意义(P>0.05)。Blank组、NC组和anti-miR-141组细胞半数抑制浓度分为为169.84 ng/ml、186.21 ng/ml和69.42 ng/ml,anti-miR-141组细胞半数抑制浓度显著低于Blank组和NC组,差异有统计学意义(P<0.05)。说明抑制miR-141的表达能够增加SKOV3细胞对紫杉醇的敏感性。见表2。
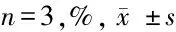
表2 不同浓度紫杉醇处理对3 组SKOV3 细胞增殖抑制率影响
2.3 NF-κB信号通路抑制剂对NF-κB信号通路激活的影响 在转染的同时使用NF-κB信号通路特异性抑制剂QNZ处理anti-miR-141组细胞,Western blot检测3组SKOV3细胞中NF-κB信号通路相关因子的表达水平,与Blank组和NC组比较,anti-miR-141组细胞中p-P65和p-IκBα蛋白表达水平显著下调,差异有统计学意义(P<0.05),与anti-miR-141组比较,anti-miR-141+QNZ细胞中p-P65和p-IκBα蛋白表达水平显著降低,差异有统计学意义(P<0.05),Blank组与NC组比,p-P65和p-IκBα蛋白表达水平变化,差异无统计学意义(P>0.05)。4组细胞中总蛋白P65和IκBα表达水平不变,差异无统计学意义(P>0.05)。提示抑制miR-141的表达能够下调p-P65和p-IκBα蛋白表达,抑制NF-κB信号通路的活化。NF-κB信号通路特异性抑制剂QNZ能够进一步阻断NF-κB信号通路的激活。见图1,表3。

图1 Western blot检测3组细胞中p-P65、P65、p-IκBα和IκBα蛋白水平

表3 3 组卵巢癌SKOV3 细胞中p-P65 、P65 、p-IκBα 和IκBα 蛋白水平比较
2.4 抑制miR-141的表达促进紫杉醇诱导的SKOV3细胞凋亡 使用终浓度为100 ng/ml的紫杉醇分别处理3组细胞,流式细胞仪检测3组细胞凋亡率,与Blank组和NC组比较,anti-miR-141组细胞凋亡率显著升高,差异有统计学意义(P<0.05)。Blank组与NC组比较,凋亡率差异无统计学意义(P>0.05)。提示抑制miR-141的表达能够促进紫杉醇诱导的SKOV3细胞凋亡。见图2,表4。

图2 流式细胞仪检测3组细胞凋亡率
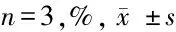
表4 3 组卵巢癌SKOV3 细胞凋亡率比较
2.5 NF-κB信号通路抑制剂增强SKOV3细胞对紫杉醇敏的感性 使用NF-κB信号通路特异性抑制剂QNZ阻断NF-κB信号通路后,MTT实验和流式细胞仪检测细胞增殖抑制率及凋亡率,与anti-miR-141组比较,anti-miR-141+QNZ组细胞增殖抑制率显著升高(t=6.060,P<0.05),凋亡率增加(t=5.221,P<0.05)。提示QNZ进一步增强了SKOV3细胞对紫杉醇敏的感性,说明miR-141介导NF-κB信号通路影响SKOV3细胞对紫杉醇敏的感性。见图3,表5。

图3 流式细胞仪检测各组SKOV3细胞凋亡率

表5 3 组卵巢癌SKOV3 细胞增殖抑制率和凋亡率比较
3 讨论
乳腺癌是全球女性癌症相关死亡的主要原因,其发病率呈逐年上升的趋势[10]。手术联合化疗是目前治疗乳腺癌的主要方式,紫杉醇是最常用的治疗卵巢癌的化疗药物之一,然而阻碍乳腺癌治疗的主要障碍是耐药的产生。因此,通过增强化疗药物敏感性是改善乳腺癌患者治疗效果的重要途径。miRNA是约22个核苷酸的内源性非编码RNA,人类原发性癌症中miRNA的表达改变已被用于肿瘤诊断、分类、分期和预后[11,12]。此外,miRNA控制细胞生长、增殖、代谢和凋亡,目前研究显示miRNA在各种类型癌症中的耐药性中具有重要作用。据报道,miR-141是一种广泛研究的人类miRNA,与多种癌症中的癌症进展和转移相关[13,14],最近有证据表明miR-141也与癌症中的耐药性相关。Imanaka等[15]强调了miR-141在食管鳞状细胞癌顺铂耐药发展中的重要调节作用。此外,miR-141介导的KEAP1调节在卵巢癌细胞对顺铂的细胞反应中起关键作用[16]。此外,下调的miR-141参与胃癌中幽门螺杆菌调节的顺铂敏感性[17]。尽管已经对miR-141进行了深入研究,但关于miR-141在乳腺癌中紫杉醇敏感性机制研究仍较匮乏。在本研究中,通过在人卵巢癌SKOV3细胞中转染miR-141抑制物,抑制miR-141的表达,通过MTT实验检测发现,抑制miR-141的表达能够显著抑制细胞增殖,诱导细胞凋亡,增强SKOV3细胞对紫杉醇的敏感性。
虽然有几项研究确定了miR-141在化疗耐药中的作用,但miR-141诱导的化疗耐药的潜在机制目前尚不清楚。大多数miRNA通过抑制靶基因的有效mRNA翻译起作用,其可能参与癌症和化疗抗性的进展[18,19]。先前的研究表明,可以通过KEAP1调节的NF-κB途径在miR-141过表达后被激活,并且该途径的抑制部分逆转了miR-141介导的卵巢癌顺铂耐药性[18]。越来越多的证据表明NF-κB信号通路与癌症的化疗抗性相关。目前已经证明紫杉醇诱导组成型NF-κB活化并导致人癌细胞的化学抗性[20]。药物或其他因子通过抑制NF-κB信号通路的激活增强卵巢癌细胞对紫杉醇的敏感性[21]。本实验中抑制miR-141的表达后,SKOV3细胞中NF-κB信号通路相关因子p-P65和p-IκBα蛋白水平显著降低,提示NF-κB信号通路活化受到抑制。提示抑制miR-141的表达可能通过抑制NF-κB信号通路的激活增强SKOV3细胞对紫杉醇的敏感性。为验证该推测,本实验在抑制miR-141的表达的SKOV3细胞同时以NF-κB信号通路特异性抑制剂QNZ处理,结果发现,QNZ能够增强下调miR-141诱导的细胞增殖抑制,促进下调miR-141诱导的细胞凋亡,增强了SKOV3细胞对紫杉醇的敏感性。以上实验结果表明,miR-141介导NF-κB信号通路影响卵巢癌SKOV3细胞对紫杉醇的敏感性。
综上,本实验验证了下调miR-141的表达能够增强人卵巢癌SKOV3细胞对紫杉醇的敏感性,其作用机制可能涉及NF-κB信号通路的活化,提示miR-141可能作为卵巢癌患者对紫杉醇耐药性治疗的潜在靶点,为进一步体内及临床研究提供实验基础。

