基于流感病毒血凝素的通用疫苗研究进展
孟 薇,张 蕾,黄金海
(天津大学生命科学学院,天津 300072)
流行性感冒是由流感病毒感染引起的一种急性呼吸道传染性疾病,严重危害人类和动物健康[1]。疫苗接种是预防和控制流感病毒感染的最有效且经济的措施[2]。世界卫生组织流感中心每年都会针对流感病毒的流行状况预测下一年的流行毒株,将其作为疫苗候选毒株。抗原漂移是流感疫苗需要每年更新的主要原因[3],对疫苗的开发和疾病的防控形成重大挑战。目前,使用的季节性流感疫苗只对与疫苗毒株相同或高度相似的流感病毒毒株具有预防和保护效力[4],当流行毒株与疫苗毒株不匹配时,季节性流感疫苗无法预防不同亚型流感病毒引起的流感,导致发病率和死亡率显著增加,严重时甚至发生流感大流行。因此,迫切需要研发一种广谱的可抵御不同亚型的流感病毒通用疫苗,该疫苗可对不同流感病毒毒株和亚型提供广泛的保护,解决流感病毒的快速传播。本研究简要介绍目前存在的通用疫苗的分类并基于血凝素HA的通用疫苗研究进展,以期为这方面研究提供参考。
1 血凝素的结构与功能
血凝素(Hemagglutinin,HA)蛋白是甲型流感病毒的主要囊膜表面的主要糖蛋白,也是目前研究最深入的流感病毒相关蛋白,可与红细胞受体结合导致红细胞凝集,具有免疫原性,与宿主细胞表面的受体的特异性结合有关,在流感病毒入侵感染过程中发挥着关键作用。HA蛋白是1个以三聚体形式存在于类脂膜上的蛋白,在结构上含有信号肽、跨膜区、胞浆区和胞外域4个结构域[5,6]。3个HA单体(HA0)以非共价键的形式结合成为同源三聚体,存在于病毒包膜上面。HA单体可被蛋白酶裂解成为HA1和HA2两条链,HA1和HA2以二硫键相连。每个HA单体由球状头部区域和杆状茎部区域两部分组成。球状头部由HA1组成,含有抗原决定簇和受体结合位点(Receptor binding site,RBS),并在分子表面暴露,呈口袋状,是流感病毒感染复制的一种必需蛋白,是中和抗体的结合靶点[7]。因此,HA头部是用于疫苗研制的重要靶抗原。HA蛋白茎部由HA2和部分HA1残基组成,HA2亚基N端有一段高度疏水的区域,相对保守,与病毒囊膜相连,由α螺旋通过疏水作用稳定三聚体的结构[8]。
HA蛋白在与宿主细胞表面受体结合、膜融合、病毒颗粒包装结合和病毒粒子致病性等多方面都发挥着重要作用[9]。在病毒感染过程中,HA蛋白前体HA0成熟组装成三聚体,运输到宿主细胞表面,在宿主蛋白酶的作用下,裂解生成HA1和HA2 2个亚单位[10,11]。HA1蛋白通过与宿主细胞表面的糖蛋白结合,使病毒颗粒附着在宿主细胞表面,再通过内吞途径进入细胞[12];HA2蛋白N端的疏水性区域肽链暴露,在内吞泡呈酸性环境的条件下发生构象重排,从而病毒包膜与内吞泡膜融合,并释放病毒核糖核蛋白复合物到细胞质中[13-15]。在受体亲和力方面,不同亚型的HA蛋白对不同宿主细胞表面受体具有的亲和力不同,影响不同的宿主。该蛋白可以特异性地识别N-乙酰基唾液酸化的唾液酸寡糖,并以α-2,6糖苷键形式或α-2,3糖苷键形式结合宿主细胞表面的唾液酸受体,从而启动流感病毒感染过程[16]。研究发现,禽流感病毒主要通过α-2,3糖苷键形式与唾液酸受体结合,而人呼吸道上皮细胞表面的唾液酸主要以α-2,6糖苷键相连[17]。猪的呼吸道上皮细胞既分布了α-2,6唾液酸受体,又分布着部分α-2,3唾液酸受体,这说明猪能同时感染禽流感和人流感,病毒较易发生跨种传播[18]。在致病性方面,HA分子的切割位点处连续存在的碱性氨基酸是判断流感病毒致病性的一个重要分子标志,HA1蛋白部分氨基酸突变会对流感病毒的致病性产生较大影响[19,20]。
血凝素蛋白作为流感病毒的一个主要保护性抗原,能够通过刺激机体诱导产生相应的中和性抗体来达到中和病毒感染的目的[21]。HA头部含有大量的抗原表位区域,茎部的保守区域含有几种广泛中和抗体的靶点,两者具有广谱中和多种甲型流感病毒亚型的能力。因此,甲型流感病毒HA蛋白头部区域抗原表位和茎部区域抗原表位是研究抗体中和病毒感染机制、疫苗开发的非常重要且有吸引力的靶点。
2 通用流感疫苗分类
目前,预防甲型流感病毒的主要手段就是接种疫苗,其中接种灭活疫苗和亚单位疫苗仍是抵抗季节性流感病毒最有效的2种方式。由于流感病毒抗原变异速度较快,上一年的疫苗通常不能对这一年的流感病毒起到保护作用,接种者不能在新一年获得对当年新型流感病毒的抵抗力,因此,科学家们在努力开发一种通用流感疫苗,即一种能够预防大部分甚至所有亚型流感病毒毒株,保护机体免受病毒感染的疫苗。目前,通用流感疫苗的研究工作旨在诱导对流感病毒表面蛋白或内部蛋白高度保守区域的广泛保护性免疫,主要靶向为流感病毒表面糖蛋白HA和NA、基质蛋白M2及T细胞免疫等[22]。
2.1 基于NA蛋白的通用流感疫苗
NA蛋白是甲型流感病毒的另一个主要表面糖蛋白,与病毒粒子的释放密切相关。抗NA的抗体虽然不具有病毒中和作用,但可以抑制NA的活性,降低病毒滴度,是研究新型流感疫苗的一个重要靶点[23]。为了评估流感病毒NA作为疫苗抗原的交叉保护潜力,Kim等[24]制备N1-VLP疫苗免疫小鼠后检测到NA抑制活性,再用H1N1、H5N1和H3N2 3种毒株攻击小鼠,表明N1-NLP疫苗具有保护小鼠免受流感病毒感染的潜力。在乙型流感病毒NA免疫试验中也发现了该现象,且当受到维多利亚系乙型流感病毒的致死性攻击时,该疫苗可保护小鼠免于发病和死亡[25]。
2.2 基于M2蛋白的通用流感疫苗
流感病毒基质蛋白M2通过其离子通道活性调节pH,在内吞过程中促进基质蛋白M1从核糖核蛋白复合物中解离[26,27]。早期通用流感疫苗的研究主要针对高度保守的流感病毒基质蛋白M2的胞外域M2e[28-31]。目前,研究已经证明小鼠血清中的特异性M2e抗体可以保护BALB/c小鼠抵抗同种类型的流感病毒的攻击[32-34]。与未免疫组相比,免疫了M2e的小鼠在流感病毒攻击后存活率提高约60%[35],并激活了特异性T细胞免疫[36,37]。同时,在异源亚型流感病毒的攻击后,M2e-VLP疫苗通过降低机体肺部病毒滴度和降低小鼠体重减轻程度来达到显著交叉保护作用[38,39]。因此,基于M2e蛋白的疫苗研究也是一种新型流感通用疫苗研究策略。
2.3 基于T细胞免疫的通用流感疫苗
机体对流感病毒的免疫反应是由先天性免疫和适应性免疫共同控制的。先天性免疫限制最初的病毒复制,是非特异性的;只有强大的适应性免疫才能有效清除流感病毒,激活体液免疫和细胞免疫。常规的流感疫苗旨在诱导对流感病毒的体液免疫,由于病毒抗原变异的发生,这些疫苗并不完全具有保护作用。科学家们近几年发现T细胞反应可能在预防流感病毒感染中具有关键作用[40-45],CD8+细胞和细胞毒性T淋巴细胞(CTL)可介导病毒清除并且已显示出对不同亚型流感病毒具有交叉反应性免疫作用[46-49]。目前,研究人员正在探索主要刺激流感特异性T细胞免疫的疫苗[50,51],作为提高流感疫苗效力和开发通用流感疫苗的一种途径,大部分疫苗选择靶向保守的流感病毒内部蛋白或其他高度保守的可刺激T细胞介导的免疫反应的抗原决定簇。Valkenburg等[52]研究发现,表达了H5N1亚型流感病毒的HA、NA、M1、M2和NP蛋白的T细胞表位肽的重组疫苗免疫小鼠后,该疫苗可保护小鼠抵抗来自同源或异源流感病毒的攻击。将流感特异性CD4+T细胞耗竭后再进行疫苗接种,病毒攻击后小鼠的存活率降低,说明该疫苗介导的保护作用依赖于流感特异性CD4+T细胞。这些发现对开发和优化T细胞活化疫苗具有重要意义。
3 靶向流感病毒HA的通用疫苗的研究进展
除了上述介绍的几种靶点通用疫苗,目前深入的广谱疫苗主要是基于甲型流感病毒血凝素HA的通用疫苗,可分为无头HA疫苗、嵌合疫苗、计算优化抗原(COBRA)疫苗、病毒样颗粒(VLP)疫苗和马赛克疫苗等[53,54],如图1所示。
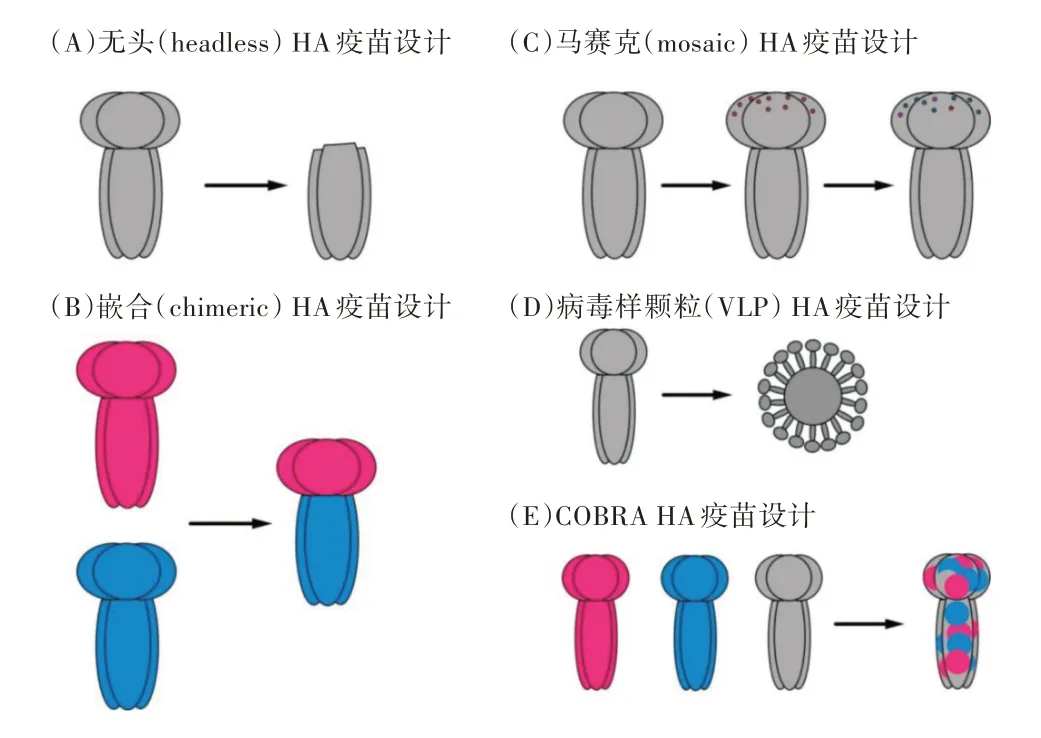
图1 基于血凝素HA的通用流感疫苗研究分类
3.1 基于无头HA的通用疫苗的研究进展
由于HA头部易发生突变造成抗原漂移,而茎部的结构和序列在不同亚型间高度保守,可以产生广泛的免疫反应[55],能够克服抗原漂移,因此研究人员尝试去掉流感病毒HA蛋白的头部,将HA蛋白的茎部作为通用疫苗的候选区域。Sagawa等[56]用分别过表达无头(Headless)HA和全长HA的细胞免疫小鼠,用甲型H1N1流感病毒攻击后,Headless HA组免疫的小鼠的存活率大于对照组,即说明HA茎部有一定的免疫抗性。John等[57]将流感病毒HA茎部的保守性区域制备疫苗免疫小鼠并设计攻毒试验,发现尽管HA茎部构象不完整,不能产生中和抗体,但靶向HA茎部的抗体能够阻止HA蛋白水解,抑制病毒与细胞膜融合,延长小鼠生存时间,从而加快机体清除病毒能力,保护小鼠免受甲型H1N1、H5N1和H6N1病毒的致死性攻击,且当小鼠存在预存免疫力时,观察到的保护作用增强。张立霞等[58]利用Bac-to-Bac杆状病毒表达系统,将Headless HA转染昆虫细胞,发现HA能够表达但不能使红细胞发生凝集。Park等[59]评估了受试志愿者在病毒攻击前后体内的抗HA茎部抗体的滴度及其对机体的保护作用,表明抗HA茎部抗体在人类流感疫苗研发过程中可作为新型疫苗起作用。
3.2 基于HA的嵌合疫苗的研究进展
3.2.1 嵌合HA疫苗 制备嵌合HA疫苗是另一种提高HA茎部区域抗原性的方法,即表达了一种亚型流感病毒的HA头部区域和另一种亚型流感病毒HA的头部或茎部区域制备的疫苗[60-62],能够诱导产生针对季节性流感的广泛性抗体[63,64]。早期的HA嵌合疫苗是将编码2种亚型流感病毒的HA1克隆至同一载体上制备的DNA嵌合疫苗。王芙艳[65]将编码A、B两种亚型流感病毒HA1基因构建到表达载体pCAGGSP7上并免疫小鼠,发现该嵌合HA疫苗可同时产生针对2种亚型的特异性抗体,并可保护小鼠抵抗流感病毒的致死性攻击,提供交叉保护作用。Krammer等[45]将表达了H9亚型HA蛋白头部序列和H1亚型HA蛋白茎部序列的嵌合疫苗免疫小鼠,发现小鼠体内能够产生针对HA茎部的广谱中和抗体,且对同组类型流感病毒毒株的攻击起到保护作用。Nachbagauer等[66]还将表达了H8亚型HA头部序列、H1亚型HA茎部序列和N1亚型的NA序列的质粒制备的嵌合疫苗免疫雪貂,同时免疫2种季节性流感疫苗作为对照,也发现了相比于季节性流感疫苗,嵌合疫苗提供的交叉保护作用更强。嵌合疫苗是新型流感疫苗研发的流行趋势之一,优势之处在于嵌合疫苗可应对最新一年的流感毒株,在疫苗制备过程中只需将最新一年的流感病毒HA头部替换以往的有效嵌合疫苗中的HA部分,即可制备交叉保护性较高的广谱性疫苗;除了HA头茎部嵌合疫苗外,还可以将流感病毒HA与其他致病性毒株的主要保护性抗原结合起来,起到预防2种病原体感染的作用。
3.2.2 马赛克HA疫苗 马赛克疫苗是在嵌合疫苗基础上扩展的疫苗,是广谱疫苗研究的热点之一[67]。该疫苗设计依托于HIV马赛克疫苗设计原理[68],即将流感多种抗原(基因片段)组合在一起,形成对机体免疫系统有较强刺激作用并能生成有效抗体的疫苗。2014年Kamlangdee等[69]首次将2 145株H5N1流感病毒毒株分离并分析抗原表位后制得马赛克疫苗,该疫苗不仅可保护小鼠抵抗H5亚型流感病毒致死性攻击,还可抵抗季节性流感H1N1的攻击,起到了广泛的交叉保护作用。Broecker等[70]研究发现,马赛克疫苗免疫小鼠和雪貂后,机体可以产生头部特异性抗体,且产生的抗体水平要大于季节性流感疫苗免疫后产生的抗体水平,能够诱导出更高的HI滴度。Kanekiyo等[71]将来自多种菌株蛋白的受体结合区域RBD展示在纳米粒子表面制备马赛克疫苗,与不同亚型单个菌株RBD展示纳米粒子制备的嵌合疫苗混合物相比,马赛克疫苗产生的中和性抗体更多,且抗体反应更广泛。基于HA的马赛克疫苗研究为流感通用疫苗的研究提供了新的思路和方法,虽然目前研究成果与真正意义上的、有效的临床应用疫苗相距甚远,但具有重要的参考意义和应用价值。
3.3 基于HA的VLP疫苗的研究进展
重组流感病毒样颗粒(VLP)指由多个病毒结构蛋白组成但不包含病毒基因组,可通过外源表达并纯化的非传染性病毒颗粒,具有免疫原性和生物学活性,目前已被证明可刺激机体产生强烈免疫反应并诱导产生针对不同种流感病毒的保护性抗体[72]。Galarza等[73]分析了1918年大流行流感病毒毒株VLPs的组成和三维结构,发现HA分子茎部区域均匀地分布在VLP表面,HA构象处于预融合状态,可以产生靶向HA茎部的特异性抗体。血凝试验显示共表达HA、NA、M1、M2这4种蛋白的病毒样颗粒具有凝集鸡红细胞的活性,且制备的VLPs免疫小鼠产生的抗体能保护小鼠免受致死性流感病毒的攻击[74],即说明VLP疫苗具有抗原保护作用,是一种新兴疫苗研发策略。除此之外,H1亚型、H3亚型、H5亚型和H7亚型流感病毒HA蛋白制备的VLPs免疫小鼠后,也可保护小鼠机体免受来自同源或H2、H6、H10和H11等异种亚型流感病毒毒株的致死性攻击[75],说明该VLP疫苗还具有交叉保护作用。在2009年墨西哥流感爆发前提下的健康人类试验中,还发现了VLP疫苗可在较短时间内刺激机体产生特异性抗体,两剂便具有高血清保护率[76],由于其高的安全性和免疫原性,基于HA的VLP疫苗的研究为通用流感疫苗的开发提供了一种新的可能。
3.4 基于HA的COBRA疫苗的研究进展
COBRA疫苗即通过计算方式优化的HA多肽疫苗,通过一系列的HA蛋白比对和随后共有序列的产生来研发优化的HA多肽,可以引起针对流感病毒的广泛反应性免疫应答[77,78]。研究人员分析了2004—2006年Clade 2分支H5N1流感病毒所有HA蛋白序列并筛选出最保守的氨基酸位点并合成COBRA HA序列,制备的COBRA-VLP疫苗免疫小鼠和雪貂后发现血清中具有较高的HI抗体滴度[79],且与单个亚型的HA VLP混合物疫苗相比,COBRA疫苗可保护小鼠和雪貂免受同组不同亚型流感病毒的致死性攻击[80]。在非人灵长类动物模型食蟹猴中也观察到该现象,同时还可保护机体,降低炎症反应的发生[81]。此外,研究发现在COBRA疫苗中添加油乳剂可提高疫苗产生抗体反应的强度和广度,更大范围地产生特异性抗体[80]。同时,由于COBRA疫苗在研发制备过程中分析了蛋白序列,研究人员可以得到相同亚型不同源或不同年份的流感病毒HA的主要的糖基化位点变化,可通过改变糖基化位点提高其诱导机体产生的中和能力[82],还可以扩大交叉保护作用[83]。
4 流感病毒通用疫苗开发存在的挑战
目前,甲型流感病毒大流行前预保护疫苗的研发仍存在如目标流感毒株是否正确、预测及免疫接种程序仍需优化等诸多挑战。同时,研究发现,先前存在的免疫对流感病毒感染和疫苗接种的抗体反应有很大影响,预先存在的免疫也会降低LAIV的复制[84],对评估新型疫苗在人群中是否提供广泛的且持久性保护作用有干扰。同时,改变免疫途径和优化免疫程序也对制备出具有诱导广泛保护性免疫的通用流感疫苗有重大意义[85,86]。
5 小结及展望
动物模型与人体临床模型都证明基于血凝素HA的流感通用疫苗具有良好的免疫原性和交叉保护性,是通用流感病毒候选疫苗侧重的表位之一。对基于HA的通用流感疫苗的生产及改进和广泛性中和抗体的开发及制备有助于预防流感病毒感染并有机会在将来省去流感疫苗的季节性修订。但是开发具有广泛保护作用的流感通用疫苗尚未实现,仍需要人们密切监测流感毒株,分析生物学特性,改进疫苗接种方法,最终制备高效、安全的通用流感疫苗。

