增温与施氮对薄荷幼苗生长及生理特性的影响
熊露露,邓小红,王健健
(贵州大学 生命科学学院/农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,山地生态与农业生物工程协同创新中心,贵州贵阳 550025)
工业革命以来,全球气候变暖与大气氮沉降愈演愈烈。第五次气候变化评估报告表明,预计到21世纪末,全球地表平均增温0.3℃~4.8℃[1]。温度是影响植物生长发育的重要生态因子,一般而言,适当增温能延长植物的生长季,将有利于植物生长速率的提高以及生物量的积累[2]。同时温度变化会改变酶的活性,对植物产生直接或间接影响,使其生长速率和光合作用发生变化,继而改变植物的生物量和各生理指标。杨春勐[3]等研究发现,增温加剧了植物膜脂过氧化程度,导致过氧化物酶活性降低,丙二醛大量积累,植物生长受到抑制。氮素是植物生长发育所必需的重要矿质营养元素。在全球氮沉降不断增加的情况下,氮沉降可能会对植物的形态和生理特征产生显著影响。已有研究证实,适量的大气氮沉降能促进植物生长,提高光合作用,使植物生物量及可溶性糖含量大量积累[4]。目前,国内外研究多侧重于增温、氮沉降等单因素对主要粮食作物如小麦、水稻等[5-6]的影响等研究,而关于增温与氮沉降交互作用对药用经济作物的生长和生理影响鲜见报道。
薄荷(MenthahaplocalyxBriq.)为唇形科(Lamiaceae)多年生草本植物,因其对生态环境的适应能力较强,我国南北各省均有分布。作为重要的植物资源之一,薄荷具宣散风热、清头目、透疹等药用功效,由其提取的薄荷精油更是因性味凉、香气鲜而被广泛应用于食品、香料等领域,极具开发推广价值[7]。近年来,关于薄荷的研究主要集中在化学成分、药理作用等功能性研发方面[8-9],在全球气候变化背景下对其生长及生理变化的影响关注较少,主要多集中于干旱、光照、密度因子等[10-11],对增温和施氮,尤其是二者互作对薄荷的影响尚未见报道。本研究设置对照、施氮、增温与温氮处理,模拟全球变暖与大气氮沉降加剧对薄荷形态、生物量及生理指标的影响,为薄荷种植管理提供理论基础与科学依据。
1 材料和方法
1.1 材料
供试薄荷采自贵阳花溪薄荷种植基地,为当地野生薄荷驯化栽培品种。2019年3月10日选择长势良好、大小相似的薄荷幼苗,置于塑料花盆(22 cm×22 cm),每盆 1 株,共60盆。盆栽试验所用土壤采集自贵阳市花溪区薄荷种植地的表层熟土(pH 7.9),待风干后过2 mm筛,与珍珠岩按1: 1充分混匀装盆,将薄荷移栽后放置于贵州大学生命科学学院实验基地进行缓苗。试验采用智能人工气候箱(RXZ-CO2系列,宁波江南仪器厂)进行控温,所施氮肥为脲(即尿素,总氮≥46.4%,天津市科密欧化学试剂有限公司)。
1.2 试验设计
试验设置对照(即不增温不施氮,记为CK)、施氮(只施氮不增温,记为N)、增温(只增温不施氮,记为W)、增温施氮(既增温又施氮,简称温氮,记为WN)4个处理,每个处理12盆薄荷,共计48盆。试验中设定的对照温度为贵阳市30年(1985~2015)4、5、6月的月平均温度,分别为:17℃、19℃、22℃,数据源于中国气象局[12]。模拟全球变暖的增温处理为在对照月平均温度基础上增温4℃[13],即:21℃、23℃、26℃。模拟大气氮沉降的氮素添加量为20g·N·m-2·yr-1[14],换算为施氮频率每7天1次,每次0.1g每盆。试验所需水分均采用当地自来水浇灌,每周浇水3次,保证土壤水分充足,进行统一标准管理。试验于2019年4月1日开始,7月1日结束。
1.3 测定项目及方法
1.3.1 生长指标
试验结束时,每个处理随机选取5株健康薄荷植株,用直尺测量其叶长、叶宽及根长,使用游标卡尺测量叶厚,并统计叶片数。其中测定叶片以叶片着生位置、叶片展开程度、叶片健康状况来取样。挖出薄荷整株,洗净泥土,分别将根、茎、叶装入不同信封,置于70℃烘干箱中烘干至恒量,称量各部分生物量并计算根生物量比(根生物量/总生物量)、茎生物量比(茎生物量/总生物量)、叶生物量比(叶生物量/总生物量)、根冠比(根生物量/(茎+叶生物量))。
1.3.2 生理生化指标
每个处理随机选取5株健康薄荷植株,每株选成熟叶片3片,摘取后迅速放至冰盒内,称取新鲜材料0.1 g进行生理生化指标的测定。SOD活性测定采用氮蓝四唑比色法[15],POD活性测定采用愈创木酚法[16],丙二醛含量测定采用硫代巴比妥酸反应比色法[17],可溶性糖含量采用蒽酮法[18]测定,5组重复。
1.3.3 统计分析
试验数据采用SPSS 22.0统计分析软件,运用单因素、双因素方差分析(ANOVA),结合Excel 2010绘图,图表中数据为平均值±标准差。
2 结果与分析
2.1 增温与施氮对薄荷生长指标的影响
增温与施氮对薄荷生长指标的影响见表1。由表1可知,薄荷各生长指标表现为N>CK,其中N对薄荷幼苗根长的促进作用显著(P<0.05),与CK相比增加440%。W处理降低薄荷叶长、叶宽、叶厚三者数值,分别降低 11.76%、 31.58%、 30%。WN处理下薄荷的叶宽降低10.53%,叶片数增加128%,而叶厚则与CK无显著差异(P>0.05)。
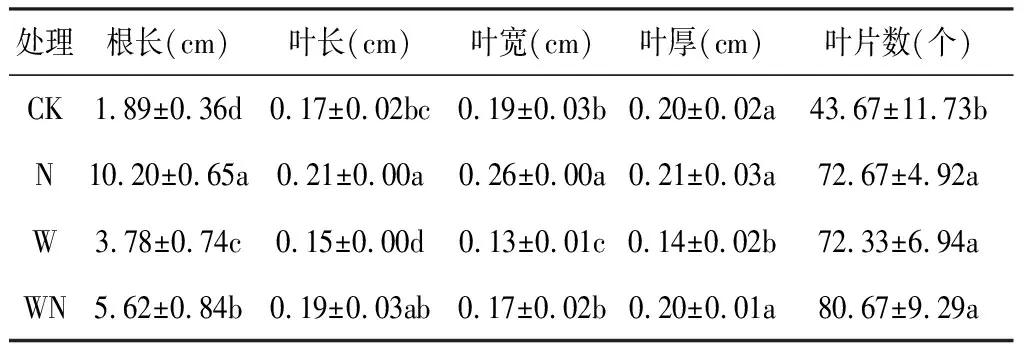
表1 增温与施氮对薄荷幼苗生长指标的影响Table 1 The growth index of M. haplocalyx seedlings under warming and Nitrogen application
2.2 增温与施氮对薄荷生物量积累及分配的影响
由表2可知,各处理中WN对薄荷根、茎、叶生物量影响最显著(P<0.05),使总生物量较CK增加了216%。W和WN处理增加薄荷各部分生物量及总生物量,其中N处理更有利于薄荷地上生物量积累,较CK增加178%,其根生物量呈上升趋势,但差异不显著(P>0.05),根冠比较CK降低22.22%。W处理对薄荷地下生物量积累更有利,较CK增加83.33%,根冠比增加33.33%。
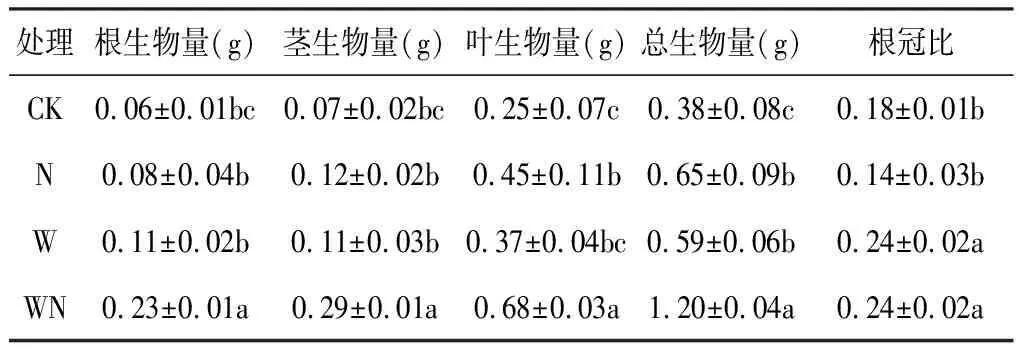
表2 增温与施氮对薄荷幼苗生物量积累及分配的影响Table 2 Biomass accumulation and allocation of M. haplocalyx seedling under warming and nitrogen application
2.3 增温与施氮对抗氧化酶POD、SOD活性的影响
由图1可知,较CK而言,在W、WN处理下,薄荷POD活性显著上升(P<0.05),增幅分别为86.29%、107%;而N处理下POD活性显著下降(P<0.05),降幅达到了36.31%。薄荷SOD活性则表现为WN>WN>CK>N,其中W、WN对SOD活性起促进作用,较CK相比分别增加了26.15%和14.18%。N对薄荷SOD活性则起抑制作用,较CK相比降幅达到了13.18%。
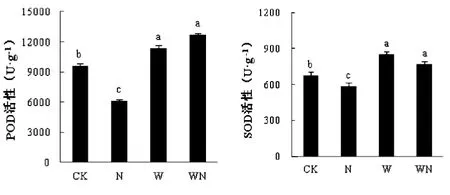
图1 增温与施氮对POD、SOD活性的影响Fig.1 Effects of POD and SOD activities in M. haplocalyx seedling under warming and nitrogen application注:不同小写字母表示在处理间存在显著差异(P<0.05),下同。
2.4 增温与施氮对薄荷MDA含量的影响
各处理对薄荷MDA含量变化差异显著(P<0.05)。由图2可知,与CK相比,N处理和WN处理均显著降低薄荷MDA含量,以N降幅最大为26.42%,WN降幅最小为10.19% 。而W处理显著增加薄荷叶片MDA含量,增加了16.60%。
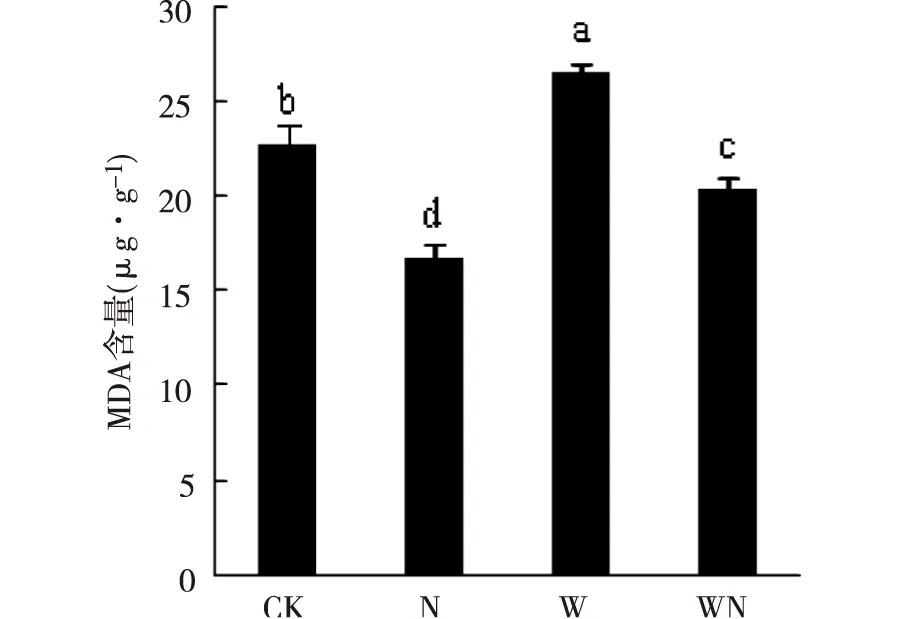
图2 增温与施氮对MDA含量的影响Fig.2 MDA content of M. haplocalyx seedlingunder warming and nitrogen application
2.5 增温与施氮对薄荷可溶性糖含量的影响
增温和施氮导致植物体内可溶性糖含量发生显著变化(P<0.05)。结果如图3所示,薄荷叶可溶性糖含量随增温与施氮的作用均有不同程度的增加。具体表现为,WN处理下可溶性糖含量最高,其次是W,最后是N。与CK相比,薄荷叶片可溶性糖含量分别增加了167%、123%、36%。
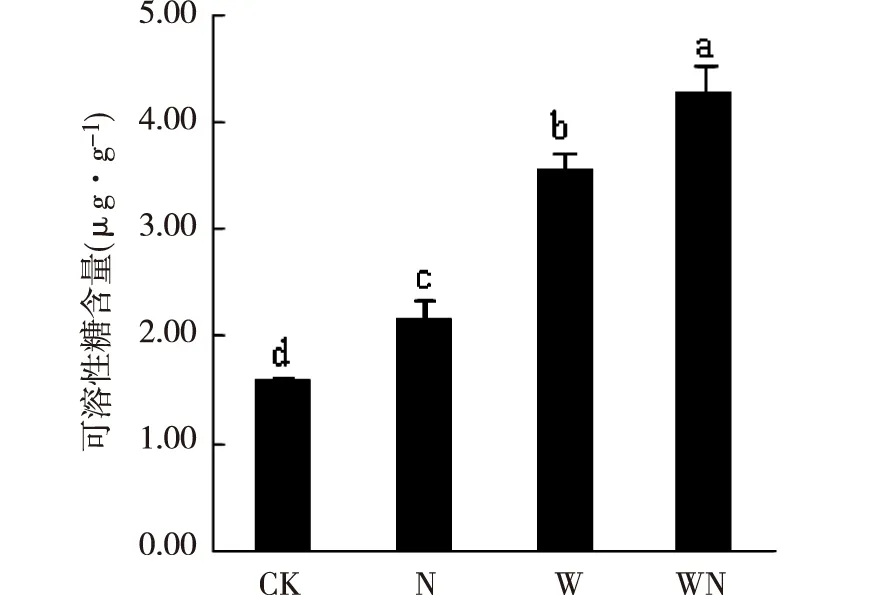
图3 增温与施氮处理下薄荷可溶性糖含量Fig.3 Soluble sugar content of M. haplocalyx seedling under warming and nitrogen application
3 讨 论
3.1 增温与施氮对薄荷幼苗生长发育的影响
温度与氮素通过调节植物各器官的生长发育进程,进而对植物形态产生影响。不同植物对增温和施氮的响应模式不同,增温和施氮的共同作用在不同植物上的表现也有所不同。就薄荷而言,增温、施氮显著增加薄荷根长及叶片数,其中温氮对薄荷幼苗各生长指标影响最大,在整个试验中基本呈线性增长,主要原因是增温和施氮通过改变土壤中养分的有效性,间接影响植物对土壤养分的吸收利用,进而促进植株生长[19]。
植株可以通过调节自身不同部位的生物量分配来优化生长以适应其所处环境条件的改变,从而最大限度地获取资源[20]。环境温度升高时营养物质向叶片的分配比例会受到影响,增施氮肥则会导致土壤所需有效养分含量增加[21],植株干物质积累及分配相应改变。整个观测期内,模拟增温增加地上与地下部分生物量,但对地下部分生物量的促进作用更大。这与增温导致的土壤含水量下降有关,因为植物缺水时,光合产物会更多地分配到根系以促进根系吸水。施氮处理时,薄荷幼苗地下生物量与地上生物量的比值明显减小,这与氮素促进了薄荷地上部分的生长有关,因为土壤养分(主要是氮)的减少会促使光合产物向根系的分配比例增加,而养分充足时光合产物将更多地向叶片分配[22-24]。
3.2 增温与施氮对薄荷幼苗生理特性的影响
植物的生理生化机制十分复杂,正常情况下植物体内保护酶系统处于平衡状态,受外界因子诱导后活性会大大改变[25]。有研究指出,植物酶促防御系统,如过氧化物酶(POD)、超氧物歧化酶(SOD)等具有清除自由基的能力,其活性往往能反映植物叶片受外界环境影响的伤害程度[26]。本研究发现,增温与施氮对薄荷POD、SOD活性变化的影响规律略有差异。增温显著升高了薄荷幼苗POD、SOD活性,与前人研究杨树高温胁迫结论一致[27]。薄荷幼苗POD、SOD活性在施氮处理时显著下降,原因是适量施氮促进了植物生长及生理过程[28],而非胁迫,故植物体内的抗氧化酶活性有所降低。温氮处理下薄荷幼苗POD、SOD活性仍较CK组大,但增幅小于单独的增温处理,可能原因是氮素缓解了高温对植物的影响。
MDA含量是细胞膜脂质过氧化作用水平的反映,其含量的高低在一定程度上可以反映出植物的膜脂过氧化水平及膜结构的受损害程度[29]。本研究发现,增温使薄荷叶内MDA含量上升,表明薄荷产生了膜脂氧化作用,即其体内存在相当数量的氧自由基导致细胞质膜发生过氧化代谢而分解形成MDA。这与杨敏等[30]发现河南省2种主要玉米在高温胁迫下MDA含量持续上升结果一致,与杜凌等[31]发现的高温胁迫使淡黄花百合幼苗叶片丙二醛的含量先降后升则不符,可能原因是本研究中增温未到达胁迫阈值。施氮、温氮处理下,薄荷MDA含量均有不同程度的下降,且单纯的施氮比温氮处理下的降幅要大,说明增温对施氮所导致的促进作用产生了一定的抑制。
可溶性糖不仅是植物生长所需的重要能源物质,同时还是植物体内重要的渗透调节物质。在整个试验过程中,可溶性糖含量在氮素、温度以及温氮间均存在显著差异。与对照相比,增温、施氮以及温氮处理均导致薄荷可溶性糖含量的大量积累,本研究结果与前人研究结果一致[32-33],主要是增温通过改变植物羧化位置光合组分活性,改变植物光合速率和呼吸速率,叶绿素含量增加,促进光合产物积累;而叶片氮含量是决定植物光合能力的主要因子,它能影响氮在叶片光合作用和呼吸作用过程中的分配,进而影响最大电子传递速率和最大羧化效率之间的平衡,植物光合作用增强,可溶性糖含量积累增加[34]。
综上所述,增温、施氮有利于薄荷幼苗的生长,并促进薄荷幼苗生物量的积累,其中增温更有利于地下生物量增加,施氮反之。温氮处理下薄荷幼苗MDA含量下降,POD、SOD活性提高,酶促防御系统增强,使得生物量及可溶性糖含量达到峰值,最终表现为薄荷生长发育、生理特性总体最佳。

