Ni-N-C单原子催化剂活化过硫酸盐降解苯酚
彭小明,吴健群,3,戴红玲,杨展宏,许 莉,许高平,胡锋平
(1.华东交通大学土木建筑学院,2.江西省饮用水安全重点实验室,3.土木工程国家实验教学示范中心,南昌 330013)
苯酚及其衍生物常作为有害污染物存在于炼油、生产塑料、造纸、制药和煤炭加工等工业废水中[1].苯酚在环境中难以降解,对人类的正常生活造成了严重的危害[2].美国环境保护署(USEPA)已将苯酚列为优先治理污染物,世界卫生组织(WHO)建议饮用水的苯酚含量最高为0.001 mg/L[3].吸附法、生物降解法和高级氧化法等多种方法已被应用于苯酚的去除[4],而基于硫酸根自由基(SO4·-)的高级氧化法在去除水和废水中的难降解有机污染物方面具有潜在的应用价值[5].
近来的研究表明,基于过硫酸盐(PMS)的类芬顿反应可产生大量的活性物质,在降解废水中的有机污染物方面显示出巨大的潜力[6~8].与传统的基于·OH的芬顿体系(E0=1.8~2.7 V)相比,基于SO4·-的类芬顿体系具有较高的氧化还原电位(E0=2.5~3.1 V)和较宽的pH值使用范围(2.0~9.0)[9],具有高氧化还原电位的SO4·-可将有机污染物降解或矿化为二氧化碳和水[10].过硫酸盐活化除产生自由基外,还存在非自由基的降解途径.非自由基途径具有较高的选择性和中等的氧化电位,与自由基氧化途径相比,其对富含电子的目标有机污染物(如卡马西平、氯酚、苯酚和染料)的选择性更强[11].研究发现,掺N的碳纳米管在激活PMS氧化苯酚的过程中存在自由基途径(·OH和SO4·-)和非自由基途径共同作用[12].Tian等[13]研究发现,在LaMnO3/PMS系统中,存在单线态氧(1O2)、·OH、SO4·-和O2·-,而1O2是有效降解氧氟沙星和苯酚的主要活性氧.因此,自由基和非自由基共存的降解途径比单一的自由基降解途径更有优势.
迄今,已经报道了多种PMS的活化方法,包括紫外光照射、加入碳催化剂和过渡金属催化剂等[14].在过渡金属中,Co,Fe和Mn被认为是最有效的PMS活化剂[15].在众多的含过渡金属的催化剂中,单原子催化剂(SACs)保留了均相和非均相催化剂的优点,如:高原子利用率、高分散位点、稳定且易于分离等,可以看作是连接均相催化剂和非均相催化剂的桥梁[16~18].杂原子(如N,S,P等原子)的掺杂可以提高相邻碳原子在催化反应中的电子密度和自旋密度,是增强催化活性的有效途径[19],其中,N配位可以降低吸附能,提高电子转移速率,从而显著提高Fenton性能[20].Feng等[21]将铁掺杂到富N的g-C3N4材料中,制备了Fe单原子催化剂(Fe-g-C3N4),Fe-g-C3N4/PMS系统对苯酚的降解率约为100%,而用Fe2+/PMS系统对苯酚的降解率不到5%,且Fe-g-C3N4催化剂具有较宽的pH使用范围.考虑到以上因素以及碳材料优良的吸附性能,将单一过渡金属原子锚定在N掺杂的生物质碳上有望有效提高类芬顿体系的催化性能.
本文以木质素生物质碳为载体,制备了N掺杂的镍单原子催化剂(Ni-N-C-10),将其与PMS形成Ni-N-C-10/PMS体系,在室温下实现了对苯酚的高效类Fenton降解.对Ni-N-C催化剂的形貌、结构进行了表征,探究了初始pH值、温度、PMS和催化剂投加量等因素对苯酚降解的影响,并通过自由基和非自由基淬灭实验、电子顺磁共振和X射线光电子能谱分析了苯酚的降解途径及机制.
1 实验部分
1.1 试 剂
木质素(脱碱)、六水合硝酸镍[Ni(NO3)2·6H2O]、六水合硝酸锌[Zn(NO3)2·6H2O]、二氰二胺(DCD)、过硫酸盐(2KHSO5·KHSO4·K2SO4,PMS)、对苯醌(C6H4O2)、异丙醇[(CH3)2CHOH]和糠醇(C5H6O2),上海麦克林生化科技有限公司;苯酚(C6H5OH)、氢氧化钠(NaOH)、盐酸(HCl)、碘化钾(KI)和甲醇(CH3OH)等,西陇科学股份有限公司.以上试剂均为A.R.级.实验用水为自制去离子水.
1.2 催化剂的制备
催化剂的制备过程如Scheme 1所示.首先,将4 g木质素、32 mmol/L Ni(NO3)2·6H2O和40 mmol/L Zn(NO3)2·6H2O加入到500 mL去离子水中,磁力搅拌1 h,然后在室温下老化11 h,通过离心分离(5000 r/min,3 min)得到木质素@Ni复合物.
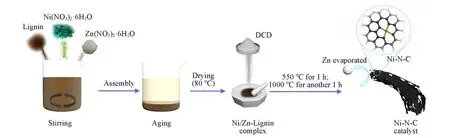
Scheme 1 Schematic illustration of the preparation of catalysts
将木质素@Ni复合物在80℃下干燥10 h后,与一定量的DCD混合研磨,然后置于管式炉中,在N2气氛中以5℃/min的升温速率将温度升至550℃,保持1 h,随后以相同的升温速率进行二次升温至1000℃,保持1 h.待材料冷却后,用5%的H2SO4进行酸洗,再用去离子水洗涤4次,最后在60℃下干燥,得到Ni-N-C-x(其中x代表DCD与木质素@Ni复合物的质量比,x=0,5,10).
1.3 催化剂的表征
利用X射线衍射仪(XRD,Bruke D8 Advance)对催化剂进行晶相分析;通过扫描电子显微镜(SEM,ZEISS MERLIN Compact)和透射电子显微镜(TEM,FEI Tecnai G2 F20)观察样品表面形貌,通过TEM自带的X射线能谱仪对样品进行元素分析;利用经球差校正的高角度环形暗场扫描透射电子显微镜(AC-HAADF-STEM,FEI Themis Z)图像探究催化剂中单原子的形成;采用Micromeritics ASAP 2020表面积和孔隙率分析仪测定77 K时的氮吸附-脱附等温线;使用配备有AlKα射线的双X射线源的光电子能谱仪(XPS,Thermo ESCALAB 250XI)获得X射线光电子能谱;用Thermo DXR拉曼显微镜获得拉曼光谱;用电子顺磁共振光谱仪(EPR,Bruker 300)检测反应自由基;利用高效液相色谱仪[HPLC,LC-20AD,配备Phenomenex Luna C18(2)柱(4.6 mm×150 mm×5 mm)]分析污染物残留;反应后溶液中溶解金属的含量采用电感耦合等离子体发射光谱仪(ICP-OES,Agilent 7700)测定.
1.4 催化降解实验
用去离子水配制10 mg/L的苯酚溶液备用.在室温(25℃)下,量取50 mL配制好的苯酚溶液倒入烧杯中,加入一定量的催化剂和PMS,进行搅拌并开始计时.每隔一定时间取样3 mL,水样使用0.22μm滤膜过滤后测试其在最大吸收波长(270 nm)处的吸光度,对苯酚的剩余量进行分析.根据下式计算苯酚在Ni-N-C/PMS体系上的降解反应的一级反应速率常数(k):

式中:c0为苯酚的初始浓度(mg/L);ct为取样测定时的苯酚浓度(mg/L);k为一级反应速率常数(min-1);t为反应时间(min).
探究催化剂的投加量(2.5,5,7.5,10 mg)、PMS投加量(0.25,0.50,0.75,1.00 mmol/L)、pH值(3,5,6,7,8,9,11)和重复利用对活化PMS降解苯酚的影响时,实验条件与上述保持一致.
2 结果与讨论
2.1 催化剂的表征
由图1中SEM[(A)~(C)]和TEM[(D)和(E)]照片可见,Ni-N-C-10催化剂中没有形成明显的纳米颗粒,而在Ni-N-C-5催化剂中形成了少量的纳米颗粒,没有加入DCD的Ni-N-C-0催化剂中则形成了大量的纳米粒子聚集体,表明加入10倍质量比的DCD更有利于Ni原子的分散.AC-HAADF-STEM图像[图1(F)]进一步证实了Ni-N-C-10催化剂中不存在团聚的Ni纳米粒子,并且可以清楚地观察到小于0.2 nm的孤立亮点,表明存在原子级分散的Ni物种.此外,Ni-N-C-10催化剂的EDS元素面扫描图[图1(G)~(I)]表明Ni元素以原子分散或团簇的形式分布在催化剂表面.这证明通过加入10倍质量比的DCD可制备得到Ni位点高度均匀分散于生物质碳表面的催化剂.

Fig.1 SEM images of Ni-N-C-10(A),Ni-N-C-5(B)and Ni-N-C-0(C),TEM images of Ni-N-C-10(D)and Ni-N-C-5(E),AC-HAADF-STEM image of Ni-N-C-10(F)and EDX elemental mappings of Ni-N-C-10(G—I)
催化剂Ni-N-C-10的XRD谱[图2(A)]在2θ=26.1°处有1个特征衍射峰,对应于石墨烯的(002)晶面[22,23],与标准图谱(PDF#89-8487)相符.此外并未观察到其它衍射峰.与Ni-N-C-0和Ni-N-C-5的XRD谱对比可知,Ni-N-C-10的XRD谱中没有观察到聚集的金属Ni物种的特征衍射峰,这与图1(A)和(D)的结果一致,进一步佐证了Ni-N-C-10中Ni可能以单原子的形式存在.
利用拉曼光谱对催化剂的表面缺陷进行了研究.如图2(B)所示,所有样品均在约1356和1592 cm-1处出现2个峰,分别归属于碳原子的D带和G带.随着DCD质量比由0分别升高到5和10,D带与G带的相对强度(ID/IG)分别从1.068减小到1.046和1.038,这表明随着N含量的增加,Ni-N-C催化剂中产生的缺陷减少.N原子的加入可能会引起碳层的变形,同时掺杂的N原子修饰了碳骨架,从而使材料产生的缺陷减少,石墨化程度降低[24].
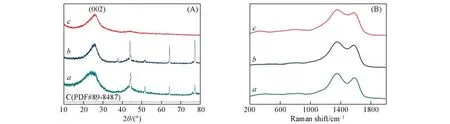
Fig.2 XRD patterns(A)and Raman spectra(B)of Ni-N-C-0(a),Ni-N-C-5(b)and Ni-N-C-10(c)
表1列出了所制备催化剂的比表面积和孔体积等参数.可见,材料的孔径介于10~30 nm之间,说明制备的3种材料均具有介孔结构.随着DCD加入量的增加,催化剂的比表面积得到了较大的提升,加入5倍和10倍DCD的催化剂的比表面积分别是不含DCD的催化剂的46.3和75.1倍,这有利于材料对苯酚的吸附[25].此外,大孔径和高比表面积可提供丰富的Ni原子活性位点,并促进底物分子的传质扩散.
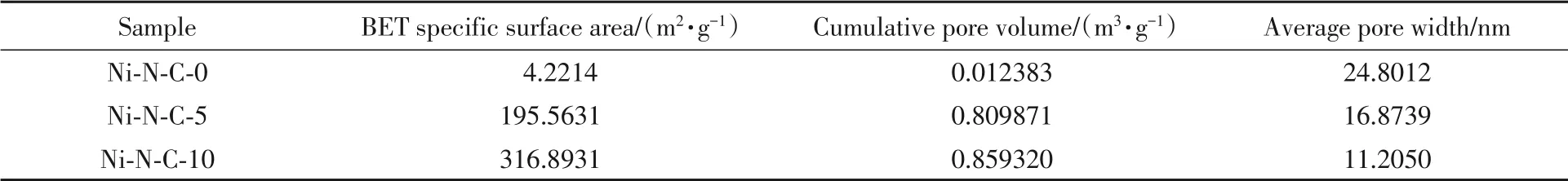
Table 1 Specific surface area,pore volume and pore size of the prepared catalysts
利用X射线光电子能谱进一步分析了3种Ni-N-C材料的近表面元素组成.图3(A)为全扫描谱图,可见,3种材料中Ni,O,N,C元素共存.图3(B)为Ni2p区域的XPS图谱,以探测Ni元素的价态.3种Ni-N-C材料的Ni2pXPS图谱显示出2∶1面积比的特征峰,分别归属于Ni2p3/2和Ni2p1/2信号.以854.9 eV为中心的峰值可归属于Ni纳米粒子,而Ni-N-C-10中Ni2p3/2峰(855.1 eV)的结合能高于Ni0(852.7 eV)的结合能,低于Ni2+(855.7 eV)的结合能,揭示了催化剂中Ni的离子态Niδ+(0<δ<2)性质[26].由于其独特的性质,单原子通常是配位不饱和的[27].
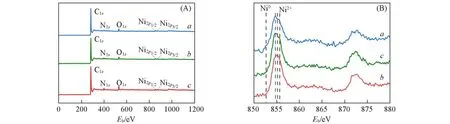
Fig.3 Survey(A)and Ni2p(B)XPS spectra of Ni-N-C-0(a),Ni-N-C-5(b)and Ni-N-C-10(c)
2.2 催化剂的性能
图4(A)为Ni-N-C-0、Ni-N-C-5和Ni-N-C-10材料对苯酚的吸附和催化氧化的去除效果.从中可以看出,Ni-N-C-10材料较大的比表面积有利于其对苯酚的吸附去除,同时也能为降解过程提供更多的反应位点[28].但总体而言,3种材料对苯酚的吸附去除效果均不理想,最高仅达15.4%.投加PMS后,Ni-N-C-5/PMS和Ni-N-C-10/PMS体系对苯酚的去除率达80.7%和94.8%,分别为吸附作用的6.4和6.2倍,表明在这两个体系中,苯酚浓度的降低主要是由于催化氧化作用.此外,加入10倍质量的DCD所制备的原子分散的Ni-N-C-10催化剂的催化性能得到了极大的提升.
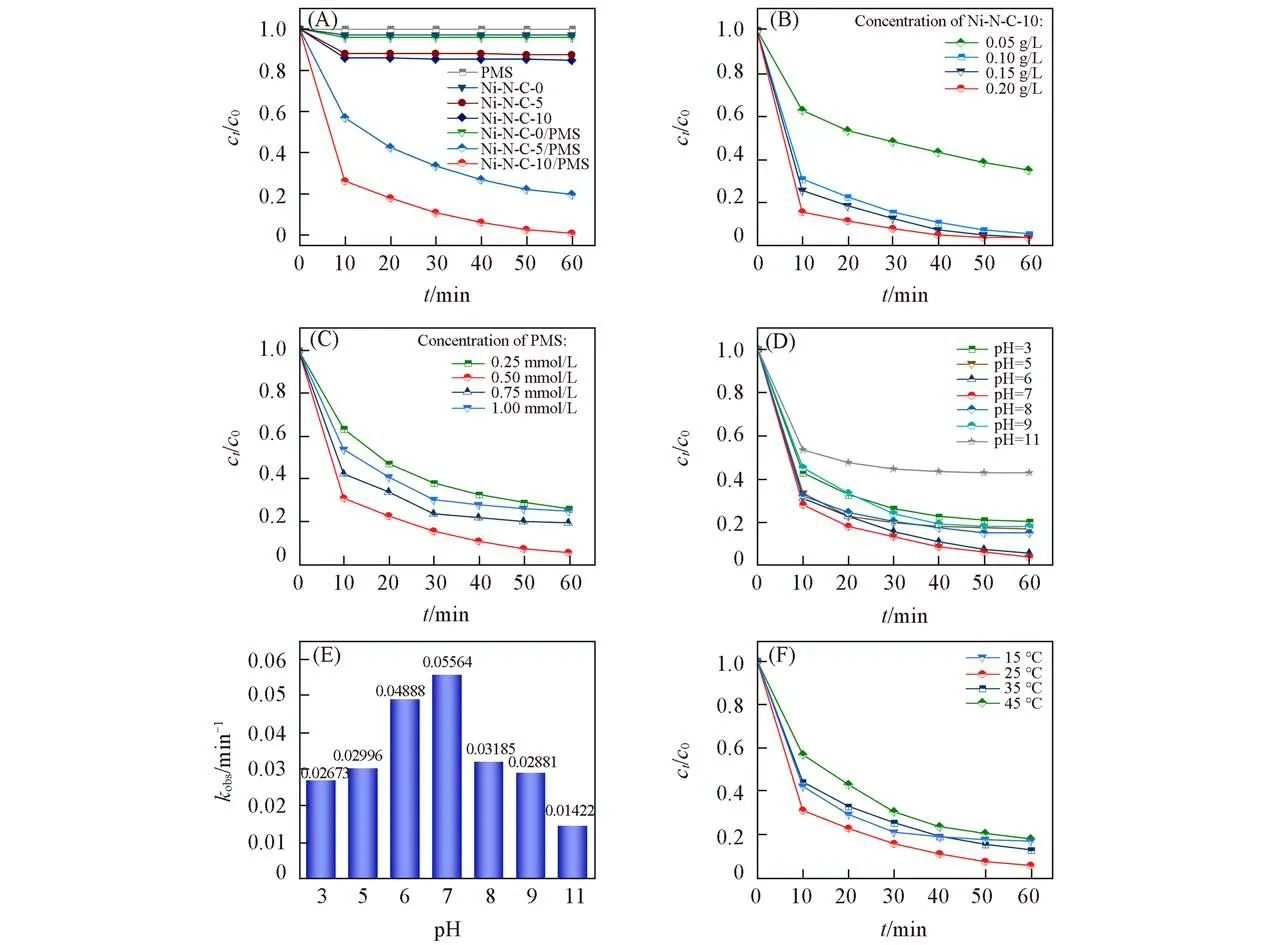
Fig.4 Effect of different reaction systems(A),catalyst dosage(B),PMS dosage(C)and pH(D,E)and temperature(F)on degradation efficiency of phenol
从表2可以看出,Ni-N-C-10/PMS体系催化苯酚降解的速率常数(kobs)分别为纳米颗粒催化剂Ni-N-C-5/PMS体系和Ni-N-C-0/PMS体系的1.8倍和16.0倍.
综合以上结果可见,3种材料中Ni-N-C-10的催化降解效果最好,因此后续实验中均采用Ni-NC-10催化剂.
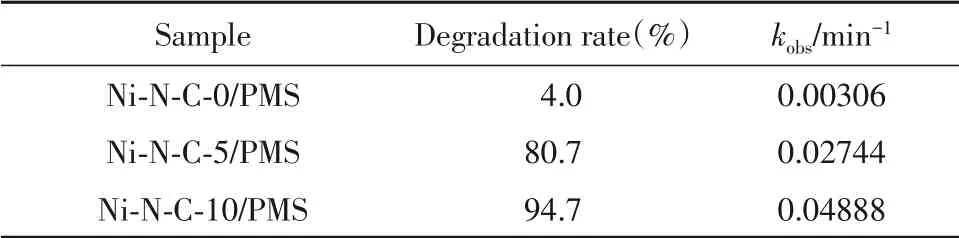
Table 2 Degradation rate and reaction rate constant of phenol in different reaction systems
2.3 Ni-C-N-10降解苯酚影响因素分析
在苯酚浓度为10 mg/L、pH值为6、PMS浓度为0.5 mmol/L时,在室温下(25℃)考察了Ni-N-C-10催化剂的不同投加量对苯酚降解效率的影响,结果如图4(B)所示.当Ni-N-C-10投加量为0.05 g/L时,反应60 min后苯酚的降解率仅为65.1%,反应速率常数为0.01754 min-1;当投加量增加到0.1 g/L时,相同时间内苯酚的降解率提高至94.7%,反应速率常数增加到0.04888 min-1,但投加量继续增加至0.15 g/L和0.2 g/L时,降解率仅升高至96.5%,这说明投加少量的催化剂就能达到较好的去除效果.综合降解效果和经济性考虑,后续实验选择0.1 g/L的催化剂投加量.
考虑到催化降解过程中PMS投加量对苯酚去除的影响,在苯酚浓度为10 mg/L、pH=6、Ni-N-C-10投加量为0.1 g/L时,在室温下考察Ni-N-C-10/PMS体系在PMS浓度为0.25,0.50,0.75和1.00 mmol/L时的催化降解效果.从图4(C)可以看出,PMS投加量直接影响苯酚的去除效果,过高或过低的PMS浓度都不利于苯酚的降解.若PMS浓度过低,则无法产生足够的活性物质用于降解苯酚;若PMS的浓度过高,过量的HSO5-会和SO4·-反应生成氧化能力较弱的SO5·-,同时还会诱发自由基之间的猝灭反应[式(2)~(4)],使苯酚的降解率下降[29].因此,在Ni-N-C-10活化PMS氧化降解苯酚的体系中,选用0.50 mmol/L的PMS浓度.
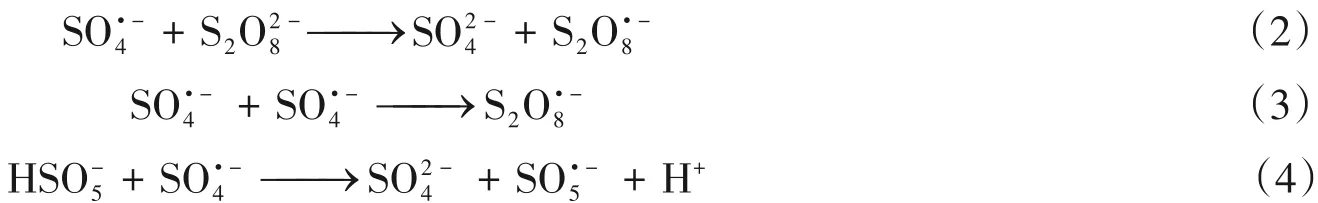
在反应前将溶液初始pH调节为3,5,6,7,8,9,11,在室温下探究不同pH值对Ni-N-C-10/PMS体系催化降解苯酚的影响,结果如图4(D)~(E)所示.随着初始pH值的逐渐升高,Ni-N-C-10/PMS体系对苯酚的降解率及反应速率首先出现增加趋势,在pH值为6和7时苯酚的去除率达到94%以上;而当溶液初始pH>7时,降解率下降,催化降解效率明显减弱,溶液pH值上升至11时,苯酚的降解率仅为57.4%,这可能是由于在较高的pH值下,生成的SO4·-易与OH-发生如下反应:

反应所生成的·OH的氧化能力弱于SO4·-,导致降解率下降[30,31].总体而言,在pH=3~9时,苯酚的降解率始终保持在80%以上,说明Ni-N-C-10/PMS体系具有较宽的pH适用范围.其中,该体系的最适pH值为6—7.
温度对苯酚降解效率和反应速率的影响如图4(F)所示.随着温度的升高,苯酚的降解率先升高后下降,在25℃下Ni-N-C-10/PMS体系对苯酚的降解效果最佳.这表明随着温度的升高,分子发生剧烈碰撞,有利于反应的正向进行;当温度高于25℃时,由于该反应为放热反应,温度的继续升高会抑制反应的正向进行,从而使苯酚的去除率降低[32].
为探究Ni-N-C-10催化剂的稳定性和应用潜力,进行了循环降解实验.每次实验结束后,均用水洗涤催化剂4次,再进行下一次循环.由图5(A)可见,3次循环实验中,催化剂对苯酚的催化降解效率分别为94.8%,86.8%和81.9%,说明该体系能够稳定地去除苯酚.循环3次后,苯酚的去除率有所下降,可能是由于吸附作用使催化剂表面的部分活性位点被覆盖,且Ni原子的逸出使活性位点减少所致.在3次循环中,水体中Ni的浓度分别为29.1,11.1和5.8μg/L,均低于世界卫生组织对饮用水中镍含量的规定值[33].在氮气气氛中500℃热处理1 h后,材料的催化活性得到回升,且接近初始水平[图5(A)],这表明通过在N2气气氛中进行简单的热处理可以去除催化剂表面的吸附物,使催化剂性能得到很好地恢复.
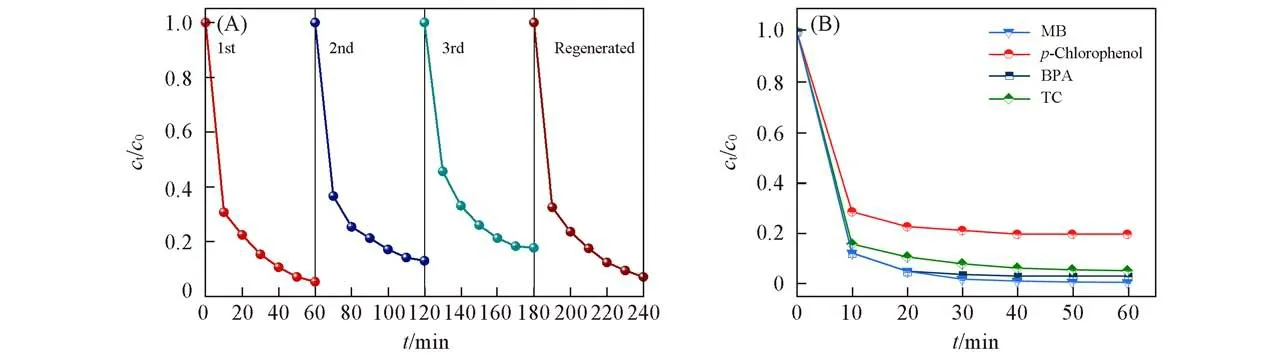
Fig.5 Stability and application potential of Ni-N-C-10/PMS system(A)Cyclic degradation experiment;(B)degradation performance toward different pollutants.Reaction conditions:initial concentration of pollutants=10 mg/L,[PMS]0=0.1 g/L,[catalyst]0=0.1 g/L,initial pollution pH=6(without buffer solution),T=298 K.
Ni-N-C-10/PMS体系不但对苯酚有较好的去除效果,而且对双酚A(BPA)、四环素抗生素(TC)和亚甲基蓝染料(MB)均能实现快速降解.如图5(B)所示,Ni-N-C-10/PMS体系在40 min内对BPA的去除率达97.4%,在60 min内对TC和MB的去除率均高于95%.总体而言,Ni-N-C-10催化剂具有良好的稳定性和较大的应用潜力.
2.4 Ni-C-N-10催化降解苯酚活性物种分析
为分析Ni-N-C-10活化PMS降解苯酚过程中产生的活性物种,选用甲醇(MeOH)、异丙醇(Isopropyl alcohol)、糠醇(FFA)、KI以及对苯醌(p-BQ)作为淬灭剂进行自由基和非自由基的淬灭实验.甲醇对自由基均有较高的反应活性,它可以与mol-1·s-1)快速反应[34],异丙醇对·OH的反应活性较强,但对SO4·-的反应活性较弱,因此甲醇可以作为和·OH的淬灭剂,异丙醇可以作为·OH的淬灭剂.此外,对苯醌、糠醇以及KI分别对自由基非自由基1O2及电子转移具有较高的反应活性,可作为这些活性物质的淬灭剂.
当苯酚浓度为10 mg/L、Ni-N-C-10投加量为0.1 g/L、pH值为6、PMS浓度为0.5 mmol/L时,向溶液中分别加入甲醇、异丙醇、糠醇、KI以及对苯醌,判断体系中对苯酚降解起主要作用的反应活性物种.如图6所示,向体系中加入KI和对苯醌时,基本没有出现抑制效果;而加入甲醇、异丙醇和糠醇时,均出现抑制效果,且糠醇的抑制效果最明显.向反应体系中加糠醇后,苯酚的降解率从94.8%降低至47.2%,反应速率常数从0.04888 min-1降低至0.01069 min-1.这表明Ni-N-C-10活化PMS降解苯酚过程中自由基SO4·-、·OH和非自由基1O2均是参与反应的活性物种,其中1O2是起主导作用的活性物种.
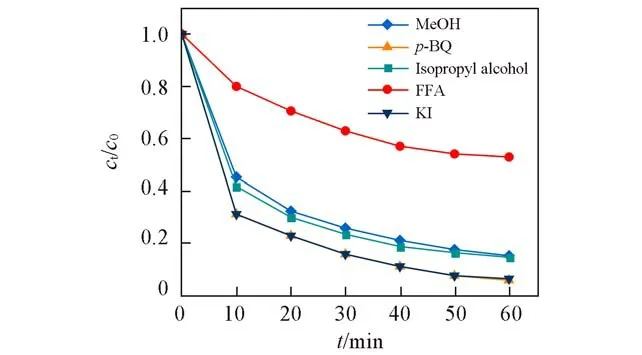
Fig.6 Effect of radical and non-radical quenching on pH degradation
为了进一步证明Ni-N-C-10/PMS系统中所产生的活性物种,进行了EPR检测.图7为Ni-N-C-10活化PMS的过程中TEMP-·OH和加合物的EPR谱图.通过EPR技术捕获到了较强的以及信号[图7(A)和(B)],进一步证明了体系中活性物质的产生.此外,也捕获到了微弱的信号[图7(C)],结合淬灭实验结果可知,在该体系中虽然产生了少量的对苯酚的降解几乎没有贡献.因此,Ni-N-C-10/PMS系统对苯酚的降解主要是通过非自由基途径,即产生,从而高效氧化降解苯酚.
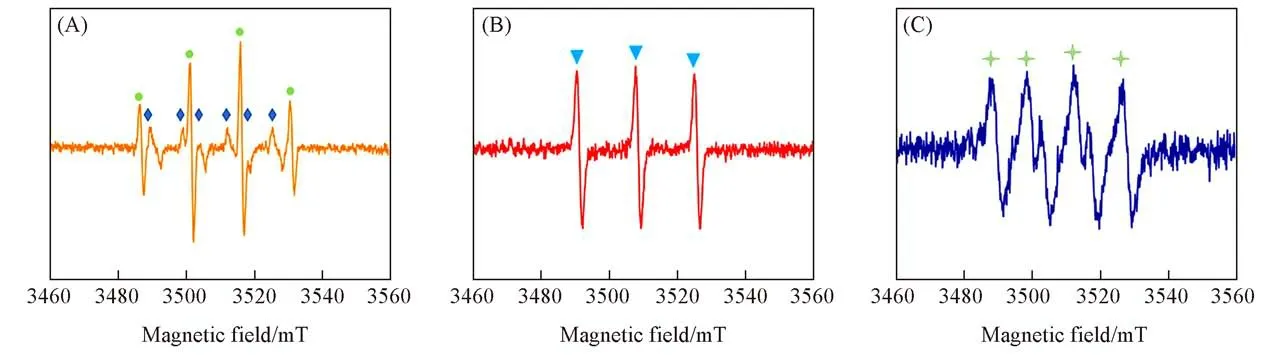
Fig.7 EPR spectra of TEMP-·OH and SO4·-(A),TEMP-1O2(B)and TEMP-O2·-(C)
Ni-N-C-10/PMS系统降解苯酚的主要反应途径如Scheme 2所示.在催化氧化过程中,Csp2自由流动的π电子可以破坏PMS的O—O键,促进和·OH的生成,同时反应生成·OH,如式(6)~(8)所示[28]:
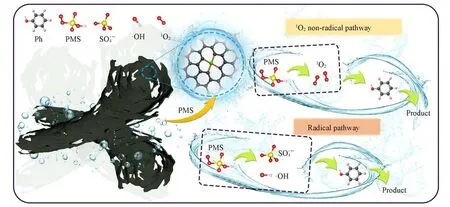
Scheme 2 Main pathways involved in the phenol degradation in Ni-N-C-10/PMS system
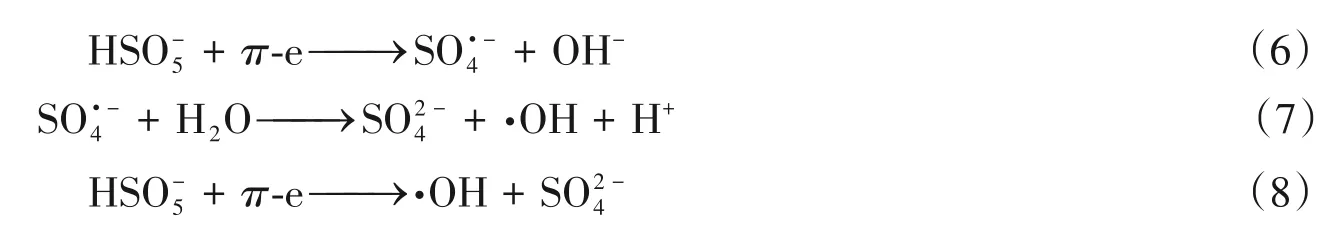
对于非自由基过程,多孔结构和N掺杂促进了有机污染物的吸附,有助于电子从有机污染物直接转移到PMS-Ni-Nx复合物中[35].在单原子催化剂中,吡啶N通常被认为是过渡金属物种的配位位点[36,37],而在Ni-N-C-10/PMS体系中,1O2的产生可能是由于吡啶N和Ni活性位点的存在.PMS和Ni-Nx位点的结合伴随着快速的电子累积和消耗,从而有效地激活PMS和生成1O2.综上,以非自由基反应的形式发生的1O2机制与自由基SO4·-和·OH共同作用实现了苯酚的高效降解.
2.5 机理分析
利用XPS分析了不同催化剂和Ni-N-C-10在使用前后的N物种含量变化对降解苯酚的影响.如图8所示,催化剂的高分辨N1sXPS图谱显示出4个峰值,分别位于402.7,401.1,399.8和398.7 eV,对应氮氧化物、石墨N、吡咯N和吡啶N[38~40].表3列出了3种催化剂的总N以及不同类型N物种的含量.从中可以看出,所制备催化剂的总N、石墨N、吡咯N和吡啶N的含量均随DCD加入量的增加而增加.然而,已有研究表明氮氧化物对碳催化剂的催化活性几乎没有贡献[41].图9(A)示出了3种催化剂的石墨N含量与苯酚的吸附效率的关系.随着石墨N含量的升高,吸附效果随之增强,两者之间呈现明显的正相关关系.因此,所制备材料的吸附作用除了与比表面积有关外,还与石墨N的含量有关,大的比表面积和较高的石墨N含量均有利于PMS和污染物在催化剂表面的吸附,从而提高材料的催化性能.
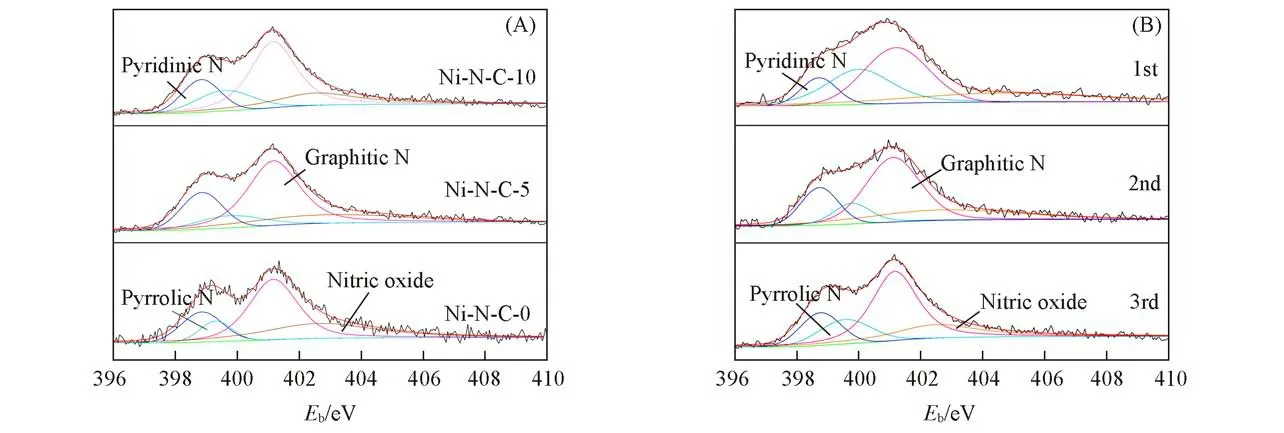
Fig.8 N1s XPS spectra of different catalysts(A)and Ni-N-C-10 before and after use(B)
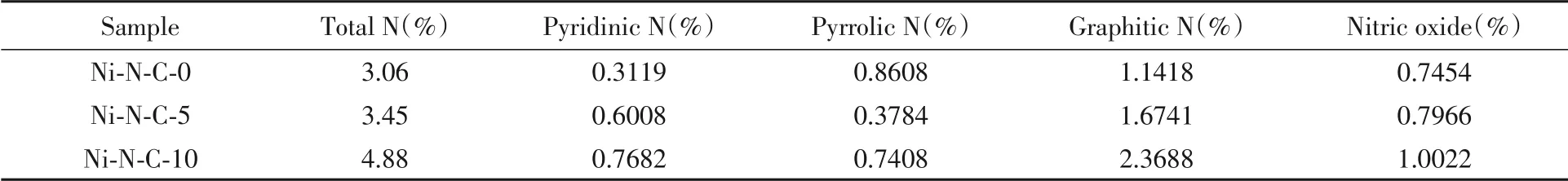
Table 3 Total N content of different catalysts and the content of different N species
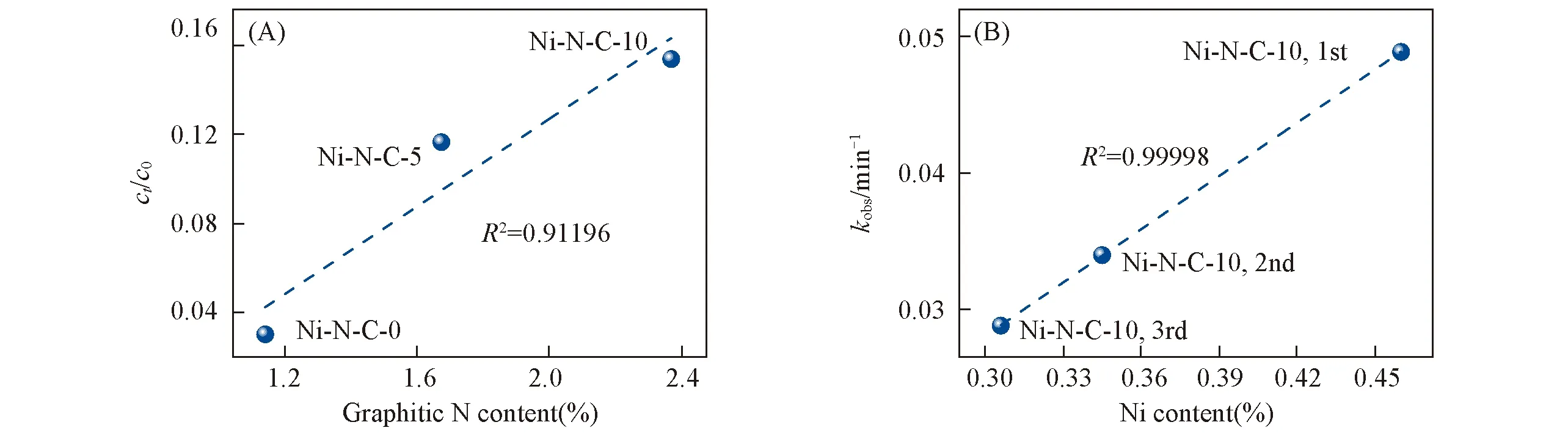
Fig.9 Effect of graphite N content on adsorption efficiency of Ni-N-C-0,Ni-N-C-5 and Ni-N-C-10 catalysts(A)and effect of Ni content on catalytic efficiency(B)
表4示出了Ni-N-C-10催化剂在使用前后不同N物种含量的变化.随着使用次数的增加,吡啶N和石墨N的含量均有所下降.而吡啶N通常被认为是过渡金属物种的配位位点,即在Ni-N-C-10催化剂中吡啶N易与Ni形成Ni-Nx位点,而在Ni-N-C-10催化剂的循环使用过程中,吡啶N含量的减少直接影响Ni-Nx位点的数量.图9(B)为循环实验中,Ni-N-C-10催化剂的Ni含量变化与催化效果的关系.可见,随着循环实验次数的增加,催化剂中Ni的含量减少,同时Ni的含量与反应速率呈明显的正相关关系.综合上述结果认为,Ni位点为催化PMS降解苯酚反应的活性中心.
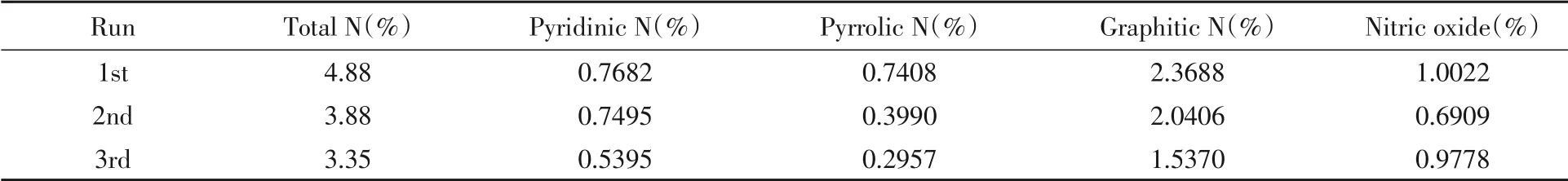
Table 4 Content of different N species in Ni-N-C-10 catalyst in cycle experiment
3 结 论
采用木质素生物质碳为载体,制备了N掺杂的镍单原子催化剂(Ni-N-C-10),该催化剂表现出较高的催化活性及稳定性.Ni-N-C-10/PMS体系在较宽的pH范围(3~9)、较低的PMS浓度(0.5 mmol/L)和较少的催化剂投加量(0.1 g/L)下可实现苯酚的有效降解,还可用于多种水中有机污染物的高效降解.Ni-N-C-10/PMS体系对苯酚的降解为非自由基主导的过程,该体系的主要活性物种为1O2.Ni位点为催化PMS降解苯酚反应的活性中心,Ni的含量与降解速率呈高线性正相关.以上结果表明,该镍单原子催化剂在废水治理领域具有广阔的应用前景.

