基于菲并咪唑的ON-OFF-ON双比色荧光探针及细胞成像
李安然,赵 冰,2,阚 伟,2,宋天舒,孔祥东,卜凡强,孙 立,2,殷广明,王丽艳,2
(1.齐齐哈尔大学化学与化学工程学院,2.黑龙江省表面活性剂与工业助剂重点实验室,齐齐哈尔 161006)
研究表明,金属离子在众多生物过程中扮演着重要的角色[1~3].金属离子具有毒性,当人体内金属离子的浓度超出正常水平时,可能会引起身体异常、紊乱或细胞死亡,进而导致慢性或急性病症[4~6].因此,调节和监控生物体内的重金属离子浓度水平是非常必要的.Cu2+浓度占人体内重金属离子含量的第三位,有助于维持骨骼、血管、免疫功能、神经和代谢系统,在铁的吸收中起着至关重要的作用[7,8].Cu2+浓度不足或过量会导致胃肠功能障碍[9]、威尔逊氏病[10]及肌萎缩性硬化[11]等疾病.此外,Ag+是另一种有毒有害的重金属离子之一,其毒性也会对人体造成重要的伤害.尤其是Ag+与多种代谢物结合后会使巯基酶失活,进而对多种细胞产生明显的细胞病变作用[12,13].鉴于Cu2+和Ag+在生物体内的重要作用,开发简便、高效及灵敏的方法用于检测生物体内Cu2+和Ag+浓度的方法具有重要意义.
近年来,原子吸收光谱(AAS)[14]、电感耦合等离子体质谱(ICP˗MS)[15]、电感耦合等离子体原子发射光谱(ICP˗AES)[16]、傅里叶变换红外光谱(FTIR)[17]和紫外-可见光谱(UV-Vis)[18]等传统分析方法已用于Cu2+和Ag+浓度的检测.然而,这些方法存在预处理时间长、操作复杂、需要精密仪器和灵敏度较差等缺点,因而在实时的现场检测中受到限制.荧光光谱法由于具有操作简单,选择性、灵敏度高及适于实时监测等优点而被广泛认可.基于不同的荧光响应机理,大量文献分别报道了具有不同发射基团和不同识别基团的选择性Cu2+荧光探针和Ag+荧光探针[19~22].但关于可区别性地识别双金属离子的荧光探针的报道较少[23,24].
本文以菲并咪唑为发射团,双Schiff碱为链接基团,设计了一种对称型菲并咪唑荧光探针PIP-ph-PIP,合成路线如Scheme 1所示,该探针既可以通过裸眼比色区别检测Cu2+和Ag+,又可以通过荧光光谱选择性地识别Cu2+和Ag+.此外,还可以通过ON-OFF-ON的方式实现的连续识别,并实现了HeLa细胞中Cu2+和Ag+的定性检测.
Scheme 1 Synthesis of probe PIP-ph-PIP
1 实验部分
1.1 试剂与仪器
菲醌(纯度99%)、对硝基苯甲醛(纯度98%)、对苯二甲醛(纯度98%)和乙酸铵(纯度97%),上海阿拉丁试剂公司;4-羟乙基哌嗪乙磺酸(Hepes)、乙酸乙酯、石油醚(60~90℃)和乙醇,天津市天力化工有限公司.参照文献[25]方法制备4-(1H-菲[9,10-d]咪唑-2-基)苯胺.
LS-55型荧光分光光度计,美国Perkin Elmer公司;TU-1901型紫外-可见分光光度计(UV-Vis),北京普析通用仪器公司;AVANCE-600型核磁共振波谱仪(1H NMR),德国Bruke公司;X-6型精细显微熔点测试仪,北京泰克仪器有限公司;TEK-ELX800型酶联免疫检测仪,美国宝特公司;BrukermicrOTOFQIII型高效液相质谱仪(HRMS),德国Bruker Daltonics公司;FV-1000型荧光共聚焦显微镜,日本Olympus公司.
1.2 探针PIP-ph-PIP的合成
将0.63 g(2.0 mmol)4-(1H-菲[9,10-d]咪唑-2-基)苯胺、0.13 g(1.0 mmol)间苯二甲醛和20 mL乙醇依次加入50 mL单口烧瓶中,室温下搅拌6 h;反应过程中用薄层色谱(TLC)跟踪监测,展开剂为乙酸乙酯/石油醚(体积比3∶7),反应结束后向反应体系中加水,析出固体,经过滤、干燥后得到粗产品;粗产品用乙酸乙酯重结晶,干燥后得到(0.61 g)黄色固体粉末PIP-ph-PIP,产率85%,m.p.>350℃.IR(KBr),ν˜/cm-1:3432,1731,1579,1453,1426,1149,1110,1043,1013,964,923,743,722,615;1H NMR(600 MHz,DMSO-d6),δ:12.53(s,2H,NH),9.21(s,2H,N=CH),8.91(s,H,ArH),8.86(d,J=9.0 Hz,4H,ArH),8.71(d,J=8.0 Hz,4H,ArH),8.52(d,J=9.5 Hz,4H,ArH),8.24(d,J=8.0 Hz,2H,ArH),7.74~7.80(m,1H,ArH),7.72~7.68(m,6H,ArH),7.65(t,J=8.5 Hz,4H,ArH),7.59(d,J=9.0 Hz,2H,ArH);13C NMR(150 MHz,DMSO-d6),δ:178.6,162.3,154.8,139.1,135.6,130.5,129.8,128.3,127.0,126.5,125.8,123.6,122.9,121.5,120.0,119.7;元素分析(C50H32N6理论值):C 83.91(83.78),H 4.66(4.50),N11.58(11.72);HRMS(ESI-TOF)for[M+H]+,m/z:716.8488.
1.3 荧光光谱测定
将探针PIP-ph-PIP用N,N′-二甲基甲酰胺(DMF)配制成浓度为1.0×10-4mol/L的储备液,测试用水溶液为Hepes缓冲溶液(10μmol/L,pH=7.4),探针的浓度为1.0×10-5mol/L.测试用金属离子为金属氯盐或硝酸盐,测试用阴离子为阴离子的钠盐或钾盐.室温下测试样品的荧光光谱,石英比色皿尺寸为1 cm×1 cm×4 cm,激发波长为311 nm,激发和发射狭缝宽度分别为2.5和5 nm.
2 结果与讨论
2.1 探针PIP-ph-PIP在水相体系中的光谱行为
为了确定主体化合物的识别体系,通过改变探针PIP-ph-PIP的DMF溶液(1.0×10-5mol/L)中水的体积分数,考察了探针PIP-ph-PIP在不同体积比DMF/H2O(10μmol/L Hepes,pH=7.4)混合溶剂中紫外吸收光谱和荧光发射光谱的变化.图1(A)给出探针PIP-ph-PIP在不同水的体积分数(fw,%)条件下的紫外光谱.可见,在纯DMF溶剂中,探针PIP-ph-PIP只有一个明显吸收峰,最大吸收波长为383 nm,吸光度处于中等强度(ɛ=0.356).当少量水存在时(fw=10%),探针PIP-ph-PIP的吸收波长几乎无变化.当fw从20%增加到50%时,探针的最大吸收波长蓝移至325 nm,且吸收峰变窄,吸光度增加,最大摩尔吸光系数(ɛ)达到0.65,同时在365 nm处存在一个小的肩缝.当fw>50%时,325和365 nm处的2个吸收峰的强度显著减小,吸收峰明显变宽,吸收波长在400 nm以上表现为一定强度的吸光度.探针PIP-ph-PIP的紫外光谱变化随水含量变化表现出3种状态:水的体积分数较小时(fw<10%),探针处于良好的溶解状态,其紫外吸收光谱与在纯DMF溶剂中的紫外光谱类似;水的体积分数在20%~50%之间时,不良溶剂(水)体积增加,探针PIP-ph-PIP的溶解度下降,形成部分聚集,导致了紫外光谱中最大吸收光谱的蓝移;当水的体积分数>50%时,整个溶剂体系接近于水溶液,探针PIP-ph-PIP的聚集加剧,溶液中探针PIP-ph-PIP颗粒增大,导致了紫外光谱吸收峰变宽,吸光度下降.

Fig.1 Absorption(A)and fluorescent spectra(B)of PIP-ph-PIP with different volume fractions(f w)of water
探针PIP-ph-PIP溶液的荧光发射光谱随水的体积分数变化也表现为3种状态[图1(B)].以311 nm为激发波长,探针PIP-ph-PIP在DMF溶剂中的发射波长为461 nm,表现为较弱的荧光发射,这可能是由于探针在纯溶剂中的自有旋转消耗了激发态的能量所致.加入少量水时,探针溶液的荧光强度开始增大,当fw增加到30%时,探针的荧光强度达到最大,增强倍数为纯DMF溶液的82倍,表现为强荧光.fw在20%~50%之间时荧光强度几乎不变.fw增加到60%时,探针的荧光强度急剧下降,降为最高强度的1/4,继续增加fw,探针溶液保持低荧光发射状态.随着fw的变化,探针PIP-ph-PIP溶液荧光强度由弱荧光变化为强荧光,再变化为中等强度荧光状态,这是由于探针分子从溶解态到部分聚集再到聚集加剧的状态变化所致.随着fw的增加,探针PIP-ph-PIP的荧光强度增强,属于典型的聚集诱导发光机制(AIE)[26];而大量水存在时,由于探针PIP-ph-PIP的聚集程度增大引起的荧光猝灭现象属于典型的聚集诱导猝灭现象(ACQ)[27].
探针PIP-ph-PIP溶液在紫外灯下的颜色变化及其丁达尔现象(图2)更加直观地证明其在水溶液中的聚集状态和荧光变化.由图2(A)可见,在紫外灯激发下,随着fw增加,探针溶液的蓝色荧光先增强后降低,这种现象与探针溶液的荧光光谱变化一致.在暗室中,采用红色的激光笔照射探针水溶液,在fw为20%的探针水溶液中开始观察到红色光束.这说明探针开始形成聚集,随着fw增加,红色光束越来越明显,说明探针的聚集加剧,丁达尔现象更明显[图2(B)].上述结果进一步证明,探针在水溶液中逐渐形成聚集,荧光机制由AIE变为ACQ.

Fig.2 Photos of PIP-ph-PIP(10μmol/L)illuminated by UV lamp(A)and red laser pointer(B)in different proportions of DMF/H2O(Hepes 10μmol/L,pH=7.4)The volume fractions of water from left to right were 10%,20%,30%,40%,50%,60%,70%,80%,90%,respectively.
2.2 探针PIP-ph-PIP在水相体系中对Ag+和Cu2+的选择性识别
鉴于探针PIP-ph-PIP的结构特征,在DMF/H2O(体积比1∶99,10μmol/L Hepes,pH=7.4)溶液中,考察了探针PIP-ph-PIP在水相体系中对金属离子的识别情况.分别向淡黄色的探针PIP-ph-PIP水溶液(10μmol/L)中加入K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe3+,Pb2+,Ba2+,Hg2+,Ag+,Cr2+,Cd2+,Co2+,Ni2+和Cu2+(100μmol/L)16种金属离子,静置5 min后,观察探针水溶液的颜色变化.结果表明,16种金属离子中,只有Ag+和Cu2+的加入引起了探针PIP-ph-PIP水溶液的裸眼颜色变化(图S1,见本文支持信息).在Ag+存在下,探针水溶液由淡黄色变为浅褐色,并伴有褐色沉淀生成;在Cu2+存在下,探针水溶液由淡黄色变为浅绿色,并伴有绿色沉淀生成.当其它14种金属离子存在时,未观察到探针PIP-ph-PIP水溶液有明显变化.从探针溶液的颜色和状态变化可以初步推断,探针PIP-ph-PIP在水相体系中能与Ag+和Cu2+发生作用,并快速形成沉淀.
为了进一步明确探针PIP-ph-PIP在水相体系下与Ag+和Cu2+的作用,考察了不同金属离子加入后探针水溶液荧光发射光谱的变化情况,结果如图3所示.以311 nm为激发波长,探针PIP-ph-PIP水溶液在465 nm处发射中等强度荧光.加入Ag+和Cu2+后,探针的荧光强度显著降低,荧光强度分别猝灭为探针单独存在时的1/16和1/12.其它金属离子存在时,探针水溶液的荧光强度只产生了可忽略的微弱变化.荧光发射光谱的变化表明,探针PIP-ph-PIP对Ag+和Cu2+产生了荧光识别作用.从探针溶液裸眼变化情况推断,探针PIPph-PIP可能分别与Ag+和Cu2+形成配位络合物,配位络合物沉淀后从水溶液中析出,导致水溶液中探针分子浓度下降,荧光强度显著降低.此外,探针PIP-ph-PIP中的杂原子与Ag+和Cu2+配位后,在激发态下,探针分子与金属离子(Ag+和Cu2+)之间形成了光诱导电子转移(PET)作用,猝灭了荧光.探针水溶液的裸眼状态变化和荧光光谱的变化说明,探针PIP-ph-PIP对Ag+和Cu2+具有荧光识别性能.

Fig.3 Fluorescent emission spectra of PIP-ph-PIP(10μmol/L)in aqueous solution in presence of the various cations(100μmol/L)a.PIP-ph-PIP;b.PIP-ph-PIP+Cu2+;c.PIP-ph-PIP+Ag+.
探针对金属离子识别的选择性是评价探针识别性能的关键因素.为了验证探针PIP-ph-PIP识别Ag+和Cu2+的选择性,测定了在过量的干扰离子(100μmol/L)存在下,探针PIP-ph-PIP(10μmol/L)识别Ag+和Cu2+(10μmol/L)的荧光发射光谱.图4(A)示出了常见的干扰离子存在时对探针识别Ag+的影响.过量的Cu2+作为干扰离子时,探针PIP-ph-PIP识别Cu2+前后的荧光强度变化程度与Ag+单独存在时相当(猝灭倍数16倍),其它干扰离子也没有影响探针对Ag+的识别,表明探针识别Ag+的荧光强度不受Cu2+及其它离子的干扰.过量的Ag+作为干扰离子时[图4(B)],探针PIP-ph-PIP识别Cu2+时荧光强度的猝灭程度比Cu2+单独存在时猝灭程度更强,猝灭程度与Ag+的单独存在猝灭程度相当(猝灭倍数仍为16倍),说明过量的Ag+会干扰探针PIP-ph-PIP对Cu2+的识别,而表现为探针PIP-ph-PIP对Ag+的识别.上述结果说明,Cu2+和Ag+同时存在时,探针PI-ph-PI可以优先识别Ag+.
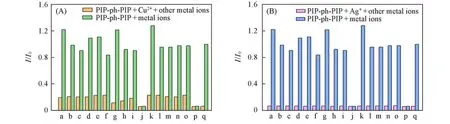
Fig.4 Changes of fluorescent intensities of PIP-ph-PIP(10μmol/L)to recognize Ag+(A)and Cu2+(B)(10μmol/L)in presence of the other interference ions(100μmol/L)a.K+,b.Ca2+,c.Na+,d.Mg2+,e.Al3+,f.Zn2+,g.Fe3+,h.Pb2+,i.Ba2+,j.Ag+,k.Hg2+,l.Cr3+,m.Cd2+,n.Co2+,o.Ni2+,p.Cu2+,q.blank.
此外,考察了水相体系pH值变化对探针PIP-ph-PIP识别Ag+和Cu2+的影响.由探针PIP-ph-PIP溶液(10μmol/L)在不同pH值(2~12)下识别Ag+和Cu2+(10μmol/L)前后的荧光发射强度的变化情况(图S2,见本文支持信息)可见,在2种离子存在下,探针PIP-ph-PIP随pH值改变其荧光强度的变化趋势分别与探针PIP-ph-PIP单独存在时变化趋势类似,说明pH值的变化对探针PIP-ph-PIP识别Ag+和Cu2+没有影响.但探针PIP-ph-PIP的荧光强度受pH变化影响较大.探针在酸性条件下表现为中等强度的荧光,随着溶液碱性的增加,荧光强度逐渐减弱;当溶液的pH≈8.0时,荧光强度下降到最低;pH值继续增大,荧光强度几乎不再变化.上述结果说明,荧光探针PIP-ph-PIP在酸性和弱碱性pH范围内对Ag+和Cu2+识别表现良好,可用于生物环境中Ag+和Cu2+的检测.
在DMF/Hepes(体积比1∶99,pH=7.4)体系中,向探针PIP-ph-PIP溶液(10μmol/L)中逐渐加入Ag+和Cu2+(0~50μmol/L),观察探针的荧光强度变化情况.由图5(A)可见,随着Ag+浓度的增加,探针PIPph-PIP在461 nm处的发射强度逐渐下降,当Ag+浓度达到20μmol/L时,荧光发射强度猝灭到最低值,达到探针荧光强度的1/25;继续增加Ag+浓度,发射强度几乎不再变化.由Ag+浓度变化与探针PIP-ph-PIP荧光衰减(I/I0)变化关系[图5(A)和(B)]可知,Ag+浓度在0~0.1μmol/L范围内,探针PIP-ph-PIP识别Ag+表现出良好的线性关系(R2=0.9978).根据公式cDL=3σ/B(cDL为最低检出限)[28]计算得到探针检测Ag+浓度的检出限为6.1 nmol/L,该值远低于美国环境保护局(US EPA)规定的饮用水中最大水平的Ag+浓度(10 nmol/L).目前文献报道的大多数荧光探针的Ag+检出限均高于50 nmol/L[29~31],检出限在10 nmol/L左右的荧光探针较少[32].因此,本文制备的水相体系中具有超低检出限的Ag+探针PIP-ph-PIP可以用于不同环境中Ag+浓度的定量检测.由图5(C)和(D)可见,在相同的测试体系下Cu2+浓度达到10μmol/L时,荧光强度猝灭为探针单独存在时荧光强度的1/7.Cu2+浓度在0~1μmol/L范围内,探针PIP-ph-PIP识别Cu2+同样具有较好的线性关系(R2=0.9921),检出限为523 nmol/L.上述结果说明,探针PIP-ph-PIP识别Cu2+同样具有较高的灵敏性,并可用于定量分析待测样品的Cu2+浓度.
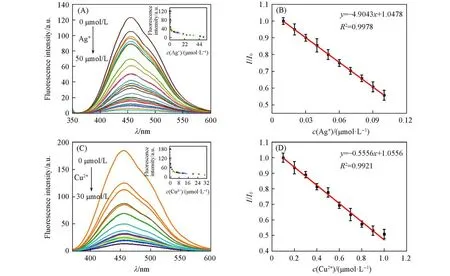
Fig.5 Fluorescent spectra of PIP-ph-PIP(10μmol/L)with the changes of the concentrations of Ag+(A)and Cu2+(C)(0—50μmol/L)and plots of the linear relation about the recognition of PIP-ph-PIP to Ag+(B)and Cu2+(D)Inset of(A):the fluorescence intensity change of PIP-ph-PIP with the increase of Ag+concentration.Inset of(C):the fluorescence intensity change of PIP-ph-PIP with the increase of Cu2+concentration.
根据探针PIP-ph-PIP识别Ag+和Cu2+裸眼观察状态和荧光变化情况,进一步通过Job法[33]考察了探针PIP-ph-PIP与Ag+和Cu2+之间的络合情况(图S3,见本文支持信息).当探针PIP-ph-PIP的摩尔分数为0.66时,荧光强度变化比值(I/I0)均达到最低.计算结果表明,探针PIP-ph-PIP分别与Ag+和Cu2+形成化学计量比为1∶2的络合物,可分别表示为PIP-ph-PIP—Ag+和PIP-ph-PIP—Cu2+.裸眼观察到的褐色沉淀和绿色沉淀也说明了这2个金属络合物的形成.
2.3 络合物PIP-ph-PIP—M在水相体系中的连续识别

Fig.6 Fluorescent spectra of the in-situ complex of PIP-ph-PIP—Ag+(A)and PIP-ph-PIP—Cu2+(B,10μmol/L)in presence of the different anions(A)a.PIP-ph-PIP;b.PIP-ph-PIP—Ag++SCN-;c.PIP-ph-PIP—Ag++other anions.(B)a.PIP-ph-PIP—Cu2++PO34-;b.PIP-ph-PIP;c.PIP-ph-PIP—Cu2++HPO24-;d.PIP-ph-PIP—Cu2++H2PO4-.
这种ON-OFF-ON连续识别效果在自然光和紫外灯照射下裸眼可见.以探针对Ag+和SCN-的连续识别为例,自然光照射下,浅黄色的探针PIP-ph-PIP溶液在Ag+存在时呈浅褐色,连续加入SCN-后溶液恢复到浅黄色[图7(A)];在紫外灯照射下,初始的探针溶液表现为亮蓝色(ON),Ag+存在下探针溶液亮度明显变暗(OFF),蓝色消失,继续加入SCN-溶液亮度恢复(ON),重新呈现蓝色[图7(B)].可见,探针的ON-OFF-ON连续识别效果既可通过荧光光谱也可通过裸眼观察实现.为了确定络合物识别SCN-和的定量关系,通过的浓度滴定,考察了络合物PIP-ph-PIP—Ag+和PIP-ph-PIP—Cu2+连续识别的线性关系(图S4,见本文支持信息).在1~12μmol/L的浓度范围内,络合物PIPph-PIP—Ag+和PIP-ph-PIP—Cu2+荧光强度分别随浓度的增加得到恢复,并具有良好的线性关系,线性偏差分别为R2=0.9957和R2=0.9769,计算得到络合物PIP-ph-PIP—Ag+和PIP-ph-PIP—Cu2+检测的检出限分别为240 nmol/L和169 nmol/L.向探针PIP-ph-PIP溶液中连续加入Ag+和,ON-OFF-ON连续识别效果可重复5次(图S5,见本文支持信息).上述结果表明,探针对的ON-OFF-ON连续识别既可以通过裸眼观察实现定性分析,也可以通过荧光光谱实现定量检测.

Fig.7 Graphs of the subsequent ON-OFF-ON effect of PIP-ph-PIP under the day light(A)and UV lamp(B)(A1,B1)PIP-ph-IP;(A2,B2)PIP-ph-PIP+Ag+;(A3,B3)PIP-ph-PIP+Cu2+.
2.4 细胞成像
为了证明探针PIP-ph-PIP在生物体内对Ag+和Cu2+的响应能力,首先评价了探针PIP-ph-PIP对人宫颈癌HeLa细胞的毒性.毒性测试结果表明,不同浓度(0~50μmol/L)的探针PIP-ph-PIP在HeLa细胞内的成活率均高于85%(图S6,见本文支持信息),说明探针分子的毒性较低,可用于细胞检测,为探针PIP-ph-PIP在活细胞中的荧光成像提供了有力的支持.图8给出探针PIP-ph-PIP在活体HeLa细胞中的成像结果.由图8(B)可见,探针PIP-ph-PIP(10μmol/L)与活体HeLa细胞共同培养时,细胞发射明显的蓝色荧光;将细胞分别用10μmol/L的Ag+和Cu2+处理后再与探针PIP-ph-PIP共同培养时,蓝色的荧光信号明显减弱,当Ag+和Cu2+浓度达到20μmol/L时,几乎观察不到蓝色荧光.这表明探针PIP-ph-PIP在细胞内的毒性较低,在细胞内对Ag+和Cu2+的荧光响应灵敏,可用于细胞内Ag+和Cu2+的检测.

Fig.8 Fluorescent images of HeLa cells treated with PIP-ph-PIP(10μmol/L)for different concentration(10 and 20μmol/L)of Cu2+and Ag+,respectively(A—E)Bright field image;(F—J)dark field image;(K—O)merged image.(A,F,K)PIP-ph-PIP;(B,G,L)PIP-ph-PIP+Cu2+,10μmol/L;(C,H,M)PIP-ph-PIP+Cu2+,20μmol/L;(D,I,M)PIP-ph-PIP+Ag+,10μmol/L;(E,J,O)PIPph-PIP+Ag+,20μmol/L.
2.5 实际水样中Ag+和Cu2+含量的检测
为了验证探针PIP-ph-PIP检测实际水样中Ag+和Cu2+的应用能力,采用自来水、齐齐哈尔劳动湖水和嫩江水(齐齐哈尔段)作为实际待测水样,通过荧光光谱测定了实际水样中Ag+和Cu2+的浓度.所取水样经过滤漂和除杂后,用Hepes溶液(pH=7.4)稀释100倍,加入探针PIP-ph-PIP及不同量的Ag+和Cu2+,记录465 nm处的荧光强度.测定完成后,用标准加入法进行回收实验,测定结果列于表1.水样中Ag+和Cu2+的回收率在93.5%~101.0%之间,误差较小,精密度较高.同样采用玻璃电极法检测了3种水样中Ag+和Cu2+的浓度(表S1,见本文支持信息),发现荧光法检测与玻璃电极法检测结果相差不大,表明探针PIP-ph-PIP可用于实际水样中Ag+和Cu2+定量检测,并具有较高的准确度和精密度.

Table 1 Determination of Ag+and Cu2+concentrations in real water samples by the fluorescence method based on the PIP-ph-PIP probe
3 结 论
设计并合成了一种对称型菲并咪唑荧光探针PIP-ph-PIP,该探针可在水相体系中分别实现对Ag+和SCN-以及的ON-OFF-ON连续识别.识别效果既可以通过裸眼比色观察,也可以通过荧光光谱进行测定.探针PIP-ph-PIP对Ag+识别具有超低检出限(6.1 nmol/L),可用于活体HeLa细胞中Ag+和Cu2+的定性检测,也能实现对实际水样中的Ag+和Cu2+的定量检测.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210089.

