血清25-羟维生素D、中性粒细胞/淋巴细胞比值与乙肝肝硬化的相关性分析
马珺珂,任慧,邢曙光,孙军
(1.锦州医科大学研究生院,辽宁 锦州 121000;2.锦州市中心医院 消化内科,辽宁 锦州 121000)
在我国,由乙型肝炎病毒(hepatitis B virus,HBV)感染引起肝硬化的比例为60%[1]。慢性乙型肝炎在导致肝损伤之后,引发肝脏慢性炎症,激发肝星状细胞,产生胶原纤维,导致细胞外基质大量沉积,引起肝脏纤维化,而肝纤维是一切慢性肝病向肝硬化发展的必经阶段。维生素D 属于类固醇衍生物,是人体必需的脂溶性维生素,它的重要作用表现在血钙、磷代谢,此外维生素D 还有调节免疫、抗炎、抗氧化、抗纤维化等多种生物学功能[2]。维生素D 在肝内活化为25-羟维生素D,被认定是测定维生素D 最可靠的指标。近年研究发现,慢性乙肝肝病患者中普遍存在维生素D 缺乏现象,维生素D 减少会加速肝脏疾病剂进展、增加炎症反应和感染风险,与晚期预后不良有关[3]。中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)是血象中新型炎症指标,既往研究显示NLR 与心血管疾病、自身免疫疾病、肿瘤等密切相关[4-5]。近年来研究显示[6],NLR 与慢性HBV 感染的慢加急性肝衰竭(ACLF)发生、发展密切相关,NLR 越高,ACLF发生率越高,患者预后越差,故可作为慢性乙肝疾病进展、炎症反应的评估指标。因此本研究通过检测慢性乙肝肝硬化患者体内25-羟维生素D、NLR 水平,探究其在疾病中的表达意义,并分析其与Child-Pugh 评分、终末期肝病模型(MELD)评分的关系。同时研究两者之间相关性,为肝硬化的治疗提供新的思路及依据。
1 资料与方法
1.1 研究对象
选取锦州市中心医院2018 年9 月至2020 年6月入院的乙肝肝硬化患者90 例作为实验组,要求患者住院信息完整,同时选取体检中心同期健康体检者70 例作为对照组。再将实验组根据Child-Pugh 分为Child-Pugh A 级、B 级、C 级三组;根据MELD 评分分为A、B、C 组。纳入标准:实验组患者均被明确诊断为乙型肝炎肝硬化,诊断标准符合2015 年中华医学会肝病学分会修订的《慢性乙型肝炎防治指南》[7]中的诊断依据:①病因学明确的HBV 感染证据;②组织学或临床提示肝硬化的证据。排出标准:①合并有其他病毒性肝炎、非酒精性脂肪性肝病(NAFLD)、酒精性肝病、自身免疫性肝病等;②急慢性细菌及病毒感染;③血液系统疾病;④急性心脑血管事件;⑤甲状腺及甲状旁腺疾病;⑥正在服用钙剂或维生素药物以及影响维生素D 代谢药物(抗癫痫药、糖皮质激素);⑦妊娠及哺乳期妇女。所有患者及家属均签署知情同意书,该研究获伦理委员会批准。
1.2 相关定义
1.2.1 MELD 评分计算公式 MELD=3.78×ln(总胆红素mg/dL)+11.2×ln(INR)+9.57×ln(血肌酐mg/dL)+6.43(胆汁性或酒精性肝硬化为0,其余1)计算结果取整数,任何小于1 的数值默认为1,以防评分为负数;适用于≥12 岁的患者。结果范围:MELD 评分≥18 分,高危;MELD 评分14~18 分,中危;MELD 评分≤14 分,低危[8]。
1.2.2 Child-Pugh 评分 Child-Pugh 评分分级,A级:5~6 分;B 级:7~9 分;C 级:≥10 分。具体评分标准,见表1。

表1 Child-Pugh 评分标准
1.2.3 维生素D水平分组 维生素D水平分为4个等级:正常(>30 ng/mL)、不足(20~30 ng/mL)、缺乏(10~20 ng/mL)、严重缺乏(<10 ng/mL)。
1.3 研究方法
记录纳入患者的一般资料,包括年龄、性别、体重指数(BMI)等。所有患者于入组后清晨空腹抽取外周静脉血15 mL,2 h 内送至检验科,采用全自动生化分析仪检测血清中白蛋白(ALB)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆红素(TBIL)、肌酐(Cr)含量;采用全自动凝血分析仪检测凝血酶原时间(PT),国际标准化比值(INR);采用全自动血液细胞分析仪检查白细胞计数(WBC)、中性粒细胞计数(Neu)及淋巴细胞计数(LYM),计算NLR。应用罗氏全自动电化学发光免疫分析仪,使用罗氏公司配套试剂,对受检者的25-羟维生素D 水平进行检测。
1.4 统计学方法
采用SPSS 26.0 软件进行统计学分析,符合正态分布的计量资料进行t检验,以均数±标准差()表示;非正态分布计量资料以中位数(四分位间距)表示,组间比较采用秩和检验;多组间比较运用单因素方差分析,两组间进行LSD、SNK 比较;计数资料采用百分率(%)表示,运用χ2检验;用Spearman 法对25-羟维生素D、NLR与肝功能Child-Pugh 评分、MELD 评分、25-羟维生素D 水平与NLR 进行相关性分析。P<0.05 为差异有统计学意义。
2 结果
2.1 实验组与对照组基本资料与相关指标比较
两组受试者中年龄、性别差异无统计学意义(P>0.05);实验组AST、ALT、PT、TBIL、Cr、NLR、INR 高于对照组,差异有统计学意义(P<0.05);BMI、ALB、白细胞计数、中性粒细胞计数、淋巴细胞计数、25-羟维生素D 低于对照组,差异有统计学意义(P<0.05)。见表2。
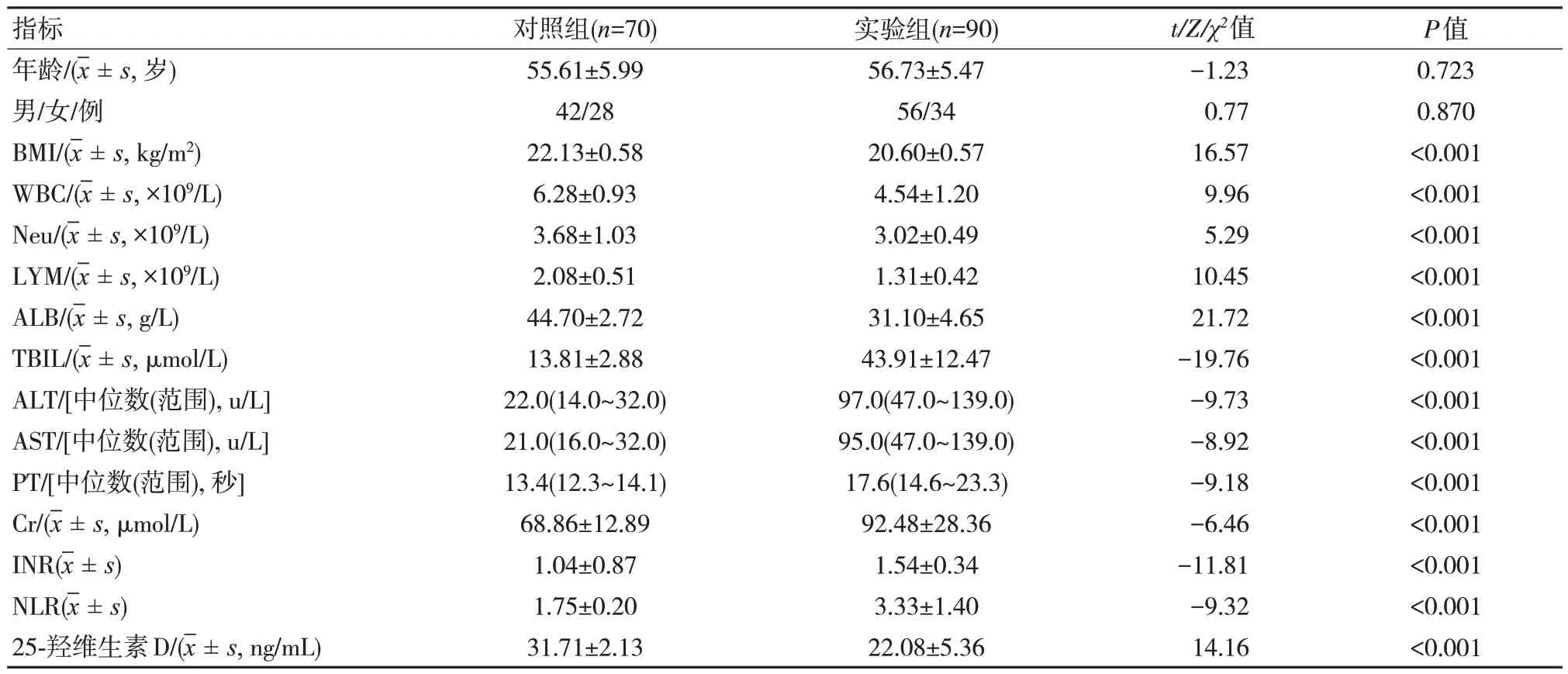
表2 实验组与对照组基本资料与相关指标比较
2.2 Child-Pugh 评分、MELD 评分中25-羟维生素D 水平、NLR 比较
根据肝功能Child-Pugh 评分将实验组分为A级、B 级、C 级,随着肝功能分级的增高,25-羟维生素D 水平降低、NLR 升高,各组间差异有统计学意义(P<0.05),见表3。
表3 不同Child-Pugh 评分中25-羟维生素D 水平、NLR 比较()

表3 不同Child-Pugh 评分中25-羟维生素D 水平、NLR 比较()
根据终末期肝病模型MELD 评分将实验组分为A、B、C 三组,其中MELD 评分≤14 分为A组;MELD 评分14~18 分为B 组;MELD 评分≥18分为C 组,比较三组实验数据,发现,随着MELD评分升高,25-羟维生素D 水平降低、NLR 升高,各组间差异有统计学意义(P<0.05)。见表4。
表4 不同MELD 评分中25-羟维生素D 水平、NLR 比较()

表4 不同MELD 评分中25-羟维生素D 水平、NLR 比较()
2.3 25-羟维生素D 水平、NLR 与Child-Pugh 评分、MELD 评分相关性分析
运用Spearman 相关性分析,发现25-羟维生素D 与肝功能Child-Pugh 评分、MELD 评分呈负相关;NLR 与肝功能Child-Pugh 评分、MELD 评分呈正相关;NLR 与25-羟维生素D 水平呈负相关,见图1。

图1 25-羟维生素D 水平、NLR 与Child-Pugh 评分、MELD 评分相关性分析
3 讨论
肝硬化是一种或多种原因引起的弥漫性进行性慢性肝损害。在我国,目前引起肝硬化的病因以乙肝病毒性肝炎为主。乙肝肝硬化患者由于HBV 感染的持续存在,可导致人体免疫功能失调,此时淋巴细胞无法精准分辨正常细胞与非正常细胞,从而导致肝脏产生炎症反应,晚期肝硬化可被视为是炎症综合征的结果。近年来发现升高的NLR 与肝炎、肝硬化肝癌密切相关,NLR 对于评估肝硬化病情进展具有重要意义,包括代偿期肝硬化、失代偿期肝硬化和终末期肝硬化患者[9-12]。ZHANG 等[4]证明了升高的NLR 与HBV 相关失代偿期肝硬化的严重性相关,可作为预测其1 个月死亡的标志。梁利民等[13]研究发现,NLR≥3.52是预测肝硬化患者1 年内死亡的独立危险因素。本研究发现乙肝肝硬化患者体内NLR 高于健康对照组;且随着Child-Pugh、MELD 评分级别升高,NLR 显著升高,与上述评分呈正相关,差异均有统计学意义(P<0.01),说明NLR 与乙肝肝硬化患者疾病严重程度相关,这与上述研究结果基本一致。目前关于NLR 比值在乙肝肝硬化的发展中作用机制尚不明确,但有研究表明NLR 可能与肝脏“二次打击学说”有关,HBV 能够促进炎症因子的表达,尤其诱导中性粒细胞向肝细胞汇集,进一步损伤肝脏,且终末期肝病患者体内剧烈炎症反应可以导致淋巴细胞大量凋亡,使存集于肝细胞内的中性粒细胞释放血,使NLR 水平升高[14-15]。
近年来还发现25-羟维生素D 水平在慢性乙肝患者体内普遍降低,其中肝硬化患者降低更甚,说明维生素D 的缺乏与慢性肝病进展及肝衰竭严重程度密切相关,有可能成为评估其预后的重要指标。REITER[16]等通过研究硬化性胆管炎小鼠,发现25-羟维生素D 可下调肿瘤坏死因子受体1 和CD11b4细胞的表达,改善肝脏炎症损伤,延缓肝纤维化进程。SUNEETHA 等[17]研究发现维生素D3 受体(VDR)基因多态性是HBV 感染的关键宿主因素,与HBV 患者易感性、病毒持续感染及疾病严重程度密切相关。本研究发现,25-羟维生素D 水平在乙肝肝硬化患者中水平较健康对照组低,且随着Child-Pugh 评分、MELD 评分升高,25-羟维生素D 水平降低,与上述评分呈负相关,差异均具有统计学意义(P<0.01)证明乙肝肝硬化患者维生素D 缺乏程度与疾病进展及肝功能严重程度相关,25-羟维生素D 可作为评估肝硬化病情的重要指标。越来越多研究发现,25-羟维生素D在免疫与炎症反应中发挥重要作用,它可以通过抑制肝星状细胞增殖,抑制细胞周期蛋白及I 型胶原蛋白等的表达发挥抗纤维效应[18],亦可通过介导调节性T 细胞表达,发挥免疫调节作用抑制炎症[19]。目前已知VDR 和1α 羟化酶在中性粒细胞均有表达,这表明25-羟维生素D 可能影响着中性粒细胞的分化、生物合成活性和它的功能[20]。ZHU 等[21]通过对长期缺乏维生素D 膳食的成年小鼠进行研究,发现其血液中肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)、白细胞介素10(IL-10)、单核细胞趋化蛋白-1(MCP-1)等炎症介质升高,转化生长因子β(TGF-β)、金属蛋白酶-13(MMP-13)等纤维化指标也显著增高,肝实质细胞凋亡因子Fas、Fas 配体(FasL)水平增高,而Bcl2、Bclx表达降低,从而证实了维生素D 缺乏可导致机体慢性炎症反应,增加细胞程序性死亡。在本研究中发现,乙肝肝硬化患者体内25-羟维生素D 水平与NLR 呈负相关,NLR 水平升高反映了该病的炎症负担,可能因为维生素D 缺乏,导致肝脏炎症和纤维化的加重,两者共同参与肝硬化的发生发展。然而,本研究存在一定局限性,样本量小,纳入患者存在偏移,而且只探讨了一个炎症指标,应对联合更多的炎症指标进行深入探讨,研究25羟-维生素D 与肝脏炎症反应的相关性。
综上所述,25-羟维生素D 的缺乏,以及NLR的升高均可加重乙肝肝硬化患者的肝脏损伤称度,其中25-羟维生素D 缺少在一定程度上介导肝脏的炎症反应,导致NLR 升高。在临床上,NLR、25-羟维生素D 可作为评估肝脏病变严重程度的指标,适当补充维生素D 可延缓肝病发展进程,但需要更多的研究、大数目的样本量以及长期随访。

