航天黄花菜组织培养繁殖技术研究*
帅娜娜,穆妮妮,张秀丽,黄卫红,任丽娟,颉敏昌△
(1.甘肃省庆阳市农业科学研究院,甘肃 庆阳 745000;2.庆阳市西峰区农业行政综合执法大队,甘肃 庆阳 745000)
黄花菜(Hemerocallis citrina Baroni)属百合科(liliaceae)萱草属,别名萱草、忘忧草、金针菜、健脑草、安神菜等,是一种常见的多年生草本植物[1],在我国已有2000 多年的栽培史,自古以来就是一种美食。黄花菜花蕾呈细长条状,黄色,有芳香气味,具有药食同源的功能[2],不仅含有丰富的蛋白质、糖类、多种维生素、游离氨基酸、黄酮类物质和钙、磷、铁、锌、硒等矿物质元素[3],还具有清热解毒、抗菌消炎、安神补脑、抵抗抑郁、延缓衰老及抗癌抑癌等功效[4]。
黄花菜在我国栽培历史悠久,种质资源丰富,南北各地均有栽植,多分布于中国秦岭以南、甘肃、湖南、江苏、浙江、湖北、江西、四川、陕西、吉林、广东与内蒙古草原等地。庆阳地处黄花菜优生区的核心区,是全球品质最好、面积最大、栽培历史最悠久的黄花菜产区。庆阳黄花菜不仅菜条肥大,色泽黄亮,而且还具有肉质厚嫩,久煮不烂的特点。被列为国家农产品地理标志保护产品。
航天诱变育种是将空间技术与常规农业育种相结合,利用空间的特殊环境,使种子或其他植物体产生遗传变异,返回地面种植,获得有益突变体,选育新品种的植物育种技术[5]。我国的航天育种走在世界前列,在农作物育种方面已取得了重要的成果,至目前已通过国家、省级审定或鉴定的品种有200 多个。黄花菜的航天育种起步较晚,发展相对落后,现在还未见成熟报道。
2019 年6 月-2020 年7 月,采用组织培养法扩繁航天黄花菜新品种金蕾二号种苗,试验对金蕾二号外植体采集、消毒,继代培养基、生根培养基配方,培养基灭菌,接种,炼苗,移栽大田等环节做了研究,现将结果报告如下:
1 材料与方法
1.1 试验时间、地点
本试验于2019 年6 月-2020 年7 月在庆阳市农业科学研究院组培室进行。
1.2 试验材料
庆阳市农业科学研究院自主选育的航天黄花菜新品种金蕾二号。
1.3 试验仪器
生物安全柜(上海力申科学仪器有限公司生产,型号:HFsafe-1200LC)、全自动立式压力蒸汽灭菌锅(上海博迅实业有限公司生产,100 L)、接种器械灭菌器(济南格艾特仪器设备有限公司)、紫外线灯、酒精灯。
1.4 试验方法
1.4.1 外植体消毒
1)幼蕾花丝:将采集的金蕾二号幼小花蕾(长度6 cm 以下),用流水冲净晾干,在无菌条件下,用70%乙醇浸10~20 s,超纯水冲洗3 次,晾干,再用0.1%氯化汞浸8~10 min,超纯水冲洗7 次,用灭菌滤纸吸干水分,撕开花瓣,取出花丝,用无菌剪刀将其剪成长约0.5 cm 的小段。
2)根状茎:将新挖的金蕾二号植株置于自来水下,小水冲洗2~3 h,用毛刷轻轻刷洗叶片及根系间的泥土,洗净后除去根系,剥离外层叶片,保留根状茎上部3~4 cm,晾干。在无菌条件下,用70%酒精浸30 s,超纯水冲洗3 次,再用0.1%升汞加0.02%吐温溶液浸泡5 min,超纯水冲洗7 次,灭菌滤纸吸干水分,手术刀剥去剩余叶片,切取茎尖0.2~0.5 cm。
1.4.2 诱导培养及外植体的选择
将黄花菜幼蕾花丝和根状茎分别接种在诱导培养基上,经过40 d 的培养,统计不同外植体诱导分化情况,选择最佳外植体。诱导培养基为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L,pH5.8~6.0,培养条件为温度25 ℃~28 ℃,光照度2000~2500 lx,光照时间16h。
1.4.3 继代培养
将诱导培养产生的愈伤组织,分割成0.6~1.5 cm 的小块,接入继代培养基中进行增殖培养。继代培养基1 为MS 培养基粉(不含糖和琼脂)4.74 g+琼脂5.5 g/L+6-BA 4.0 mg/L+NAA0.1 mg/L+蔗糖3%;继代培养基2 为MS 培养基粉(不含糖和琼脂)4.74 g+琼脂5.5 g/L+6-BA 0.5 mg/L+IBA0.2 mg/L+蔗糖3%。每瓶接种4 个单芽,重复3 次。培养温度25 ℃~28 ℃,光照度2000~2500 lx,光照时间16 h。经过30 d 的培养,随机选出30 瓶统计愈伤组织、芽丛、无根苗(高3cm、6 片叶以上)增殖情况。
1.4.4 生根培养
金蕾二号继代培养生成的无根苗高约3 cm,叶6 片以上时,接入不同激素的1/2MS 生根培养基,生根培养基1 为1/2MS 培养基粉(不含糖和琼脂)2.47 g+琼脂5.5 g/L+NAA0.2 mg/L+蔗糖3%,生根培养基2 为1/2MS 培养基粉(不含糖和琼脂)2.47 g+琼脂5.5 g/L+IBA0.2 mg/L+蔗糖3%。培养温度25~28℃,光照度2000~2500 lx,光照时间16 h。经过30 d的培养,观察生根情况。
1.4.5 炼苗
无根苗在生根培养基上生根2 条以上时,使生根苗逐步接受自然光照、与外界交换空气、适应较低湿度的环境,直至具备在自然环境中生存的能力,炼苗完成。
组培苗经过30d 炼苗,高度达到10cm 以上,根状茎直径0.6 cm 以上,肉质根2 条以上,生长健壮,定植大田。大田等行栽植,行距0.85m,株距0.40 m。
2 结果与分析
2.1 外植体的选择
经过40 d 的诱导培养,不同外植体诱导频率统计见表1。据结果可以看出,花丝、根状茎尖两类外植体接入诱导培养基中均可诱导产生愈伤组织,金蕾二号幼蕾的花丝接入诱导培养基,7 d 花丝膨大,萌动3 个,15 d 有31 个花丝基部长出黄色愈伤组织,40 d 愈伤组织达到46 个,逐渐变绿分化增多,进入高峰,诱导愈伤率为76.67%;根状茎尖作为外植体接入诱导培养基,7 d 根状茎尖膨大,萌动1个,15d 有19 个根状茎尖基部长出黄色愈伤组织,40d 愈伤组织变绿分化增多,达到28 个,同时长出许多新生芽点,诱导愈伤率为46.67%。综上,可选黄花菜幼蕾花丝为最佳外植体。

表1 外植体诱导频率统计表
2.2 继代培养
选取继代培养的黄花菜无菌苗,接种于含不同浓度6-BA、NAA、IBA 的培养基中,增值情况见表2。结果表明,20 d 继代培养基1、继代培养基2 都能产生大量淡绿色外观呈不规则的颗粒状胚性愈伤组织,继代培养基1 愈伤组织增殖快,30 d 愈伤组织增殖3.1 倍。继代培养基2 萌发芽丛41 个,生成无根苗23 个。继代培养基1 适合金蕾二号愈伤组织增殖培养,继代培养基2 适合金蕾二号分化胚性愈伤组织,生成芽丛,长出无根苗。试验中还观察到,金蕾二号花丝诱导愈伤过程中,初次出现的愈伤组织越紧实,表面有小颗粒状分布的,则增殖及生成芽丛的能力就越强,而诱导的愈伤组织越松散则再生能力越差。

表2 继代培养基愈伤组织增殖统计表
2.3 生根培养
采用添加NAA、IBA 两种不同激素的生根培养基,生根情况见表3。结果表明,生根培养基1 接种18 d 从无根苗的根状茎上萌发出白色乳状凸起4个,30 d 有113 个苗生根,共生根267 条,无根苗生根率75.33%。生根培养基2 接种18 d 从无根苗的根状茎上萌发出白色乳状凸起1 个,30 d 有99 个苗生根,共生根299 条。两种生根培养基都能促进生根,生根培养基1 培养的植株叶片宽大、苗较健壮,生根快;生根培养基2 生根数较多、根较粗长、根系发达。30 d 后,根数继续增加,根系继续扩大。当无根苗生根2~3 条以上时,植株叶片增多,根部肥大,植株生长旺盛,开始炼苗。
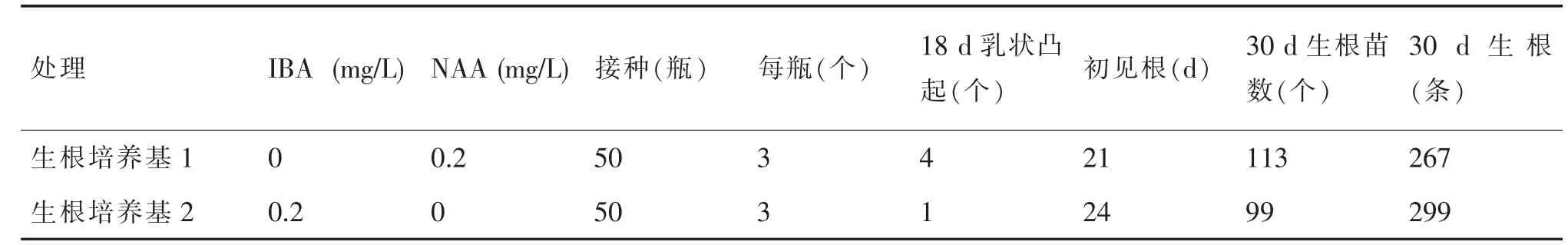
表3 生根培养基生根统计表
2.4 炼苗
(1)使用80%多菌灵300~500 倍液均匀喷雾处理宁夏中青生物科技有限公司生产的育苗基质,加水湿透至育苗基质手握成团,捏不出水分,装入直径10cm 的营养钵,每钵栽入1 株2 条根系以上,植株叶片宽大、生长健壮的组培苗,立即放入小拱棚,保持温度25~28℃、相对湿度55%~80%,逐步接受阳光照射。栽入155 株带根组培苗进行炼苗,11d 后将组培苗移出小拱棚时,死亡76 株,存活79 株。日光温室内整好练苗用地,开沟,铺放处理的育苗基质,栽入苗子,沿苗子两侧撒入处理过的育苗基质,压实,轻浇薄水。7 d 内及时补水。10d 后全部死亡。
(2)日光温室内开沟,铺放用80%多菌灵300~500 倍液处理的育苗基质,将130 株2 条根系以上,叶片宽大、生长健壮的组培苗,从培养瓶移出,冲去根部培养基基质,栽入育苗基质之上,沿苗子两侧撒入处理过的育苗基质,压实,轻浇薄水,加盖遮阳网。移栽7d 内及时补水,保持小环境具有较高的空气湿度,减少叶面的水分蒸发,当外围老叶枯死,新叶长出后,逐渐降低湿度,减少喷水次数,10d 后仅存活1 株,存活率不足1%。
(3)将生根2 条以上的生根苗,连同培养瓶置于自然光照环境,第1 天接受自然光照1h,以后每天增加20 min,逐步适应自然光,7d 后解开封口绳,再过2 d,将封口膜上移,使瓶内组培苗能与外界进行空气交换,适应较低湿度的环境,7d 后将封口膜去掉,张开瓶口,置于日光下10 d,炼苗完成,移栽大田。大田挖小坑,喷施80%多菌灵300~500 倍液,进行土壤消毒,栽入苗子,沿苗子两侧撒入处理过的育苗基质,压实,轻浇薄水,加盖遮掩网遮光,视土壤墒情及时用喷雾器补水。栽植7d 后去掉遮掩网,喷洒0.1%尿素水溶液1 次、喷雾80%多菌灵300~500 倍液1 次,然后每10d 喷1 次。栽植生根苗2216 株,成活1319 株,成活率在59.52%。
(4)将组培苗生根2 条以上的培养瓶,解开封口绳置于培养室,2d 后将封口膜上移,7 d 后将封口膜去掉,张开瓶口,组培苗能与外界交换空气,适应较低湿度的环境,10d 后使用80%多菌灵300~500倍液均匀喷雾处理育苗基质,加水湿透至育苗基质手握成团,捏不出水分,装入6cm×6cm32 孔或4.5cm×4.5cm50 孔育苗盘,在培养室经过10d 过渡,期间,死亡13 株,10d 后将育苗盘移入自然光照环境,第1d 接受自然光照1h,以后每天增加20 min,逐步适应自然光照和有菌环境,7d 后,又死亡27株,炼苗期间共死亡40 株,死亡率48.78%。存活42株移栽大田。大田挖小坑,喷施80%多菌灵300~500倍液,进行土壤消毒,栽入苗子,壅土压实。轻浇薄水,视土壤墒情及时用喷雾器补水。栽植7 d 后喷洒加入0.1%尿素的水溶液1 次、喷雾80%多菌灵300~500 倍液1 次,然后每10 天喷1 次,10d 后,成活19 株。成活率23.17%。
由表4 可以看出,金蕾二号炼苗成活率低,驯化难度大。采用方法(3)炼苗成活率相对较高,但也只有59.52%。航天黄花菜组培苗与传统品种黄花菜品种组培苗相比生长势较弱,更容易死亡。

表4 炼苗成活率统计表
2.5 大田区域试验示范
在位于合水县固城镇高台村合水县鑫庆丰黄花菜农民专业合作社基地栽植金蕾二号组培苗试验示范田1330 m2。试验用苗经过大田生长50 d 以上,根状茎直径0.8 cm 以上,肉质根3 条以上,生长健壮。栽植时将地上叶片剪短至3~5 cm,行距0.85m,株距0.40 m。共栽植3900 株,成活3889 株,成活率99.71%。经过炼苗存活下来的金蕾二号组培苗,栽植大田后抵抗力提高,与其他黄花菜品种无差异。
3 讨论与结果
1)金蕾二号组培苗再生系统的生长周期明显,花丝接入诱导培养基经过萌动膨大,诱导出黄色愈伤组织,继代增殖培养形成芽丛,长出无根苗,无根苗在生根培养基中萌发出根系。不同炼苗方法成活率差异很大,需要进一步探索。
2)本研究结果表明,金蕾二号通过反复继代增殖培养,可达到大量繁殖的目的。黄花菜以花丝为外植体进行组培快繁,可采用诱导培养基MS+6-BA1.0mg/L+NAA0.1mg/L、继代培养基MS 培养基粉(不含糖和琼脂)4.74g+琼脂5.5g/L+6-BA 4.0mg/L+NAA0.1mg/L+3%和MS 培养基粉(不含糖和琼脂)4.74g+琼脂5.5g/L+6-BA 0.5mg/L+IBA0.2mg/L+3%蔗糖;生根培养基1/2MS 培养基粉(不含糖和琼脂)2.47g+琼脂5.5g/L+NAA0.2mg/L 或1/2MS 培养基粉(不含糖和琼脂)2.47g+琼脂5.5g/L+IBA0.2mg/L 的组织培养再生系统。
3)金蕾二号黄花菜组培苗生长势弱,炼苗难度大,成活率低。金蕾二号炼苗中存活的组培苗,抵抗能力不断提高,移栽到大田后与其他黄花菜品种无差异。

