半夏泻心汤调控Shh信号通路对BMSCs外泌体诱导的人胃癌细胞BGC-823增殖的影响
崔国宁,刘喜平,李沛清,王庆苗,戴丽蓉,王宇,朱中博,董俊刚
半夏泻心汤调控Shh信号通路对BMSCs外泌体诱导的人胃癌细胞BGC-823增殖的影响
崔国宁,刘喜平,李沛清,王庆苗,戴丽蓉,王宇,朱中博,董俊刚
甘肃中医药大学,甘肃 兰州 730000
观察半夏泻心汤对骨髓间充质干细胞(BMSCs)外泌体诱导的人胃癌细胞BGC-823增殖的影响,探讨其相关作用机制。利用Transwell小室将BMSCs外泌体与BGC-823细胞进行非接触共培养,实验分为空白组、模型组、阳性对照组和半夏泻心汤高、中、低剂量组,荧光染料Dil标记BMSCs外泌体,激光共聚焦显微镜观察BGC-823细胞对BMSCs外泌体的摄取,计算平均光密度(MOD);实时无标记细胞分析技术检测细胞增殖;流式细胞术检测细胞周期;RT-qPCR检测Shh、Ptch1、Smo、Gli1及C-myc mRNA的表达。与空白组比较,模型组细胞内可见大量红色荧光标记,MOD值显著增加(<0.05);模型组20~50 h细胞指数(CI)显著增加(<0.05),G1、G2期细胞比例降低,S期细胞比例升高(<0.05),Shh、Smo、Ptch1、Gli1及C-myc mRNA表达显著升高(<0.05);与模型组比较,半夏泻心汤各剂量组红色荧光标记减弱,其中半夏泻心汤高、中剂量组MOD值明显减少(<0.05),半夏泻心汤各剂量组20~50 h CI显著减少(<0.05),G1、G2期细胞比例升高,S期细胞比例降低(<0.05),Shh、Smo、Ptch1、Gli1及C-myc mRNA表达显著降低(<0.05)。半夏泻心汤可抑制BMSCs外泌体诱导的BGC-823细胞增殖,其机制可能与下调Shh、Smo、Ptch1、Gli1及C-myc mRNA表达,抑制Shh信号通路有关。
半夏泻心汤;人胃癌细胞;骨髓间充质干细胞;外泌体;Shh信号通路
胃癌是常见的恶性肿瘤,居全球肿瘤性死亡病因的第2位[1]。研究发现,胃癌发生发展与骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)有关[2]。胃癌前病变期,BMSCs可归巢至胃黏膜部,参与胃黏膜修复,与胃上皮细胞融合转化为胃癌细胞[3]。胃癌发生后,BMSCs可归巢至肿瘤部位,成为肿瘤微环境的重要细胞成分[4],促进肿瘤的生长[5]。课题组前期研究表明,胃癌微环境中BMSCs可恶性转化,有明显促瘤作用[6-7]。外泌体是微环境中细胞间传递生物信息物质的重要载体,肿瘤微环境中BMSCs能分泌更多外泌体[8],BMSCs促进胃癌细胞增殖与其外泌体具有明显相关性[9]。Shh信号通路是影响细胞增殖分化的关键信号通路,而BMSCs外泌体可激活Shh信号通路,促进肿瘤细胞生长增殖[10]。但BMSCs外泌体促进胃癌细胞生长增殖机制仍不十分清楚。课题组前期研究表明,半夏泻心汤对胃癌荷瘤裸鼠有明显抑瘤作用[11],也可抑制人胃癌细胞BGC-823增殖[12-13],同时对胃癌微环境中BMSCs的恶变促瘤有明显抑制作用[14]。本研究旨在观察半夏泻心汤对胃癌细胞摄取BMSCs外泌体的影响,探讨半夏泻心汤调控BMSCs外泌体诱导的胃癌细胞增殖的作用机制,以期揭示其防治胃癌的新靶标。
1 实验材料
1.1 动物及细胞株
8周龄雄性SD大鼠40只,SPF级,体质量180~220 g,甘肃中医药大学动物实验中心提供,动物生产许可证号SCXK(甘)2015-0002,动物使用许可证号SYXK(甘)2019-0002。大鼠饲养于温度23~25 ℃、相对湿度40%~60%的SPF级实验室。本研究涉及动物的实验均经甘肃中医药大学实验动物伦理委员会审查批准(2018-009)。BGC-823细胞,重庆威斯腾生物科技公司提供。大鼠BMSCs来源外泌体,重庆威斯腾生物科技公司提取鉴定,浓度为100 μg/mL。
1.2 药物
半夏泻心汤(法半夏12 g,干姜9 g,黄芩9 g,黄连3 g,人参9 g,大枣4枚,甘草9 g),饮片购自甘肃中医药大学附属医院中药房,按原方称取饮片,混合并浸泡30 min,煎煮2次,第1次加8倍量水,煎煮1.5 h,第2次加6倍量水,煎煮1 h,合并煎液离心,过滤,滤液减压分别浓缩至含原药材2.700、1.350、0.675 g/mL,得半夏泻心汤高、中、低剂量汤剂。
1.3 主要试剂与仪器
胎牛血清、无外泌体血清、DMEM高糖培养基,美国Gibco公司,货号分别为HLC0101、10828-028、11995-065;MTT试剂盒,英国Abcam公司,货号20140165;DAPI染色液,上海碧云天生物科技有限公司,货号C1005;细胞膜红色荧光探针(Dil),美国Sigma公司,货号41085-99-8;GANT 61,美国MCE公司,货号HY-13901;DEPC,美国Sigma公司,货号D5758;RNA提取试剂盒,日本Takara公司,货号9767;引物、RT-PCR试剂盒、SYBR GREEN Ⅰ,重庆威斯腾生物科技公司。荧光倒置显微镜(日本Nikon公司,型号ECLIPSE Ti-s),流式细胞检测仪(美国Beckman公司,型号CYTOFLEX),细胞功能分析仪、检测板(美国xCELLigence公司),0.4 μm、8 μm Transwell小室(美国Costar公司),实时荧光定量PCR仪(美国ABI StepOne Plus公司,型号Stepone plus),电泳仪(美国Bio-Rad公司,型号DYCP-3I DN),Tanon 2500R凝胶成像仪(上海Tanon公司),CO2培养箱(日本三洋公司)。
2 实验方法
2.1 半夏泻心汤药物血清制备
参考前期研究方法造模[15],大鼠常规适应性饲养1周,按随机数字表法分为正常组及半夏泻心汤高、中、低剂量组,每组8只,实验前禁食不禁水12~24 h。按人与动物体表面积折算等效剂量,半夏泻心汤高、中、低剂量组分别给予相应剂量汤剂灌胃,每次2 mL,每日2次。正常组给予等体积生理盐水灌胃,连续2周。末次灌胃后1 h,大鼠麻醉开腹,腹主动脉收集全血,静置分层后3 000 r/min离心10 min,收集血清,于56 ℃水浴灭活30 min,经0.22 µm微孔滤膜过滤除菌,分装,-20 ℃冰箱保存备用。
2.2 MTT法筛选半夏泻心汤药物血清最佳浓度
将BGC-823细胞以5×104个/孔接种至96孔培养板中,每孔100 μL,同时每孔加入0.1 mL浓度为100 μg/mL的BMSCs外泌体,分别设空白对照组及5%、10%、15%半夏泻心汤高剂量药物血清组,每组3个复孔,培养箱中培养24 h,分别加入含正常对照血清及5%、10%、15%半夏泻心汤高剂量药物血清的培养液,继续培养24、48、72 h,每孔加入100 μL MTT(5 mg/mL),37 ℃孵育4 h,吸去上清液,每孔加入200 μL DMSO,震荡10 min,酶标仪参比波长设为620 nm,测定波长495 nm处各孔OD值,计算细胞存活率。细胞存活率(%)=药物血清组OD值÷空白对照组OD值×100%。每个样品计数4次并进行统计学处理。通过细胞存活率计算半数抑制浓度(IC50),确定半夏泻心汤药物血清的最佳浓度。
2.3 分组及共培养体系建立
利用Transwell小室将BMSCs外泌体与BGC-823细胞进行非接触共培养。实验分为空白组、模型组、阳性对照组和半夏泻心汤高、中、低剂量组。各组上室加入1.5 mL BGC-823细胞悬液(2×105个/mL,DMEM培养基∶双抗=90∶1),模型组及空白组上室加10%正常对照血清,半夏泻心汤高、中、低剂量组上室分别加对应的10%药物血清,阳性对照组上室加含20 μmol/L GANT 61(Shh通路阻断剂)的10%正常对照血清。下室加无外泌体血清培养液(DMEM培养基∶无外泌体血清∶双抗=90∶10∶1),模型组、阳性对照组和半夏泻心汤高、中、低剂量组下室加100 μg/mL的BMSCs外泌体1 mL。培养48 h后收集细胞,进行相关检查。
2.4 BGC-823细胞摄取骨髓间充质干细胞外泌体观察
采用荧光活性染料Dil标记BMSCs外泌体。将BMSCs外泌体与Dil按1 000∶1比例混合,避光放置30 min,100 000×、4 ℃离心90 min,PBS重悬后再次超速离心,弃上清液,获得Dil标记的BMSCs外泌体,加入“2.3”项下模型组、阳性对照组和半夏泻心汤高、中、低剂量组下室内,继续培养48 h。取BGC-823细胞,吸弃培养液,4%多聚甲醛固定,PBS清洗,常温爬片15 min,PBS洗3次×10 min;滴加DAPI染液,避光孵育15 min,PBS洗4次,每次5 min;抗荧光淬灭剂封片,激光共聚焦显微镜观察细胞内红色荧光表达,并用Image Pro Plus 6.0软件分析红色荧光的平均光密度(MOD)。
2.5 BGC-823细胞增殖水平检测
取“2.3”项下共培养48 h的BGC-823细胞,消化成细胞悬液,移至离心管,1 000 r/min离心5 min,弃上清,调整细胞密度为1×105个/mL,备用。设置细胞功能分析仪程序:进行基线测量后,每隔10 min检测1次细胞指数(CI),记录细胞生长过程。在E-Plate 16检测板孔中加50 µL培养基,将检测板置于工作站上进行系统扫描,取出检测板,孔中分别加入各组BGC-823细胞,数量为2 000个/孔,置于超净台中室温放置30 min,将检测板放到培养箱中,工作站上实时动态检测约50 h,观察BGC-823细胞增殖水平,并计算CI值。
2.6 BGC-823细胞生长周期检测
取“2.3”项下共培养48 h的BGC-823细胞,消化成细胞悬液,将细胞悬液移至离心管,2 000 r/min离心5 min,PBS洗2次,相同条件下再次离心后,调整细胞密度为1×105个/mL,4 ℃预冷后置于70%乙醇中固定过夜,随后1 000 r/min离心5 min,加1 mL预冷的PBS重悬细胞,再次离心后弃上清,各组加4.7%PI染液0.5 mL,重悬细胞后,37 ℃温浴30 min,4 ℃避光存放,流式细胞术检测BGC-823细胞生长周期,计算G1、G2、S期细胞比例。
2.7 RT-qPCR检测BGC-823细胞Shh、Ptch1、Smo、Gli1及C-myc mRNA表达
取“2.3”项下共培养48 h的BGC-823细胞,PBS洗1次,4 ℃、8 000×离心2 min,弃上清,细胞中加入适量Buffer RL,采用RNA提取试剂盒提取总RNA,随后合成cDNA。反转录条件:30 ℃、10 min,42 ℃、60 min,95 ℃、5 min,冰上冷却。扩增条件:50 ℃、2 min,95 ℃、2 min,95 ℃、2 s,60 ℃、1 min,循环40次。采用2-ΔΔCt法计算mRNA相对表达量。引物序列由重庆威斯腾生物科技公司合成,见表1。
表1 各基因PCR引物序列
基因名称引物序列(5’~3’)产物长度/bp GAPDHF:AGATCCCTCCAAAATCAAGTGG252 R:GGCAGAGATGATGACCCTTTT ShhF:ATGACTCAGAGGTGCAAAGACAAG206 R:CCACGGAGTTCTCTGCTTTCA Ptch1F:CCATTTCTTGCCCTTGGTGT 82 R:TCCTCTTATTCTGTCCCGTTTCA SmoF:GCCTTGATGGCTGGAGTAGTGT120 R:GAGCAGGTGGAAATAGGATGTCTT Gli1F:CTCGACCTGCAAACCGTAATC223 R:GAAGCATCATTGAACCCTGAGTAG C-mycF:CCTCCCGCTGACCCAACAT112 R:TGTCCTGGCTCGCAGATTGT
3 统计学方法
4 结果
4.1 半夏泻心汤药物血清最佳浓度筛选
与空白组比较,各浓度半夏泻心汤高剂量药物血清组BGC-823细胞存活率明显下降(<0.05,<0.01)。第48 h,10%半夏泻心汤高剂量药物血清组BGC-823细胞存活率接近50%,故将10%半夏泻心汤药物血清浓度作为最佳浓度进行后续实验。结果见表2。
4.2 半夏泻心汤对BGC-823细胞摄取骨髓间充质干细胞外泌体的影响
与空白组比较,模型组BGC-823细胞内可见大量红色荧光标记,MOD值显著增加(<0.05);与模型组比较,半夏泻心汤高、中、低剂量组BGC-823细胞内红色荧光标记减弱,MOD值减少,其中半夏泻心汤高、中剂量组最显著(<0.05)。见图1、表3。
表2 不同浓度半夏泻心汤高剂量药物血清对不同时点BGC-823细胞存活率的影响(±s)
注:与空白组比较,*<0.05,**<0.01
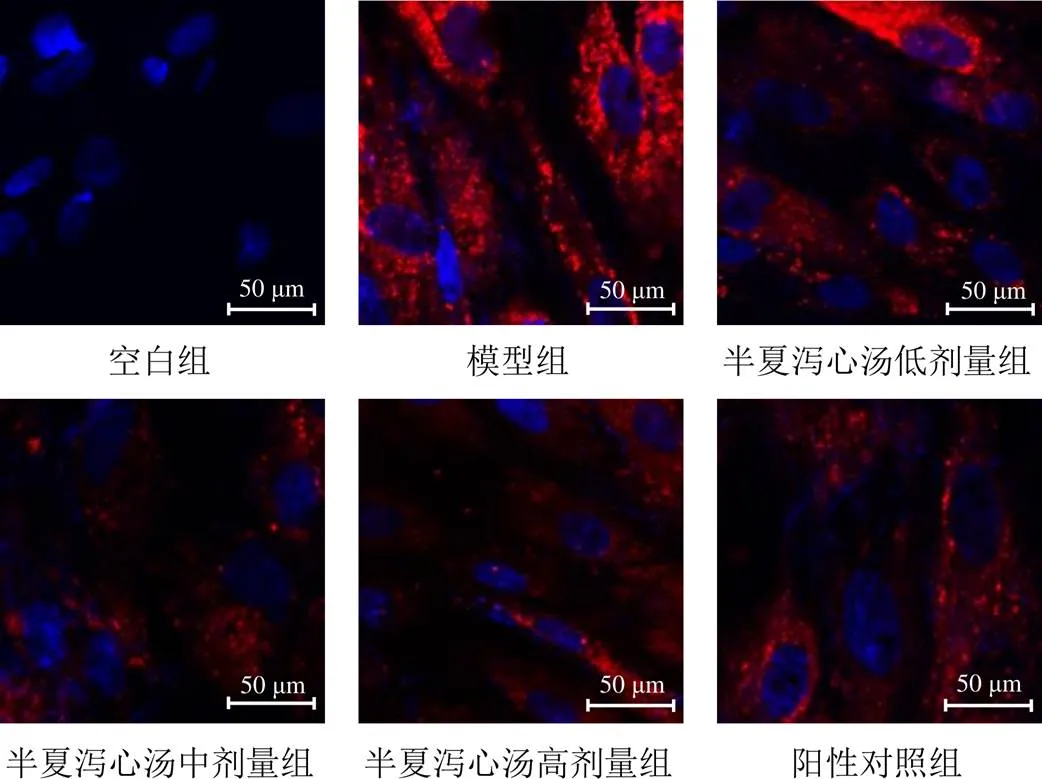
图1 各组BGC-823细胞摄取BMSCs外泌体形态
表3 各组BGC-823细胞摄取BMSCs外泌体水平比较(±s)
注:与空白组比较,#<0.05;与模型组比较,*<0.05;与半夏泻心汤低剂量组比较,△<0.05
4.3 半夏泻心汤对BGC-823细胞增殖水平的影响
0~20 h,各组BGC-823细胞CI无明显变化(>0.05)。20~50 h,与空白组比较,模型组BGC-823细胞CI显著增加(<0.05),与时间呈正相关(2=0.952 8);与模型组比较,半夏泻心汤高、中、低剂量组BGC-823细胞CI均显著减少(<0.05),其中半夏泻心汤高剂量组最显著。见图2。

图2 各组BGC-823细胞增殖水平比较
4.4 半夏泻心汤对BGC-823细胞生长周期的影响
与空白组比较,模型组G1、G2期细胞比例降低,S期细胞比例明显升高(<0.05);与模型组比较,半夏泻心汤高、中、低剂量组G1、G2期细胞比例明显升高,S期细胞比例明显降低(<0.05);与半夏泻心汤低剂量组比较,半夏泻心汤高剂量组S期细胞比例明显降低(<0.05)。见表4、图3。
表4 各组BGC-823细胞生长周期比较(±s,%)
注:与空白组比较,*<0.05;与模型组比较,#<0.05;与半夏泻心汤低剂量组比较,△<0.05

图3 各组BGC-823细胞生长周期检测
4.5 半夏泻心汤对BGC-823细胞Shh、Smo、Ptch1、Gli1、C-myc mRNA表达的影响
与空白组比较,模型组BGC-823细胞Shh、Smo、Ptch1、Gli1、C-myc mRNA表达明显升高,差异有统计学意义(<0.05);与模型组比较,半夏泻心汤高、中、低剂量组BGC-823细胞Shh、Smo、Ptch1、Gli1、C-myc mRNA表达明显降低(<0.05);与半夏泻心汤低剂量组比较,半夏泻心汤高、中剂量组BGC-823细胞Shh、Gli1 mRNA表达明显降低(<0.05),半夏泻心汤高剂量组BGC-823细胞Smo、Ptch1、C-myc mRNA表达明显降低,差异有统计学意义(<0.05)。见表5。
表5 各组BGC-823细胞Shh、Smo、Ptch1、Gli1、C-myc mRNA表达比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05;与半夏泻心汤低剂量组比较,△<0.05
5 讨论
肿瘤微环境是由肿瘤细胞、基质细胞(间充质干细胞、成纤维细胞等)、细胞外基质及生长因子、细胞因子及其他小分子等共同构成的复杂动态环境系统[16]。研究表明,肿瘤微环境中的非肿瘤细胞及非细胞成分在调控肿瘤发生发展及侵袭转移中起关键作用[17]。BMSCs参与肿瘤微环境的构成,是肿瘤微环境中的重要非细胞成分之一[18]。
既往研究认为,肿瘤微环境中的各种细胞通过产生多种生长因子和蛋白水解酶调节细胞外基质微环境,或激活肿瘤基质细胞而活化肿瘤基质,活化的肿瘤基质细胞可分泌多种细胞因子,通过体液弥散方式直接作用于肿瘤细胞。但随着研究深入,发现肿瘤微环境中的外泌体在介导肿瘤细胞与基质细胞间信号传输,促进肿瘤发展恶化方面具有重要作用[19]。外泌体可富集、包裹细胞外的miRNA、mRNA、蛋白质、细胞因子等多种生物信息物质,并保护其免受环境降解,从而将生物信息物质以胞吞的形式传递至受体细胞,并被受体细胞摄取、内化后激活胞内信号通路对受体细胞进行多途径、多位点的精细调节[20]。本研究表明,BMSCs来源的外泌体能被BGC-823细胞摄取,提示BGC-823细胞是BMSCs外泌体的靶细胞之一。
Shh信号通路主要由sonic hedgehog配体(Shh)、跨膜受体蛋白Patched 1和Patched 2(Ptch1、Ptch2,主要为Ptch1)、G蛋白偶联受体样蛋白Smoothened(Smo)及下游核转录因子蛋白Gli(Gli1、Gli2和Gli3,主要为Gli1)组成。生理情况下,Shh信号通路处于失活状态,可维持细胞稳态及其正常分化增殖。而异常激活的Shh信号通路通过激活下游癌基因,造成细胞过度增殖[21]。Shh信号通路的激活起始于Shh与Ptch1的结合,进而激活Smo,诱导转录因子蛋白Gli1表达。Gli1是hedgehog信号通路激活的重要标志,可进一步激活下游C-myc等靶标基因[22]。C-myc为8号染色体癌基因,是肿瘤细胞过度增殖恶化的重要标志[23]。本研究结果显示,BGC-823细胞摄取BMSCs外泌体后Shh信号通路Shh、Ptch1、Smo、Gli1及C-myc mRNA水平升高,提示细胞生长增殖能力明显增强;而以Shh信号通路阻断剂GANT 61(阳性对照组)干预后,Shh、Ptch1、Smo、Gli1及C-myc mRNA水平明显下降,表明BGC-823细胞生长增殖能力明显减弱,从而说明激活Shh信号通路能促进BGC-823细胞生长增殖。
胃癌属中医学“积聚”“反胃”等范畴。半夏泻心汤出自《伤寒杂病论》,方中法半夏、干姜辛开以化痰散结,黄连、黄芩苦降以清解癌毒,人参、大枣、甘草甘补健脾补虚。全方辛开、苦降、甘补配伍,兼顾虚实,共奏健脾补虚、化痰散结、清解癌毒之功。本研究结果表明,半夏泻心汤能抑制BMSCs外泌体诱导的BGC-823细胞生长增殖,下调Shh信号通路Shh、Ptch1、Smo、Gli1及C-myc mRNA表达,提示半夏泻心汤抑制BMSCs外泌体诱导的BGC-823细胞增殖与阻断Shh信号通路有关。
本研究从外泌体途径初步阐明了BMSCs促进胃癌恶化进展的机制,揭示了半夏泻心汤抑制BGC-823细胞增殖的新靶标及作用机制。至于BGC-823细胞摄取BMSCs外泌体后对细胞侵袭和迁移的影响及BMSCs外泌体向BGC-823细胞传递的具体生物信息物质,有待今后进一步研究。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA:A Cancer Journal for Clinicians,2018,68(1):7-30.
[2] SUN C, DAI X, ZHAO D, et al. Mesenchymal stem cells promote glioma neovascularization in vivo by fusing with cancer stem cells[J]. BMC Cancer,2019,19(1):1240.
[3] HE X, LI B, SHAO Y, et al. Cell fusion between gastric epithelial cells and mesenchymal stem cells results in epithelial-to- mesenchymal transition and malignant transformation[J]. BMC Cancer,2015,15(1):24.
[4] 常晶晶,颜次慧,张新伟,等.间充质干细胞在肿瘤微环境形成中的作用[J].中国肿瘤生物治疗杂志,2018,25(4):421-425.
[5] 涂超,程芳.人骨髓来源间充质干细胞外泌体与肿瘤生长的关系[J].基因组学与应用生物学,2019,38(6):2842-2848.
[6] 吴高峰,刘喜平,杨柏林,等.胃癌微环境对大鼠骨髓间充质干细胞形态、生长及CD34、CD44表达的影响[J].中国组织工程研究,2016,20(14):2040-2045.
[7] 汪永锋,刘喜平,崔国宁,等.胃癌微环境转化后骨髓间充质干细胞的体内致瘤性[J].中国组织工程研究,2017,21(1):32-37.
[8] 毛佳慧,梁照锋,田伊卿,等.不同状态p53小鼠骨髓间质干细胞分泌外泌体的差异[J].江苏大学学报(医学版),2017,27(2):103-106.
[9] 武雪,钱曼青,吴东梁,等.间充质干细胞来源外泌体对肿瘤的调控效应[J].中国组织工程研究,2018,22(25):4083-4088.
[10] QI J, ZHOU Y, JIAO Z, et al. Exosomes derived from human bone marrow mesenchymal stem cells promote tumor growth through hedgehog signaling pathway[J]. Cellular Physiology and Biochemistry:International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology,2017,42(6):2242- 2254.
[11] 崔国宁,刘喜平,陈嘉慧,等.半夏泻心汤联合IL-12转染骨髓间充质干细胞对胃癌荷瘤裸鼠抑瘤作用研究[J].中国中医药信息杂志,2020, 27(1):39-44.
[12] 李沛清,刘喜平,席时燕.半夏泻心方及其配伍药组含药血清对人胃癌BGC-823细胞生长抑制作用及p53表达的影响[J].中药药理与临床, 2005,2(5):7-9.
[13] 席时燕,刘喜平,李沛清.半夏泻心方及其配伍药组含药血清对人胃癌BGC-823细胞增殖及bcl-2表达的影响[J].中国中医药信息杂志, 2006,13(4):20-22.
[14] LIU X P, MING H X, LI P Q. Intervention effect of pinelliae decoction for purging stomach-fire on malignant transformation of bone marrow mesenchymal stem cells in the gastric cancer microenvironment[J]. American Journal of Translational Research, 2016,8(7):2937-2946.
[15] 张炜,刘喜平,明海霞,等.半夏泻心汤含药血清对胃癌微环境诱导腹膜间皮HMrSV5细胞凋亡的影响[J].中华中医药杂志,2016,31(9):3735- 3738.
[16] ABADJIAN M Z, EDWARDS W B, ANDERSON C J. Imaging the tumor microenvironment[J]. Adv Exp Med Biol,2017,1036(1):229-257.
[17] QUAIL D F, JOYCE J A. Microenvironmental regulation of tumor progression and metastasis[J]. Nature Medicine,2013,19(11):1423-1437.
[18] SPEES J L, LEE R H, GREGORY C A. Mechanisms of mesenchymal stem/stromal cell function[J]. Stem Cell Research & Therapy,2016, 7(1):125.
[19] WEBBER J, YEUNG V, CLAYTON A. Extracellular vesicles as modulators of the cancer microenvironment[J]. Seminars in Cell & Developmental Biology,2015,40(1):27-34.
[20] COLOMBO M, RAPOSO G, THÉRY C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annual Review of Cell & Developmental Biology,2014, 30(1):255-289.
[21] PAN Y, BAI C B, JOYNER A L, et al. Sonic hedgehog signaling regulates Gli2 transcriptional activity by suppressing its processing and degradation[J]. Molecular and Cellular Biology, 2006,26(9):3365-3377.
[22] BRINK G R V D. Hedgehog signaling in development and homeostasis of the gastrointestinal tract[J]. Physiological Reviews,2007, 87(4):1343-1375.
[23] MCMAHON S B. MYC and the control of apoptosis[J]. Cold Spring Harb Perspect Med,2014,4(7):a14407.
Effects of Regulation ofDecoction for Shh Signaling Pathway on BMSCs Exosomes-induced Proliferation of Human Gastric Cancer Cells BGC-823
CUI Guoning, LIU Xiping, LI Peiqing, WANG Qingmiao, DAI Lirong, WANG Yu, ZHU Zhongbo, DONG Jungang
To observe the effects ofDecoction on the proliferation of human gastric cancer cells BGC-823 induced by exosomes of bone marrow mesenchymal stem cells (BMSCs); To discuss its mechanism of action.BMSCs exosomes were co-cultured with BGC-823 cells in a Transwell chamber. The experiment was divided into blank group, model group, positive control group,Decoction high-, medium- and low-dosage groups. BMSCs exosomes were labeled with fluorescent dye Dil; the uptake of BMSCs exosomes by BGC-823 cells was observed with a laser confocal microscope, and the mean optical density (MOD) was calculated; Real-time label-free cell analysis technology was used to detect cell proliferation; flow cytometry was used to detect cell growth cycle; RT-qPCR was used to detect the expressions of Shh, Smo, Ptch1, Gli1 and C-myc mRNA. Results Compared with the blank group, a large number of red fluorescent markers were seen in the cells of the model group, and the MOD value significantly increased (<0.05); the cell index (CI) of the model group increased significantly between 20 and 50 hours (<0.05), the proportion of cells in G1and G2phases decreased, the proportion of cells in S phase increased (<0.05), the expressions of Shh, Smo, Ptch1, Gli1 and C-myc mRNA significantly increased (<0.05). Compared with the model group, the red fluorescent markers inDecoction groups were weakened, and the MOD value ofDecoction high- and medium-dosage groups was significantly reduced (<0.05); the CI ofDecoction groups decreased significantly between 20 and 50 hours (<0.05), the proportion of cells in G1and G2phases increased, and the proportion of cells in S phase decreased (<0.05), the expressions of Shh, Smo, Ptch1, Gli1 and C-myc mRNA were significantly reduced (<0.05).Decoction can inhibit the proliferation of BGC-823 cells induced by BMSCs exosomes. The mechanism may be related to down-regulating the expressions of Shh, Smo, Ptch1, Gli1 and C-myc mRNA and inhibiting the Shh signaling pathway.
Decoction; human gastric cancer cell; BMSCs; exosomes; Shh signaling pathway
R285.5
A
1005-5304(2021)08-0077-06
10.19879/j.cnki.1005-5304.202011548
国家自然科学基金(81860813、81860782)
刘喜平,E-mail:Lxp-d257@163.com
(收稿日期:2020-11-30)
(修回日期:2020-12-24;编辑:华强)

