新生儿医院内肺部感染病原菌及相关因素分析
吴少珍,杨海霞,官燕飞,谭 南
广东省中山市博爱医院检验科,广东中山 528403
随着围生期相关医学的快速进步与发展,临床对异常状态下新生儿的救治能力不断提高,但是由于各类插管等侵袭性操作的使用及抗菌药物的大范围、高强度应用,其伴发的医院内肺部感染情况成为关注的重点[1]。有研究指出,低体质量的早产儿,不仅体质量低,而且其免疫状态更加低下,极易发生医院内感染[2-3]。医院内感染的发生,不仅仅是公共卫生问题,而且是生命安全问题,这主要是因为引起医院内感染的多药耐药菌株严重影响新生儿的生命健康,这就要求临床医护人员及时了解新生儿医院内肺部感染的相关病原菌及其相关危险因素,以提高感染控制措施持续改善的能力并指导执行[4]。在诱导该类疾病发生的相关因素研究中,不同的研究者关注了不同的危险因素,国外的研究认为呼吸窘迫综合征、胃管和静脉插管是危险因素[5],而在国内的回顾性研究中有创通气时间、吸痰、败血症等是危险因素[6]。由于在不同地区的患儿群体中其危险因素可能存在差异,故对本院相关危险因素进行分析是本次研究的关注点,以期为临床的救治工作提供建议。
1 资料与方法
1.1一般资料 选取2017年10月至2019年10月在本院住院救治的1 415例新生儿作为研究对象进行回顾性分析。本研究获得新生儿家属的知情同意并符合伦理学要求。纳入标准:(1)日龄<28 d;(2)住院时间>48 h;(3)发生医院内肺部感染(入院48 h后发生的、胸片等影像学检查确认肺炎、血培养阳性、相关临床症状体征和检查结果证实存在肺部感染)[4]。排除标准:(1)入院时存在明确的肺部感染;(2)入院<48 h发生的肺部感染;(3)新生儿存在明显的畸形异常;(4)家属不能配合完成。
1.2方法 入院后或者在使用抗菌药物前即评估新生儿的指标确定是否发生肺部感染,在入院48 h以后发生呼吸机相关肺炎,或者怀疑患儿发生肺部感染时,留取痰或者血标本送检。使用吸痰管进行肺部分泌物的取样,使用无菌痰杯留取后尽快送检,使用赛默飞需氧血培养瓶留取2 mL血液送检,血培养出现阳性或者连续2次痰培养阳性的肺部感染患儿被认为发生医院内肺部感染,当血培养结果和痰液培养结果不一致时,应该进行鉴别和排除。使用布鲁克全自动质谱鉴定系统对培养的细菌进行鉴定,细菌培养的质控选择:金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853。药敏鉴定使用MH培养基等和Oxoid药敏纸片,0.5麦氏浊度下接种后培养16 h,然后测量抑菌圈确定药敏结果。此外,收集患儿的一般资料如性别、年龄、体质量等进行相关危险因素的分析。
1.3统计学处理 采用Graphpad Prism 5.0 统计软件进行数据的分析处理。计数资料以例数或百分率表示,比较采用χ2检验或者精确检验法(Fisher检验);将性别、胎龄等临床资料纳入进行一般资料分析,有意义的指标则纳入多因素Logistic回归分析;以P<0.05为差异有统计学意义。
2 结 果
2.1新生儿医院内肺部感染情况分析 1 415例新生儿发生医院内肺部感染71例,感染率5.02%,共培养分离病原菌株79株,其中革兰阴性杆菌58株(73.4%),革兰阳性球菌21株(26.6%),见表1。在革兰阴性杆菌中,大肠埃希菌和肺炎克雷伯菌分别占26.6%和21.5%,明显多于其他菌株;而金黄色葡萄球菌在革兰阳性球菌中占明显优势。
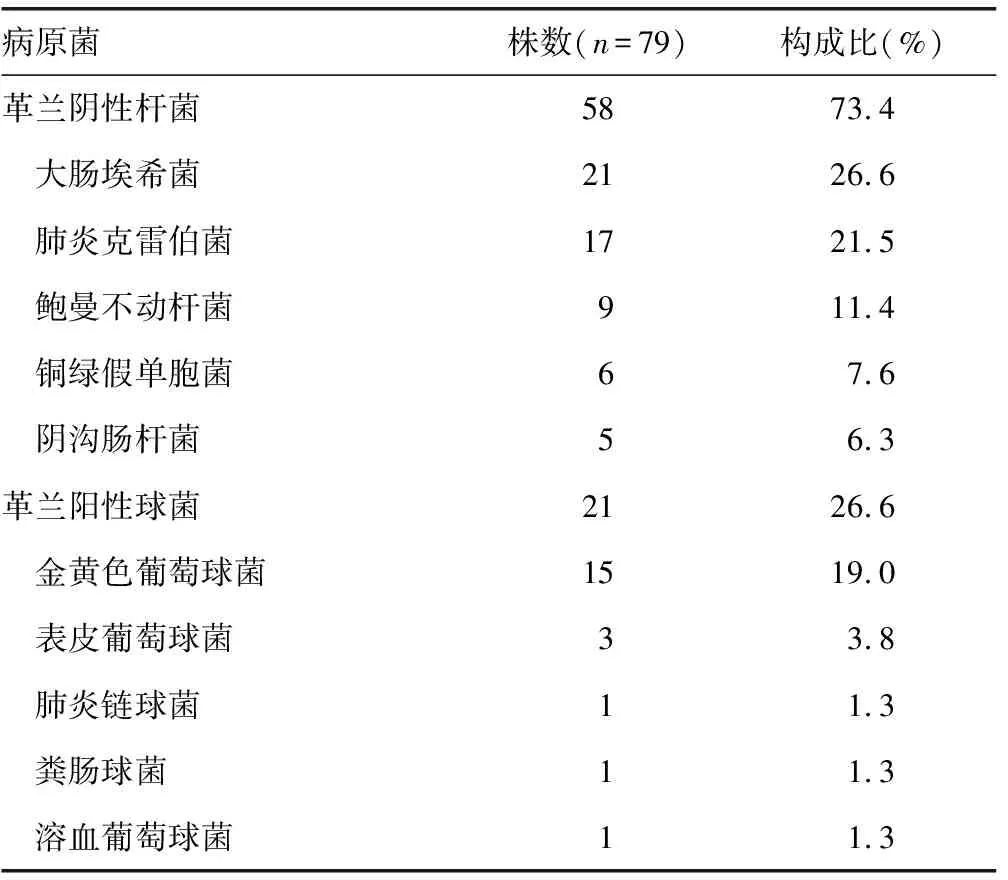
表1 新生儿医院肺部感染菌株分布
2.2主要革兰阴性病原菌的耐药性分析 对检出的主要革兰阴性病原菌进行药敏分析,见表2。结果分析发现,大肠埃希菌和肺炎克雷伯菌对氨苄西林、哌拉西林、头孢唑啉、头孢呋辛钠均表现为100.0%耐药,对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦和碳青霉烯类抗菌药物的耐药率较低,应该酌情使用这几类抗菌药物。但还是应该注意药物联用时新生儿的身体情况,由于新生儿不适用喹诺酮类、四环素类和氨基糖苷类药物,故未对左氧氟沙星、四环素和庆大霉素等抗菌药物进行药敏分析。

表2 主要革兰阴性病原菌的药敏分析(%)
2.3金黄色葡萄球菌的耐药性分析 见表3。结果显示,15株金黄色葡萄球菌对青霉素G的耐药率为100.0%,对苯唑西林的耐药率为33.3%。这15株金黄色葡萄球菌对利奈唑胺和糖肽类抗菌药物均为100.0%敏感,但是这类抗菌药物不良反应明显,应该注意药物联用时的身体指标监测。
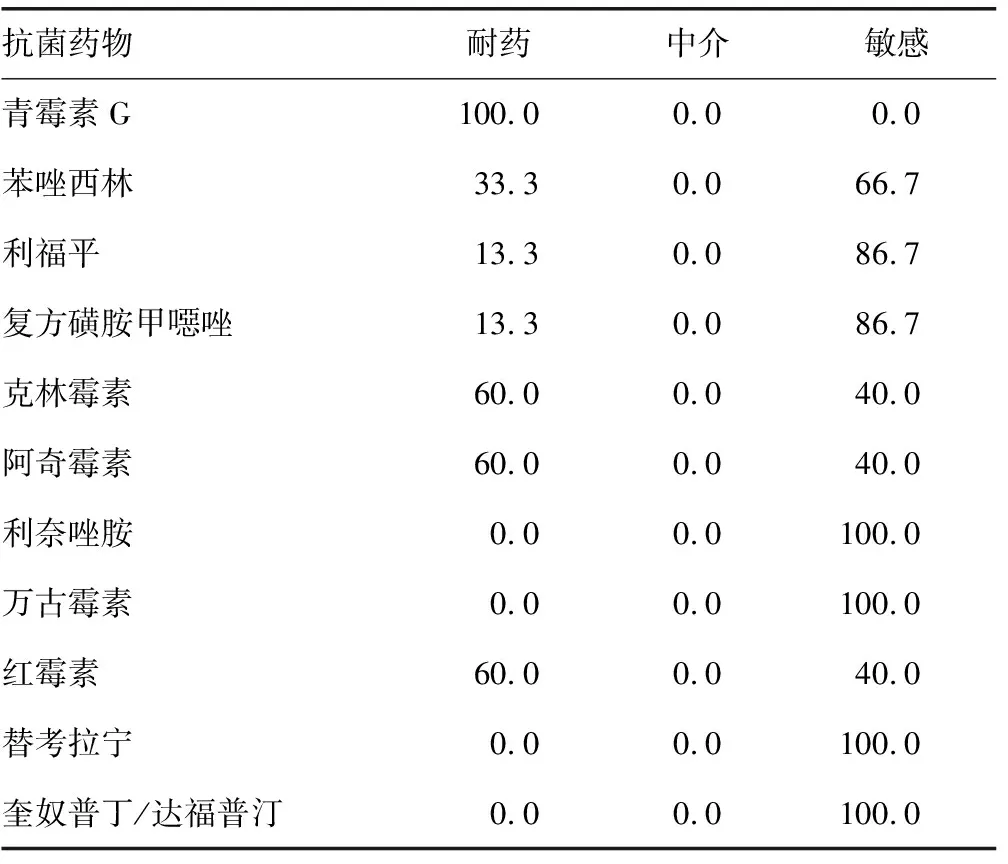
表3 金黄色葡萄球菌的药敏分析(%)
2.4新生儿医院内肺部感染一般资料分析 见表4。一般资料分析结果显示,低体质量(<1 500 g)、低胎龄(<32周)、长住院时间(≥7 d)、侵袭性操作(吸痰)、窒息、机械通气和静脉营养是新生儿发生医院内肺部感染的相关因素(P<0.05);但是在性别、产前感染性疾病和羊水污染的一般资料分析中显示,其在医院内肺部感染中差异无统计学意义(P>0.05)。
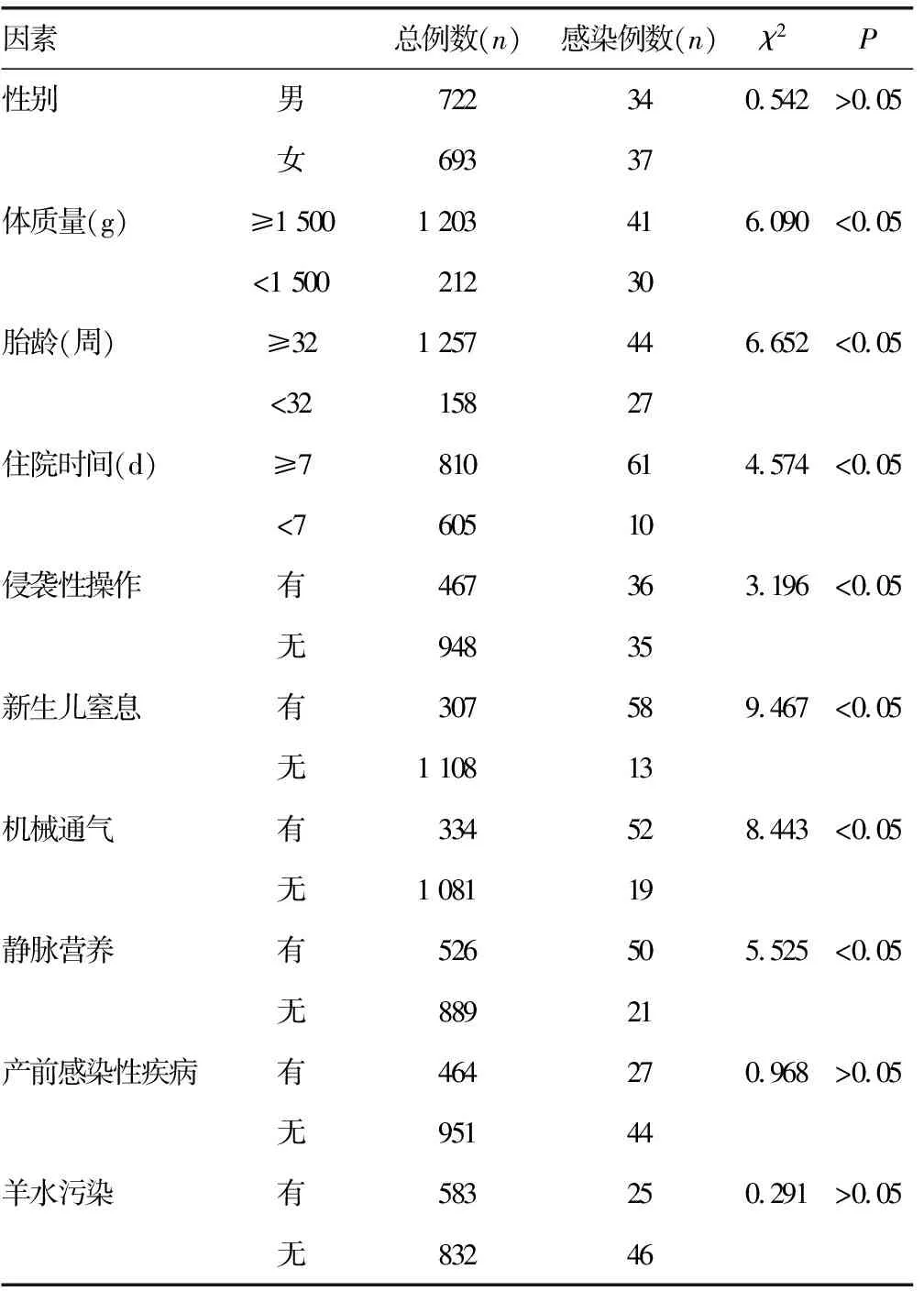
表4 新生儿医院内肺部感染一般资料的分析
2.5新生儿医院肺部感染的多因素分析 对一般资料分析结果显示为P<0.05的因素继续分析,使用回归分析观察新生儿医院肺部感染的危险因素,见表5。结果显示,在回归分析中,低体质量(<1 500 g)、低胎龄(<32周)、住院时间长(≥7 d)、侵袭性操作(吸痰)、新生儿窒息、机械通气和静脉营养为新生儿发生医院内肺部感染的独立危险因素(P<0.05)。

表5 新生儿医院内肺部感染的多因素分析
3 讨 论
随着生命支持手段的快速进步,早产儿等新生儿的存活率显著提升,但医院内感染相关的管理监督存在不足,这导致医院内肺部感染成为关注的重点。这主要是因为肺部多重耐菌株的感染和相关药物的使用,对新生儿造成不可逆的器官损伤进而严重影响了新生儿的生长发育,故减少医院内感染的发生成为围生儿方面的关注重点[3]。本研究中,共1 415例新生儿纳入研究,71例(5.02%)发生医院内感染,虽然5%的医院内感染发生率较低,但是仍然需要给予新生儿医院内感染更多的关注,以减少新生儿医院内感染的发生和全力保护新生儿的健康。
对79株医院内肺部感染菌株进行分析,发现革兰阴性杆菌占73.4%,明显多于革兰阳性球菌(26.6%),这说明在目前本院的医院内肺部感染中,大肠埃希菌和肺炎克雷伯菌占据绝对的优势,随后就是金黄色葡萄球菌,这提示在日常工作中需关注这3种细菌的医院感染监测,并进行充分的消毒和手卫生操作。在药敏结果分析中发现,大肠埃希菌和肺炎克雷伯菌对氨苄西林、哌拉西林、头孢唑啉、头孢呋辛钠均表现为100.0%耐药,这说明医院内感染的革兰阴性杆菌对青霉素类及头孢菌素一代、二代表现为耐药,在治疗过程中发生医院内肺部感染时,应停止这类药物的使用,并且对三代头孢菌素亦具有较高的耐药率,也应该减少三代头孢菌素的使用[6-7]。这也说明大肠埃希菌和肺炎克雷伯菌表现为超广谱β-内酰胺酶阳性,属于多重耐药菌株,应注意加强与其他新生儿的隔离措施,减少医院内交叉感染[4]。大肠埃希菌和肺炎克雷伯菌对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦和碳青霉烯类抗菌药物的耐药率较低,应该酌情使用这几类抗菌药物。但还是应该注意药物联用时新生儿的身体情况,由于新生儿不适用喹诺酮类、四环素类和氨基糖苷类药物,故未对左氧氟沙星、四环素和庆大霉素等抗菌药物进行药敏分析。药敏结果显示,15株金黄色葡萄球菌对青霉素G的耐药率为100.0%,对苯唑西林的耐药率为33.3%,这说明15株金黄色葡萄球菌均为产β-内酰胺酶的菌株,其中5株为耐甲氧西林的菌株,该类菌株是多重耐药菌株,应该注意这些患儿与其他新生儿的隔离措施,减少医院内感染的发生。这15株金黄色葡萄球菌对利奈唑胺和糖肽类抗菌药物均为100.0%敏感,但是这类抗菌药物不良反应明显,药物联用时应该注意对患者进行身体指标的监测。
对医院内肺部感染的相关资料进行分析,低体质量(<1 500 g)、低胎龄(<32周)、长住院时间(≥7 d)、侵袭性操作(吸痰)、新生儿窒息、机械通气和静脉营养是新生儿发生医院内肺部感染的危险因素。这主要是由于早产和低体质量的新生儿,其身体的免疫系统发育滞后,特别是固有免疫系统低下,不能够抵抗外界病原菌的进入。有研究表明,随着胎儿体质量的增加和胎龄的增长,其免疫系统发育逐渐成熟,不易受到病原菌侵袭和发生感染[8-9]。长时间住院和吸痰等侵袭性操作也是重要的危险因素,这是由于长时间处于医院这个带菌环境中,其住院时间越长发生感染的可能性越大,特别是新生儿有痰无法咳出时,经常使用吸痰管,这属于侵入性操作,能够直接将外界的细菌引入到呼吸道中,而且吸痰这种操作常常一天几次,极大地增加了发生医院内肺部感染的可能性[10-11]。多因素回归分析显示,新生儿窒息和机械通气是危险因素,这是由于新生儿窒息会引入机械通气的治疗手段,而机械通气属于有创治疗措施,其将新生儿的肺部直接暴露于医院的环境中,极易引起医院内肺部感染,这种治疗手段虽然效果明显,但是其后续的医院内感染和撤机困难一直困扰着临床工作者[12]。
总之,本院新生儿医院内肺部感染率虽然不高,但是仍然需要对病原菌分布和药敏结果进行分析,指导临床用药,同时需关注发生医院内肺部感染的危险因素,以求减少医院内感染的发生,保护新生儿的生命健康。

