胃癌靶向治疗过程中血清HER2-ECD检测1例报道
邢继成,何玉杰,朱春燕,邱 红△
东部战区总医院秦淮医疗区:1.医技保障科;2.肿瘤中心,江苏南京210002
胃癌精准治疗的分子靶点中,临床意义最明确、应用最广泛的是人表皮生长因子受体2(HER2)。胃癌中HER2阳性率为12%~20%[1]。HER2阳性往往预示着肿瘤进展快、容易发生淋巴结或血道转移,对新辅助化疗不敏感,预后不佳。研究发现,分泌入血清中HER2胞外区(ECD)的水平可以有效反映组织学HER2表达情况[2],目前临床上检测患者HER2表达水平的方法为免疫组织化学染色和荧光原位杂交(FISH),由于其主观性、滞后性和难以取材的局限性,越来越多的研究者开始对血清HER2-ECD进行研究。在临床实践中,血清HER2-ECD的检测还没有被广泛使用,临床价值也尚未在胃癌患者中得到充分验证。本文搜集了1例HER2阳性晚期胃癌患者的整个治疗过程及相关检查的资料,分析血清HER2-ECD检测在胃癌靶向治疗过程中的应用价值。
1 病例资料
1.1一般资料 患者,女,75岁,2016年10月上旬因“上腹部阵发性隐痛半月”就诊,胃镜活检病理明确诊断胃腺癌,于2016-10-21行全胃根治性切除术。术后病理(图1):胃溃疡浸润性中低分化腺癌伴坏死,淋巴结26枚中16枚见癌组织转移,Lauren分型为肠型、pTNM分期为T2N3MxⅢA期,免疫组化显示HER2(+++)。术后半月出现腹腔出血,引流管引流出鲜红色血性液体约1 000 mL,予以积极对症治疗效果欠佳,2016-11-10急诊行腹腔止血术,术程顺利。
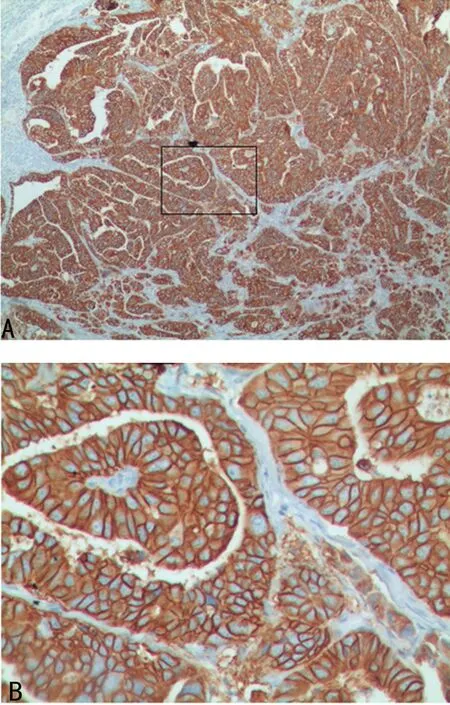
图1 全胃根治术后病理图片
1.2治疗方案及检查结果
1.2.1第1阶段治疗方法 术后口服替吉奥单药化疗2个周期。2017-02-14查腹部增强CT(图2)提示肝脏、腹腔淋巴结转移。2017-02-28开始予以低剂量SOX方案联合曲妥珠单抗治疗,经治疗后患者病灶较前缩小,其中2017-08-22病灶最小,从2017-11-27开始病灶有增大趋势。
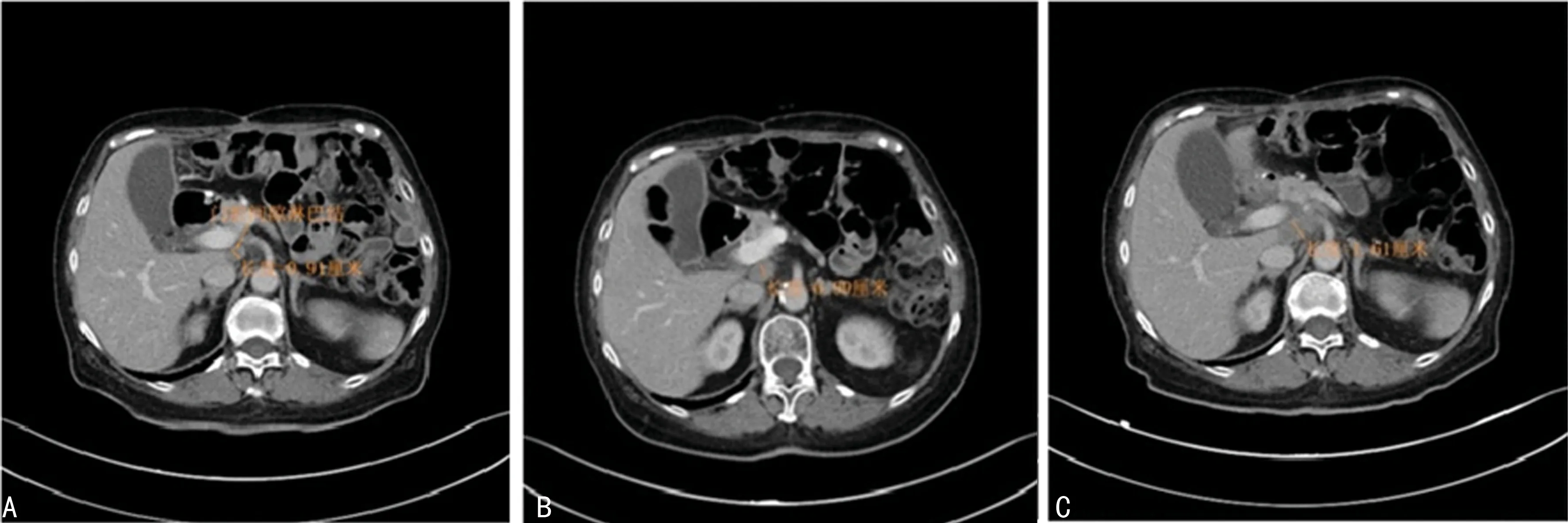
1.2.2第1阶段治疗血清HER2-ECD和癌胚抗原(CEA)动态检测结果 2017-02-14病灶总径为70.5 mm,2017-02-28开始第1阶段化疗,于2017-03-21检测HER2-ECD和CEA,HER2-ECD采用西门子原厂试剂、ADVIA Centaur CP全自动化学发光免疫分析仪检测,CEA采用新产业试剂、MAGLUMI 4000Plus全自动化学发光免疫分析仪检测。2017-08-22病灶总径51.5 mm,2017-11-27病灶总径54.5 mm,淋巴结短径9 mm。见图2。第1阶段治疗血清HER2-ECD和CEA检测结果见表1。
1.2.3第2阶段治疗 2017-12-12、2018-01-03予SOX方案联合赫赛汀、恩度治疗2个周期,2018-01-25复查胸腹部CT,评价病情稳定。2018-01-29、2018-02-23继续予SOX方案联合赫赛汀、恩度治疗2个周期。2018-03-19复查胸腹部CT(图3、4),肝脏多发转移瘤,大部分较前增大,门腔间隙淋巴结较前增大,评价病情恶化。

注:A图病灶总径70.5 mm;B图病灶总径51.5 mm;C图病灶总径54.5 mm;D图淋巴结短径9 mm。
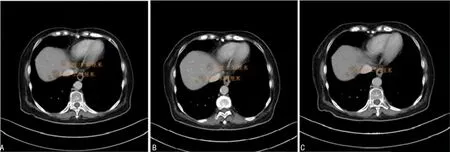
注:A图病灶总径54.5 mm;B图病灶总径53 mm;C图病灶总径61 mm。
注:A图淋巴结短径9 mm;B图淋巴结短径9 mm;C图淋巴结短径16 mm。
1.2.4第2阶段治疗血清HER2-ECD和CEA动态检测结果 2017-12-12开始第2阶段治疗,2018-01-25病灶总径53 mm,淋巴结短径9 mm;2018-03-19病灶总径61 mm,淋巴结短径16 mm。第2阶段治疗血清HER2-ECD和CEA检测结果见表1。
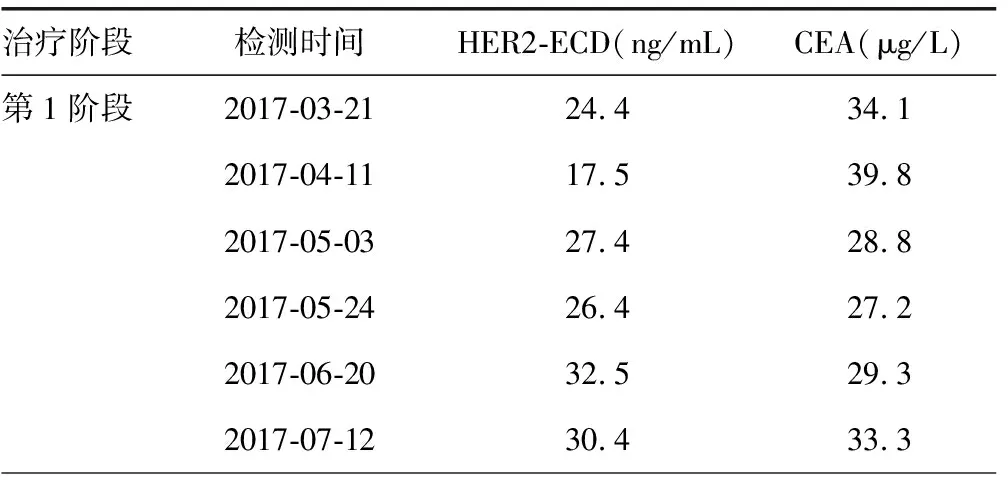
表1 患者治疗过程中血清HER2-ECD和CEA检测结果

续表1 患者治疗过程中血清HER2-ECD和CEA检测结果
2 讨 论
研究发现,曲妥珠单抗是针对HER2受体细胞膜外部分的单克隆抗体,通过与HER2细胞膜外Ⅳ区结合,阻断下游磷脂酰肌醇(PI3K)/蛋白激酶B(AKT)和Ras/MEK肿瘤细胞信号传导从而发挥抗肿瘤作用[3-4]。
虽然血清HER2-ECD检测尚未纳入诊疗指南,但相关研究发现,血清HER2-ECD检测可以作为连续动态评估进展期乳腺癌患者接受抗HER2靶向治疗的疗效及预后的较为特异的指标[5-8],但临床上血清HER2-ECD检测用于胃癌患者疗效观察的报道较少[9-10]。CEA是广谱性肿瘤标志物,在反映胃肠道癌的疗效判断、病情监测及预后评估方面效果较好[11]。
本例患者在确定胃癌HER2阳性、行胃癌根治术后发现有转移灶时进行分子靶向治疗,第1阶段治疗,CT显示该患者转移灶缩小,随着治疗的进展血清HER2-ECD水平趋于平稳,病情稳定。治疗半年后检查病灶最小,此时血清HER2-ECD水平较前次检测略有升高,提示病情进展可能,1个月后HER2-ECD水平达到41.9 ng/mL,这阶段血清CEA水平变化不明显,血清HER2-ECD水平明显升高提示患者可能存在治疗耐药;第1阶段治疗末期CT检查病灶增大趋势明显,影像学资料与血清HER2-ECD水平的增高呈一致性,随着病灶的增大血清HER2-ECD水平达到61.4 ng/mL,增高明显,此时CEA水平也明显升高;第2阶段通过SOX方案联合赫赛汀、恩度探索性治疗,在添加抑制肿瘤血管生成药恩度的作用下,使血清HER2-ECD水平维持在一个平稳下行的趋势至38.3 ng/mL,病灶总体趋势在缩小,探索性治疗略显疗效,而CEA水平一直处于一个平缓上升状态,对疗效观察的效果欠佳。第2阶段治疗末期复查病灶在原来的基础上再次增大,血清HER2-ECD水平增高达149.4 ng/mL,同时CEA水平也到了一个新的高度,这阶段病灶的增大和血清HER2-ECD水平增高的原因可能是患者本身肝肾综合征合并肝性脑病所致,患者器官代偿能力不足,后续治疗疗效甚微,直至生命终结。
通过对该患者病程进展过程中影像学和血清学指标的监测,可以清晰地监测到血清HER2-ECD水平在治疗每个阶段的变化,能够较准确反映病灶的进展程度和患者的病情进展,为病理诊断HER2阳性患者的治疗提供依据,同时弥补了肿瘤切除后难以动态观察患者HER2阳性结果量化的不足。由于病例较少,有待进一步扩大研究来证实血清HER2-ECD在胃癌靶向治疗过程中的指导作用。

