微波联合坦索罗辛治疗慢性前列腺炎的临床效果
何成祖 熊永高 宋少康
(佛山市高明区人民医院泌尿外科,广东省佛山市 528500)
慢性前列腺炎(chronic prostatitis,CP)在我国的发病率为6.0%~32.9%[1],具有病因复杂、经久不愈、极易反复的特点。若长期不能治愈,患者的各种不适症状会在性生活后加重,导致患者因恶性刺激对性产生厌恶感,最终引起阳痿、早泄等[2],严重影响其生活。坦索罗辛是临床上治疗CP的常规药物,但单独使用的有效率仅为76%左右,治疗效果欠佳[3]。微波治疗是通过高频的热效应使机体温度上升、血管扩张,从而加快血液循环、新陈代谢,进而促进药物吸收的治疗方式。本研究选取42例CP患者给予坦索罗辛联合微波治疗,获得显著的临床效果。现将结果报告如下。
1 资料与方法
1.1 一般资料 选取2019年1月至2020年10月在我院接受治疗的84例CP患者作为研究对象。纳入标准:符合CP的诊断标准,伴有3个月以上排尿困难、会阴不适、盆腔疼痛等临床症状[4];经实验室检查可见前列腺液中白细胞数多于10个/HP,卵磷脂小体大幅度减少或者消失;患者自愿签署知情同意书。排除标准:合并前列腺增生、前列腺癌、急性前列腺炎等疾病;合并尿道炎、尿道狭窄;对本研究药物过敏;合并严重肝、肾功能不全者;不积极配合本研究者。将患者按随机数字表法分为对照组(n=42)和观察组(n=42)。观察组年龄(37.16±4.15)岁,病程(3.14±0.42)年,美国国立卫生研究院慢性前列腺炎症状指数(the National Institute of Health-Chronic Prostatitis Symptom Index, NIH-CPSI)评分(28.31±1.86)分;对照组年龄(37.89±4.01)岁,病程(3.10±0.37)年,NIH-CPSI评分(28.68±1.75)分。两组患者的一般资料比较,差异无统计学意义(均P>0.05),组间资料均衡可比。
1.2 方法 本研究所有患者皆接受基础治疗,即采用大环内酯类、喹诺酮类、头孢类等抗生素进行治疗,并行对症治疗,每天晚上热水坐浴,每周行前列腺按摩1次。对患者进行心理干预,鼓励其积极配合治疗,并嘱咐患者进行长期的体育运动,与此同时,忌饮酒和食用刺激性食物,忌久坐以及过度性生活。
1.2.1 对照组 在上述治疗的基础上采用坦索罗辛治疗,餐后予以盐酸坦索罗辛缓释胶囊(湖北天宁医药药材有限责任公司,生产批号:20180315)0.2 mg口服,1次/d,1个月为1疗程。
1.2.2 观察组 在对照组治疗的基础上联合微波治疗(维世康微波治疗仪 MTC-3B,上海实业医药投资股份有限公司),治疗前排空大便,嘱患者取侧卧位,把双膝抱于胸前,肛门全部暴露后,消毒。把一次性手套套于直肠探头,并涂上石蜡油,缓慢插入肛门内5 cm,将微波治疗仪功率设为5 W,隔日1次,20 min/次,2周为1疗程,共治疗2疗程。
1.3 观察指标 (1)临床疗效:实验室检查未见改善,患者症状亦未见改善,NIH-CPSI评分降低少于30%为无效;实验室检查可见卵磷脂小体较治疗前增加,且白细胞总量较少,NIH-CPSI评分减少30%~59%为有效;实验室检查可见卵磷脂小体较治疗前显著增加,基本恢复正常,NIH-CPSI评分减少60%~89%为显效;实验室检查可见卵磷脂小体增加≥75%,完全恢复正常,NIH-CPSI评分减少≥90%为痊愈。(2)NIH-CPSI评分:包括生活质量、排尿症状、疼痛或不适症状、症状影响四个维度,分值43分,总分越低表示症状越轻。(3)前列腺液炎症因子水平:采用酶联免疫吸附法检测治疗前后的白介素-2(interleukin-2,IL-2)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平。
1.4 统计学方法 应用SPSS 23.0统计学软件分析数据,符合正态分布的定量资料用均数±标准差(x±s)表示,组间比较行t检验;计数资料用例数和百分率[n(%)]表示,组间比较行χ2检验,等级资料比较用秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效比较 观察组患者的临床疗效明显优于对照组,差异有统计学意义(u=2.357,P=0.018)。见表1。

表1 两组患者的临床疗效比较 [n(%)]
2.2 NIH-CPSI评分比较 治疗前,两组患者的NIH-CPSI各维度评分差异无统计学意义(均P>0.05);治疗后,两组患者的NIH-CPSI各维度评分均降低,且观察组低于对照组,差异均有统计学意义(均P<0.05)。见表2。
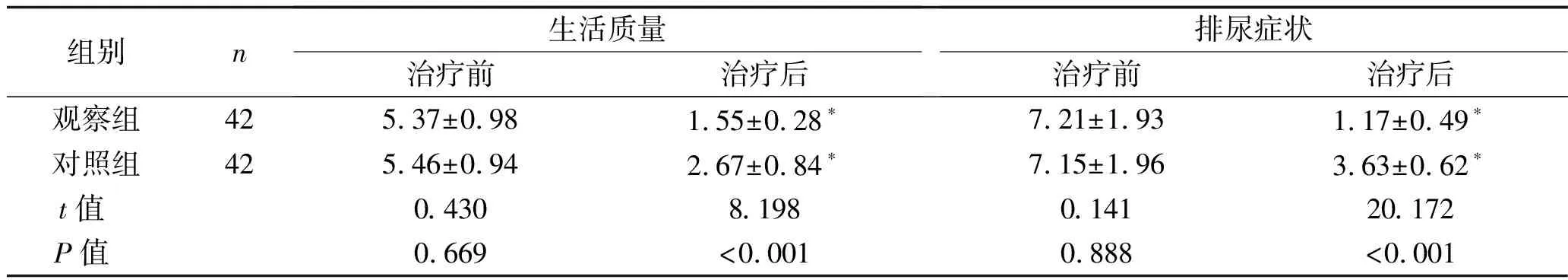
表2 两组患者的NIH-CPSI评分比较 (x±s,分)
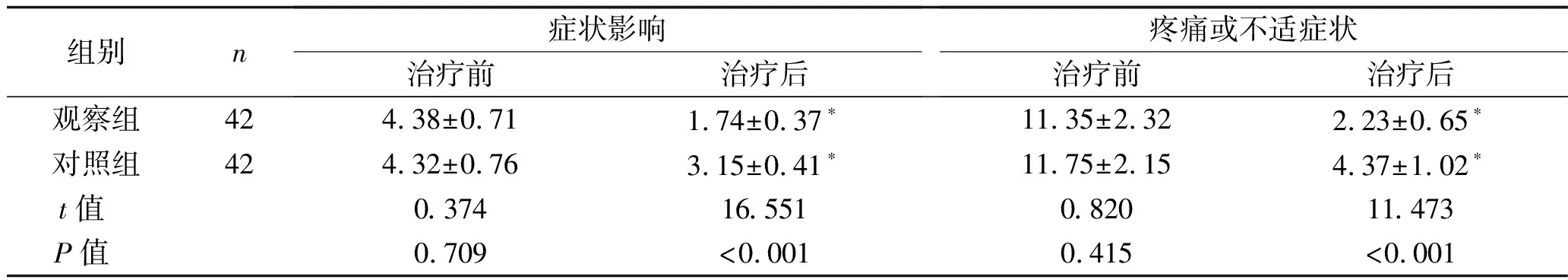
续表2
2.3 前列腺液炎症因子水平比较 治疗前,两组患者的前列腺液IL-2、IL-6、TNF-α水平差异无统计学意义(均P>0.05);治疗后,两组患者上述炎症因子水平均明显降低,且观察组低于对照组,差异有统计学意义(均P<0.05)。见表3。
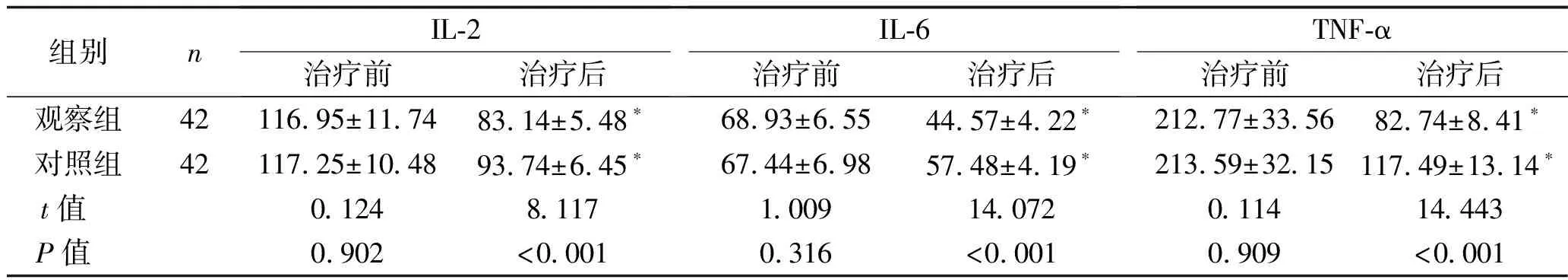
表3 两组患者的前列腺液炎症因子水平比较 (x±s,pg/mL)
3 讨 论
目前治疗CP的主要方式有α受体阻断剂、抗生素、植物制剂、生物反馈、止痛剂和前列腺按摩等,但这些手段单一治疗的疗效欠佳,易导致复发,治疗效果不能满足患者的需求。为此,探索CP更有效的治疗手段十分重要。
本研究结果显示,观察组的临床疗效明显优于对照组,治疗后观察组的NIH-CPSI各维度评分低于对照组,治疗后前列腺液IL-2、IL-6、TNF-α水平低于对照组(均P<0.05)。说明微波联合坦索罗辛治疗CP疗效显著,可改善患者临床症状,减少炎症反应。CP的发病机制较为复杂,尚未有统一定论。其主要的发病机制是自主神经功能紊乱导致α受体兴奋性增高,从而引发尿道-神经肌肉功能失调,导致尿液在排尿的过程中,在膀胱颈部功能失调和盆底肌群抽搐的情况下反流至前列腺,导致其发生慢性炎症[5]。α受体多分布于尿道黏膜平滑肌、前列腺基质平滑肌、前列腺包膜等交感神经突触后膜上[6]。α受体阻断剂可选择地阻断尿道、前列腺和膀胱颈部多部位平滑肌的兴奋性,缓解平滑肌痉挛,使尿道阻力相应减轻,从而改善尿流率,缓解功能性尿道梗阻,最终减轻CP患者的疼痛,对CP有很好的疗效[7]。坦索罗辛作为α受体阻断剂代表药物之一,可与α1A受体结合,缓解广泛分布于前列腺与尿道中的交感神经的紧张程度,前列腺平滑肌随之松弛,尿道内压明显降低,进而CP患者的排尿困难现象改善[8-10]。微波治疗CP主要以高频的热效应为主,通过直肠透入与其相邻的前列腺,促进腺体内温度稳定上升,体内组织血管逐渐扩张,血流速度加快,使前列腺血液循环得到改善,加速了局部毒素和新陈代谢产物的排出,进而促进炎症吸收[11-12];另一方面微波治疗使瘢痕软化,脓栓液化,脓肿消退,甚至直接杀死腺体内的细菌,进而达到治疗CP的效果[13-14]。研究显示,白介素是一类与免疫应答有密切联系的细胞因子,IL-2、IL-6是由活化T淋巴细胞产生,其通过调控促炎因子的合成,介导机体的炎症反应。TNF-α有助于机体内前列腺素E的合成,促进炎症反应发生。微波联合坦索罗辛可使前列腺液IL-2、IL-6、TNF-α水平降低,说明微波联合坦索罗辛降低炎症反应发生的效果显著,与魏小义等[15]研究结果相似。
综上所述,微波联合坦索罗辛治疗CP疗效显著,可减少炎症反应,改善临床症状,值得推广。

