姑息化疗治疗老年肺癌患者的疗效及其对患者生存质量的影响
陈延春,陈开训,孙鹏摇,孙雪竹
(解放军联勤保障部队第901医院肿瘤一科,安徽 合肥 230031)
肺癌属于目前全球范围内最为常见的恶性肿瘤疾病,占癌症患者总数的15%左右,且具有较高的死亡率[1-2]。在60岁以上老年人群中,肺癌发病率极高,尤其是70~74岁,属于发病高峰期。目前,肺癌患者当中有四成以上为70岁以上,一成左右为80岁以上[3]。绝大多数肺癌患者在就诊时已经处于中晚期,常无法实施较有效的手术治疗,归因于其肿瘤转移情况较严重,需要联合采用化疗等多种治疗方法[4]。另外,老年肺癌患者多伴发各种慢性疾病,患者及家属往往会对化疗产生的不良影响较为担忧。本研究观察不同治疗模式对老年肺癌患者的临床疗效,明确姑息化疗对老年肺癌患者的治疗效果、生存质量、免疫功能指标和炎症因子等的影响。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年12月解放军联勤保障部队第901医院收治的85例老年肺癌患者为研究对象,并根据不同的治疗方式分成实验组(n=42)与对照组(n=43)。实验组中,男性28例,女性14例;年龄62岁~92岁,平均(70.74±4.35)岁;鳞癌18例,腺癌24例;转移情况:14例恶性胸腔积液,10例肝转移,7例骨转移,6例肺内转移,其他5例。对照组中,男性27例,女性16例;年龄63岁~91岁,平均(70.05±4.41)岁;鳞癌20例,腺癌23例;转移情况:15例恶性胸腔积液,9例肝转移,7例骨转移,5例肺内转移,其他7例。实验组和对照组的性别、年龄、肺癌病理类型、转移情况等一般资料比较,差异无统计学意义(P>0.05)。纳入标准:(1)患者及家属对研究知情,并签订医院伦理委员会批准的知情同意书;(2)参照《中华医学会肺癌临床诊疗指南(2018版)》中的诊断标准[5],明确患者的肺癌患病情况,临床症状符合非小细胞肺癌,且经影像学检查与病理检查确诊;(3)无化疗禁忌症;(4)研究期间未同时进行放疗和靶向治疗等其他治疗。排除标准:(1)肝肾功能或心脏功能不全;(2)罹患精神疾病或存在语言障碍;(3)依从性较差或中途退出研究的患者。
1.2 方法
1.2.1 对照组 采用对症治疗方法,依据患者及家属意愿不实施化疗,仅采取雾化、化痰、补抗炎及营养支持质量方法。
1.2.2 实验组 采取姑息化疗方案,以患者病例检查分析结果和不良反应等为基础,制定化疗方案,主要是使用25~30 mg/m2顺铂联合60 mg/m2多西紫杉醇,或75 mg/m2顺铂联合120 mg/m2依托泊苷治疗,每个周期化疗4次,28 d为1个周期,共治疗3个周期。治疗过程中观察病情变化及相关指标,有严重咯血等症状的患者,停止治疗,实施对症治疗,情况稳定后再决定是否继续化疗。
1.3 观察指标和判定标准
(1)肺癌疗效评估依据联合国世界卫生组织(World Health Organization,WHO)实体瘤评价标准[6],病灶完全消失为完全缓解(complete response,CR),病灶缩小达到50%为部分缓解(partial response,PR),病灶缩小不足50%或是扩大不足25%为稳定(stable disease,SD),病灶扩大25%及以上为进展(progressive disease,PD),肺癌控制率=(CR+PR+SD)/总例数×100%。(2)在患者化疗3个周期后1周评估其生存质量,使用欧洲癌症研究与治疗组织制定的生存质量核心量表(QLQ-C30)[7]进行评估,包括1个整体生活质量量表、3个症状量表、5个功能量表和6个单项症状量表;整体量表和功能量表分数越高,表示功能越好;症状量表分数越高,表示症状越严重,生活质量越差。(3)在治疗前与治疗3个周期后,分别采集两组患者的外周血样本,并使用流式细胞仪(贝克曼CytoFLEX)检测CD3+、CD4+、CD8+、CD4+/CD8+水平。清晨空腹取静脉血4 mL、5 mL各1份,血液样本经2 000 rpm离心10 min,取上清液,进行血清标号,于-80 ℃保存。其中,4 mL静脉血样本采用流式细胞仪测定抑制/细胞毒性T淋巴细胞(CD3+、CD4+、CD8+)[人CD3分子(CD3)ELISA检测试剂盒,泉州市九邦生物科技有限公司]、以及辅助/诱导T淋巴细胞(CD3+、CD4+、CD8-)等的百分比,计算辅助/抑制T淋巴细胞(CD4+/CD8+)比值。另外,5 mL的静脉血样本先以3 500 rpm转速将血液样本离心20 min,再使用全自动血细胞检测仪(贝克曼CytoFLEX)检测白细胞(white blood cell,WBC)的水平,再分别使用C-反应蛋白(C-reactive protein,CRP)ELISA试剂盒(上海凯创生物技术有限公司,沪食药监械(准)字2012第2401021号)和降钙素原(procalcitonin,PCT)检测试剂盒(基蛋生物科技股份有限公司,苏械注准20162401534)检测CRP和PCT的表达水平。(4)参照CTCAE第四版中的恶性肿瘤不良反应[8],记录两组患者治疗期间发生不良反应的情况,并根据严重程度将其分为不同等级。其中,1级为轻度不良反应,即无症状或有轻微症状,仅为临床或是诊断所见,不需要治疗;2级为中度不良反应,需要进行较小的、局部或非侵入治疗;3级为严重不良反应,反应严重但不会危及生命安全,而住院时间延长,日常生活受限;4级为危及生命的不良反应,需要接受紧急治疗。
1.4 统计学分析
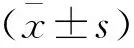
2 结果
2.1 两组临床疗效对比
实验组的肺癌总控制率为88.10%,高于对照组的67.44%(P<0.05)。见表1。
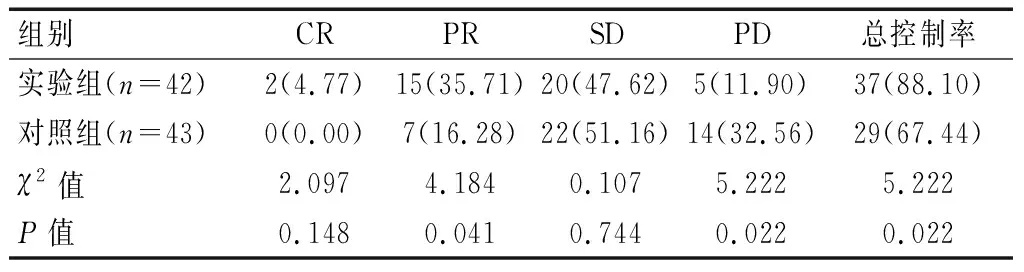
表1 两组临床疗效对比[n(%)]
2.2 两组治疗后的生存质量对比
实验组的整体生活质量评分高出对照组(P<0.05),生活质量优于对照组;功能方面:实验组情绪和认知功能评分高出对照组(P<0.05),躯体、角色和社会功能评分略高于对照组,但无统计学意义(P>0.05);症状方面:实验组的疲乏、疼痛、恶心呕吐,及失眠、呼吸困难、腹泻、便秘、食欲丧失等症状的评分均低于对照组,症状改善效果更佳(P<0.05);两组的经济困难评分比较,差异无统计学意义(P>0.05)。见表2。

表2 两组治疗后的QLQ-C30评分对比分)
2.3 治疗后两组的免疫功能指标和炎症因子水平对比
治疗前,两组的免疫功能指标和炎症因子水平均无明显差异(P>0.05);治疗后,实验组的CD3+和CD4+水平高于对照组(P<0.05),CD8+水平低于对照组(P<0.05),CD4+/CD8+高于对照组(P<0.05),实验组的免疫功能指标优于对照组;治疗后,实验组的WBC、CRP和PCT水平均低于对照组(P<0.05),实验组炎症因子水平显著下降。见表3及表4。
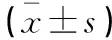
表3 治疗后两组的免疫功能指标水平对比
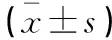
表4 治疗后两组的炎症因子水平对比
2.4 不良反应发生情况对比
实验组和对照组患者和均发现白细胞减贫血、脱发和肝功能下降(P>0.05),入组患者发生的不良反应大部分可耐受,无3级以上严重不良反应,未出现治疗相关性死亡病例。见表5。
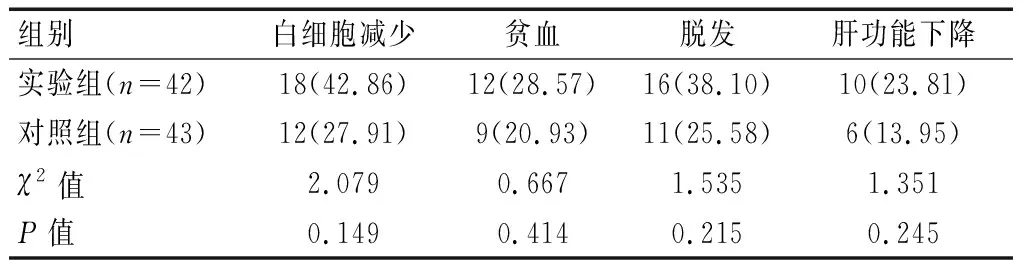
表5 两组的不良反应发生情况对比[n(%)]
3 讨论
近些年来,鉴于癌症病发率日益增高,癌症患者的生存质量颇受重视。其中,老年肺癌患者进行化疗可在一定程度上缓解病情,延长生存期,改善生存质量。
本研究表明,接受姑息化疗的老年肺癌患者,疾病控制率可有效提升,疲乏、疼痛、恶心呕吐,以及失眠、呼吸困难、腹泻、便秘、食欲丧失等不良症状缓解,情绪功能和认知功能有所改善,免疫功能和炎症因子水平也明显优于常规治疗的患者。尽管姑息化疗患者的不良反应发生率略高,但并未产生3级及以上严重不良反应和治疗相关性死亡,安全性仍在合理范围内。既往研究[9-11]发现,肺癌患者的细胞免疫功能明显改善,而炎症因子水平改善不显著。这与本研究既有一致性又有一定的差异。肿瘤患者临床治疗中,淋巴细胞亚群指标水平能够反映出治疗的敏感性,有助于评估治疗效果和预后。其中,CD8+淋巴细胞可抑制免疫应答的活化,使特异性抗肿瘤效应下降。
癌症患者在疾病等多种因素的影响下,生活质量会显著下降,尤其是对于身体机能较差的老年患者而言,对放化疗的耐受性较差,身心严重受创。刘冉冉等[11]研究发现,实施姑息治疗的患者,其生活质量处于较低水平,而影响患者生活质量的因素中,ECOG评分属于独立风险因素。早期或晚期肺癌患者实施早期姑息治疗可改善生活质量,延长生存期,降低便秘、抑郁等不良反应的发生率,是肺癌综合治疗的重要内容之一[12-14]。对于老年肺癌患者而言,生存期与生存质量是治疗的关键目标,但由于身体机能和营养状态较差,不少患者接受化疗的意愿较低[15-16]。因此,医护人员对患者进行科学的健康教育和心理疏导有一定的必要性[17-18]。对于肿瘤医学及姑息医学人员来说,需较准确地掌握相关临床知识,以有效评估患者生存期和生存质量的能力,再在此基础上为患者设计合适的治疗方案[19-20]。
综上所述,姑息化疗治疗可在一定程度上改善老年肺癌患者的临床预后,恢复部分身体机能,降低临床症状的严重程度,但无法避免白细胞减贫血、脱发和肝功能下降等不良反应的发生。

