槲皮素对小鼠肺缺血再灌注损伤的保护作用及机制研究
刘文,康凯,张健楠,种阳,赵鸣雁
(哈尔滨医科大学附属第一医院重症医学科,黑龙江 哈尔滨 150001)
肺缺血再灌注损伤(lung ischemia-reperfusion injury,LIRI)可发生于肺移植、肺切除、心脏骤停和肺栓塞患者,其引起的肺功能障碍是急性肺损伤(acute lung injury,ALI)的重要危险因素,预示患者预后较差[1]。LIRI病理机制复杂,涉及炎症反应、氧化应激和细胞凋亡等[2],靶向于无菌炎症反应和氧化应激是减轻患者LIRI和改善预后的主要治疗策略[3]。槲皮素是一种黄酮类化合物,广泛存在于较多蔬菜、水果和饮料中,具有抗炎、抗增殖和抗氧化等多种药理学活性[4-5]。研究[6-10]发现,槲皮素对多种肺损伤模型均有保护作用,通过诱导血红素加氧酶-1(HO-1)抑制肺上皮细胞的氧化应激,并通过调节抗氧化剂基因的表达减少,可缓解百草枯介导的氧化损伤;通过与广泛的细胞靶标相互作用,可减少炎症性细胞因子和生长因子的表达及粘蛋白的分泌,降低金属蛋白酶的活性,减轻香烟中烟气引起的大鼠气道炎症和粘液产生,而其抗小鼠肺缺血再灌注损伤的活性尚未阐明。本研究旨在探讨槲皮素对LIRI的保护作用及可能的机制。
选择-0.074 mm占41.41%、60.00%、80.00%、89.29%、99.59%的磨矿细度进行细度试验。磁性分析表明该矿以强磁性矿物为主,故磨矿细度试验采用弱磁选,弱磁选条件:磁场强度110.00 kA/m,给矿浓度35.00%。试验结果见表6。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性小鼠40只,体质量28~32 g。动物分笼饲养于SPF级动物房,自由饮水和饮食,12 h交替光照,湿度21~23 ℃,所有动物试验均经过伦理委员会批准同意。将小鼠随机分为对照组、模型组、槲皮素低剂量组、中剂量组和高剂量组,每组各 8只。
三个月说到就到,这天,又到交房租的日子,老梅打电话告诉李老鬼,说下午在家等他。李老鬼不愿意见老梅,给王鲶鱼借一千二百元钱,让李叔和送过来。李叔和来到她家的时候,她正和几个女人打麻将。
1.1.2 主要试剂 槲皮素(B20527-1g)购买于上海源叶生物;Anti-p-AKT(protein kinase B,#13038)、AKT(#4685)、p-PI3K(phosphatidylinositide 3-kinases,#17366)、p-IκBα(Inhibitor of NF-κB,#2859)、p-p65(#3033)、p65(#8242)和β-Actin(#4970)抗体购于美国Cell signal公司,均为兔源;髓过氧化物酶(myeloperoxidase,MPO)、丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒购自南京建成生物公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin- 6,IL-6)和白细胞介素-1β(Interleukin-1β,IL-1β)小鼠ELISA试剂盒购于杭州联科生物生物技术股份有限公司。
1.2 方法
1.2.1 给药方法 槲皮素低剂量组(2.5 mg/kg)、中剂量组(5 mg/kg)、高剂量组(10 mg/kg)小鼠灌胃给予对应剂量的槲皮素;对照组和模型组给予等体积生理盐水,连续5 d,最后一次给药60 min后,麻醉小鼠进行后续实验。
1.2.7 TNF-α、IL-6和IL-1β测量 收集小鼠血清和肺组织匀浆上清液,酶联免疫吸附试验(ELISA)测量小鼠血清和肺组织TNF-α、IL-6和IL-1β的含量,操作严格按试剂盒说明书进行。
1.2.5 肺组织W/D测量 处死小鼠后,立即称重左肺下叶(即湿重),然后在60 ℃干燥24 h至恒重称量(即干重),计算W/D值。
HE染色显示,与对照组比较,模型组小鼠肺泡壁水肿,肺间质增厚,肺泡结构破坏和肺泡腔内大量炎性细胞浸润,肺损伤评分增加(P<0.05);槲皮素各剂量组小鼠较模型组上述病理变化缓解,肺损伤评分降低(P<0.05)。模型组小鼠肺W/D值(7.50±0.36)高于对照组(3.10±0.47)(P<0.05),槲皮素低、中、高剂量组小鼠肺W/D值(7.00±0.38、5.80±0.52、4.86±0.48)较模型组减小(P<0.05)。见图1。
1.2.3 苏木精-伊红(HE)染色 将小鼠肺组织于4 %多聚甲醛中固定24 h,石蜡包埋,切片机切片,厚度4 μm。二甲苯除蜡脱水,苏木精染色5 min,盐酸乙醇分化30 s,水浸泡15 min;伊红染色2 min;常规脱水、透明、密封。
1.2.8 蛋白免疫印迹(Western blot) 称取左肺组织50 mg,加入含有蛋白酶抑制剂混合物和磷酸酶抑制剂混合物的RIPA缓冲液,匀浆。4 ℃ 13 000 rpm离心20 min,收集上清, BCA蛋白定量。每泳道上样20 μg蛋白质于聚丙烯酰胺凝胶,电泳分离后,将蛋白转于PVDF膜;用稀释后的特异性一抗(Anti-p-AKT、AKT、p-PI3K、p-IκBα、p-p65、p65和β-Actin,稀释比例 1∶1 000)与膜4 °C孵育过夜;洗膜,HRP-二抗室温孵育60 min后,用增强型化学发光(ECL)试剂盒曝光显色。
1.2.2 LIRI小鼠模型建立[11]小鼠腹膜内注射10%水合氯醛(4.5 mL/kg)麻醉,RSP1002型小动物呼吸机辅助机械通气,呼吸比(吸入/呼出空气)1∶1,呼吸频率80次/min,潮气量10 mL/kg,吸氧分数100%。观察到肺塌陷和扩张后开胸,用微血管钳将左肺门肺血管(包括肺动脉,静脉和支气管)闭塞60 min,再灌注120 min,缝合胸腔切口。术后2 h,小鼠眼球取血,脱颈椎处死。分离小鼠左肺下叶部分用于后续试验。通过检测肺湿干重比值(W/D)、观察病理变化验证建模成功与否。
1.2.6 肺组织MPO、MDA和SOD测量 收集肺组织,加入生理盐水,组织匀浆,4 ℃ 2 000 rpm离心15 min,收集上清,比色法测量肺组织MPO、MDA和SOD含量,操作严格按试剂盒说明书进行。
1.3 统计学分析
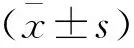
2 结果
2.1 各组小鼠LIRI肺组织形态学变化及损伤评分比较
1.2.4 肺损伤组织学评分 包括肺泡充血、肺泡壁增厚和水肿、肺泡细胞浸润3项内容,每项0~ 3分; 0分为无损伤,1分为轻度损伤,2分为中度损伤,3分为严重损伤[12]。
只有学生在真正的理解与掌握了电荷作用力后,才可以明确的找到库仑定律中所包含的关键性的知识点。因此,在引导学生探索库仑定律之前,首先要对电荷作用力进行深入的探究。教师在设计课堂实验的时候,可以选择悬挂小球的实验,将3个小球悬挂在铁支架下侧的位置,接着让学生分析小球自身承受的作用力。通过这一实验的演示,对于电荷彼此的作用应以f来表示,悬挂线和竖直方向的夹角以a来表示,小球的质量以m来表示。由此可见,通过观察夹角的大小,便可以归纳出电荷作用力。
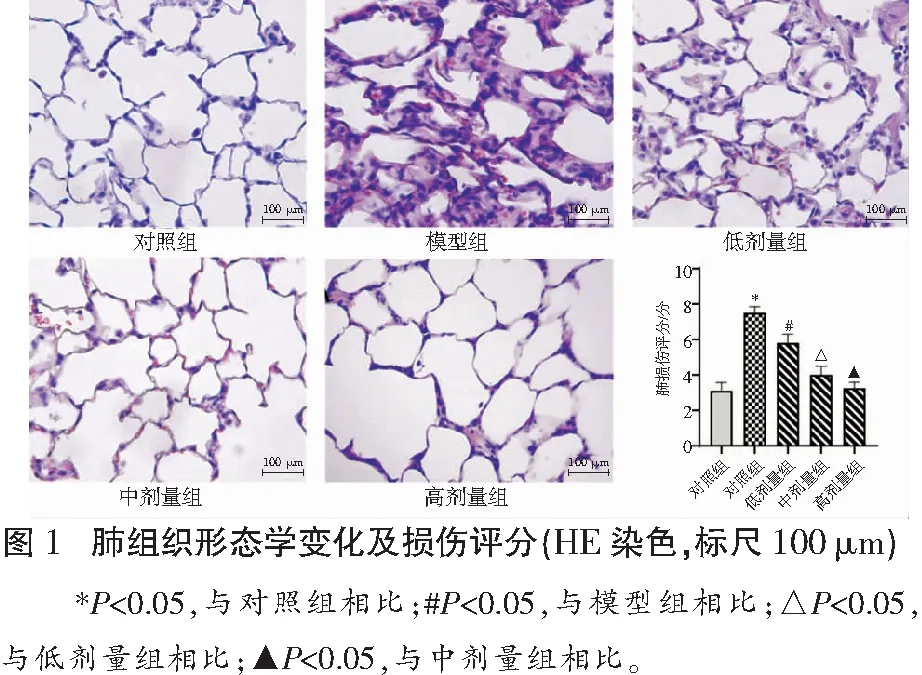
2.2 各组小鼠肺组织MPO、MDA及SOD含量比较
模型组小鼠肺组织MPO和MDA含量高于对照组(P<0.05),SOD含量低于对照组(P<0.05);槲皮素中剂量和高剂量组小鼠肺组织MPO和MDA含量低于模型组(P<0.05),SOD含量高于模型组(P<0.05)。见表1。
首先是药品智能化物流管理系统。药品供应是医疗保障的重要部分,医院采用了先进的药品智能化物流管理系统,实现了药品采购计划生成智能化、采购计划网上传输、药库库位智能化管理、药库主动补货、药房药品智能发放、药品追溯等功能。有效提高了药品供应效率,减少了人为因素。
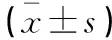
表1 各组小鼠肺组织MPO、MDA及SOD含量比较
2.3 各组小鼠肺组织TNF-α、IL-1β及IL-6含量比较
模型组小鼠血清TNF-α、IL-1β和IL-6含量高于对照组(P<0.05);槲皮素低、中、高剂量组小鼠血清TNF-α、IL-1β和IL-6含量低于模型组(P<0.05),且槲皮素高剂量组<中剂量组<低剂量组(P<0.05)。见表3。
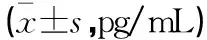
表2 各组小鼠肺组织TNF-α、IL-1β及IL-6含量比较
2.4 各组小鼠血清TNF-α、IL-6及IL-1β含量比较
模型组小鼠肺组TNF-α、IL-1β及IL-6含量高于对照组(P<0.05);槲皮素低、中、高剂量组小鼠肺组织TNF-α、IL-1β及IL-6含量低于模型组(P<0.05),且槲皮素高剂量组<中剂量组<低剂量组(P<0.05)。见表2。
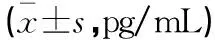
表3 各组小鼠血清TNF-α、IL-1β及IL-6含量比较
2.5 各组小鼠肺组织PI3K-AKT-NFκB蛋白表达量比较
模型组小鼠肺组织中p-p65/p65、p-IκBα、p-AKT/AKT及p-PI3K蛋白表达量高于对照组(P<0.05);槲皮素低、中、高剂量组小鼠肺组织p-p65/p65、p-IκBα、p-AKT/AKT及p-PI3K蛋白表达量低于模型组(P<0.05),且槲皮素高剂量组<中剂量组<低剂量组(P<0.05)。见图2及表4。
比较1990—2015年我国与上述样本库中部分国家的HDI指标,我国于2011年后HDI指标正式步入0.7,根据联合国开发计划署(UNDP)定义,“中等发展水平国家”变成“发展水平较高国家”。因此,上述HDI指标对于我国经济发展所处不同阶段具有较好的刻画作用(见图1)。
慢性病患者的就医行为主要发生在门诊[13]和自购药品[14]上,高血压长期而频繁的门诊治疗和疾病管理所花费的医疗费用是因病致贫的主要原因[15]。研究证实,收入较低的患者面临着较高的门诊就诊经济风险,高血压患者的门诊自付费用对患者家庭发生CHE存在着显著影响。
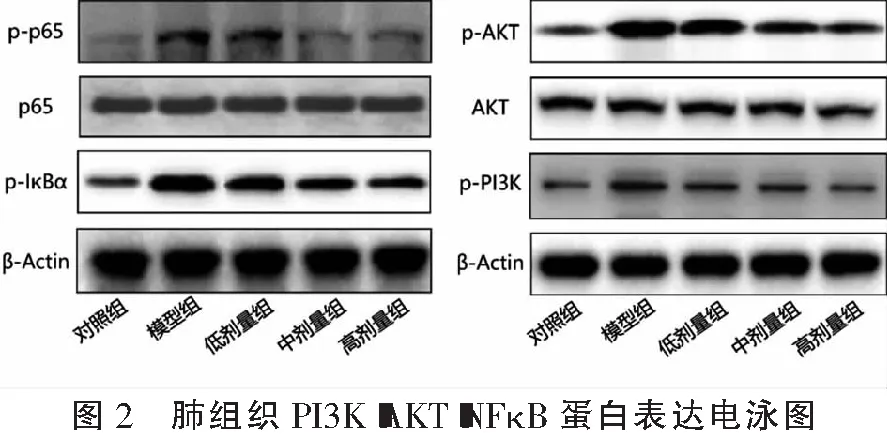
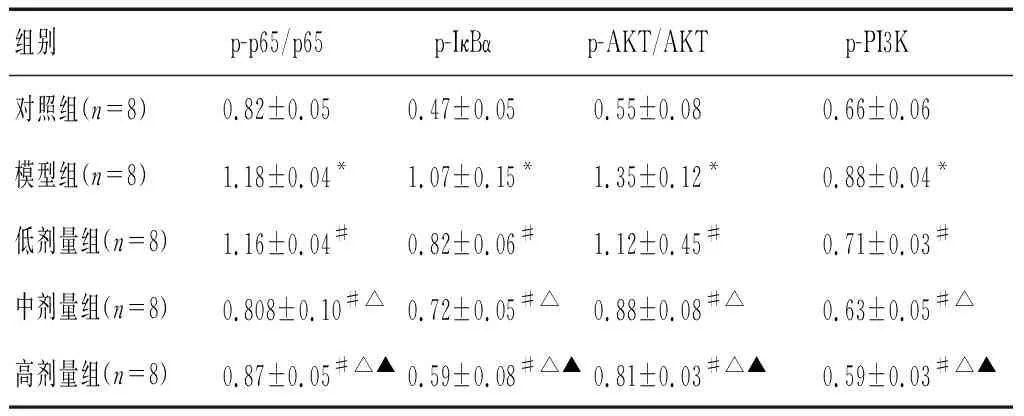
表4 各组大鼠PI3K-AKT-NFκB蛋白表达量比较
3 讨论
有研究[13]报道,炎症因子可引起肺泡-毛细血管屏障的肺通透性增加,进而导致动脉血氧合损伤及水肿。另有研究[14-16]发现,许多天然类黄酮,如甘草查尔酮A、千层纸素A和黄芪素均可通过抑制炎性细胞因子分泌缓解肺损伤。本研究发现,槲皮素预处理可减轻I/R肺损伤小鼠的肺泡壁增厚和炎性细胞浸润,并降低了肺湿/干重比(P<0.05),表明槲皮素对LIRI和水肿有保护作用。TNF-α、IL-6和IL-1β是机体炎症反应的重要参与因子。TNF-α主要由单核巨噬细胞和淋巴细胞激活、产生和释放,是一种强大的炎症介质。研究[17]表明,TNF-α可以增加肺泡毛细血管通透性,减少肺泡中液体的清除能力,与IL-1β具有相似的作用。中性粒细胞是促炎性细胞因子的重要来源,中性粒细胞浸润是急性肺损伤的重要标志。本研究发现,模型组比较,槲皮素降低了I/R肺损伤小鼠炎症因子TNF-α、IL-6和IL-1β含量(P<0.05),表明槲皮素可能通过抑制炎症反应发挥抗急性肺损伤作用。
LIRI与过度氧化应激有关。研究[18]发现,过量ROS会导致脂质过氧化和其他有害的氧化反应,从而导致细胞死亡或凋亡。MDA是脂质过氧化作用的最终产物,其含量反映了组织中脂质过氧化的程度。本研究发现,与对照组相比,模型组小鼠肺组织中MDA含量增加(P<0.05),表明LIRI脂质过氧化增强;但与模型组比较,槲皮素组小鼠组织MDA含量降低(P<0.05),表明槲皮素可以缓解脂质过氧化。SOD是肺组织中主要的内源性抗氧化剂,各种内源性抗氧化剂(如过氧化氢酶,GSHPx等)和非酶性抗氧化剂(如维生素C,维生素E等)共同构成了抗氧化剂系统,可以清除氧自由基并保持体内平衡[19]。因此,SOD可反映抗氧化程度。另外,组织MPO活性是嗜中性粒细胞浸润的关键指标[6]。本研究发现,槲皮素升高了急性肺损伤小鼠组织SOD含量和MPO活性(P<0.05),表明槲皮素对LIRI有预防作用,可能与提高抗氧化酶和减少氧化应激密切相关。
NF-κB信号既是调节炎症因子(IL-1β、TNF-α和IL-6)释放的重要通路,也是炎症因子表达的重要转录因子[20]。病理条件下,NF-κB信号通路激活,IKK活化,进而促进IκBα磷酸化降解,引起p65磷酸化,调节炎症因子的转录表达。有研究[21]报道,阻断NF-κB信号通路可以发挥抗炎和抗氧化作用,并缓解LIRI。此外,PI3K/AKT途径与细胞存活、增殖和氧化应激密切相关,但PI3K/Akt途径对LIRI的具体作用不清楚[22],可能与PI3K/AKT信号通过降解IκBα激活NF-κB信号通路有关[23]。本研究发现,与对照组相比,模型组小鼠肺组织p-PI3K、p-AKT和p-p65表达升高(P<0.05),表明PI3K/Akt介导的NF-κB信号通路与急性肺损伤的病理变化密切相关[24]。槲皮素组小鼠肺组织p-PI3K、p-Akt和p-p65的表达降低(P<0.05),表明槲皮素可以抑制PI3K-AKT-NF-κB信号通路发挥抗急性肺损伤作用。
综上,槲皮素能有效改善小鼠LIRI,机制可能与抑制PI3K-AKT-NFκB信号通路有关,其具体机制及对PI3K-AKT-NF-κB途径的调节是直接作用还是间接仍需进一步研究。

